Localisés vs délocalisés
La distinction entre « localisés » et « délocalisés » n’existe que lorsque nous décrivons le mouvement des électrons en utilisant la théorie de la liaison de Lewis.
Selon cette théorie, les électrons localisés ont un comportement normal. Une paire solitaire localisée reste proche d’un atome. Une paire de liaison localisée se déplace entre deux atomes.
Les hybrides de résonance contiennent nécessairement quelques électrons « anormaux ». Une paire solitaire peut sembler avoir certaines caractéristiques de liaison ; au lieu de rester près d’un atome, elle visite deux atomes. Une paire de liaison peut sembler se déplacer entre deux paires d’atomes différentes. Ces électrons sortent des limites que la théorie de Lewis leur a fixées, et nous les considérons comme délocalisés.
La façon la plus simple de repérer les électrons délocalisés est de comparer les emplacements des électrons dans deux formes de résonance. Si une paire apparaît à un endroit dans une forme, et à un endroit différent dans une autre forme, la paire est délocalisée.
Vous pouvez voir un comportement délocalisé dans les formes de résonance I et II ci-dessous. Les deux formes contiennent deux paires d’électrons délocalisées. Pouvez-vous les trouver ? Quel type de paires d’électrons sont délocalisées dans chaque structure ?
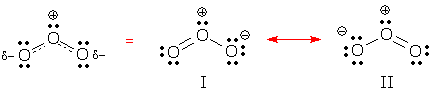
(Réponse : ces formes contiennent une paire de liaison délocalisée et une paire solitaire délocalisée.)
Les liaisons délocalisées et les charges délocalisées
L’étiquette « délocalisée » s’applique également aux liaisons et aux charges.
Une liaison délocalisée est une liaison qui apparaît dans certaines formes de résonance, mais pas dans d’autres. La forme de résonance I contient 2 liaisons localisées et 1 liaison délocalisée.
Une charge délocalisée est une charge formelle qui apparaît sur un atome dans certaines formes de résonance et sur d’autres atomes dans d’autres formes. La charge négative de l’ozone est délocalisée sur les deux O d’extrémité, alors que la charge positive est localisée sur le O central.