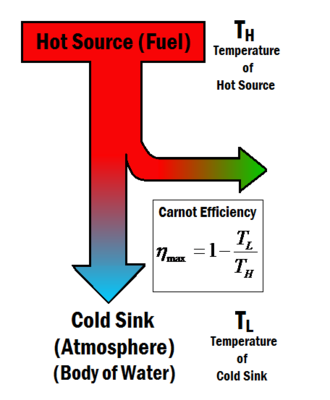
Figure 1 : Une source chaude fournit l’énergie nécessaire pour produire du travail dans un processus thermodynamique. Le rendement de Carnot ne dépend que de la température de la source chaude et du puits froid.
Le rendement de Carnot décrit l’efficacité thermique maximale qu’un moteur thermique peut atteindre comme le permet la deuxième loi de la thermodynamique. Cette loi a été dérivée par Sadi Carnot en 1824. Carnot a réfléchi à l’idée d’un rendement maximal dans un moteur thermique, se demandant si le rendement d’un moteur thermique pouvait approcher les 100 % ou s’il existait une limite supérieure à ne pas dépasser. La réponse s’est avérée être qu’il existe une valeur maximale, et Carnot a développé un moteur idéal qui donnerait théoriquement ce rendement, connu sous le nom de moteur de Carnot. Le rendement maximal, connu sous le nom de rendement de Carnot , ne dépend que des températures de la source chaude et du puits froid et , comme le montre la figure 1, et est donné par l’équation ci-dessous
(1)
La deuxième loi exige que la chaleur perdue soit produite dans un processus thermodynamique où le travail est effectué par une source de chaleur. Un tel processus est donné par l’équation
(2)
Avec un rendement thermique de
(3)
Où :
- est la chaleur fournie au système à partir d’un combustible
- est la chaleur cédée par le système au puits froid connu sous le nom de chaleur perdue
- est le travail utile réalisé par le système
Donc, le rendement de Carnot donne une quantité maximale atteignable de travail de tout moteur thermique. L’équation 1 montre qu’en augmentant ou en diminuant le rendement, on peut l’augmenter. Idéalement, il faudrait donc que la température du puits froid soit égale au zéro absolu, mais on sait que c’est impossible. En réalité, le puits froid est l’environnement de la Terre. Cela signifie que le puits froid se trouve à une température d’environ 280-300 kelvins, et que les sources chaudes proviennent de combustibles brûlant à une température d’environ 1100 kelvins (bien que la recherche essaie toujours de faire monter cette température). Ces températures donnent une valeur de rendement de Carnot de ou environ.
Moteur de Carnot
Un moteur de Carnot est un moteur idéalisé, utilisant des processus qui ont des interactions mécaniques et thermiques réversibles. Cela signifie que le moteur peut effectuer ses mouvements et revenir à son état initial sans augmentation de l’entropie (sans perte d’énergie). Pour que le moteur puisse revenir à son état initial sans augmenter l’entropie, il doit être en équilibre thermique tout au long de son cycle. Les conditions pour qu’un tel moteur existe sont :
- Interactions mécaniques : aucune énergie n’est perdue sous forme de frottement, il n’y a donc pas de transfert de chaleur lors de ces processus mécaniques (), dit processus adiabatique.
- Interactions thermiques : le transfert de chaleur est infiniment lent (dit quasi-statique). Cela signifie que la différence de température entre le système et la chaleur d’entrée/sortie est très proche de la même, ce qui fait que le transfert de chaleur se fait sur un temps infini. Ces échanges doivent se faire en maintenant constante la température interne du système, ce que l’on appelle un processus isotherme.
Un moteur qui ne possède que ces propriétés est connu sous le nom de moteur de Carnot, qui est un « moteur parfaitement réversible », et présente le rendement thermique maximal () et, s’il fonctionne comme un réfrigérateur, le coefficient de performance (). Bien qu’un tel moteur maximise le rendement, en termes d’efficacité, il est terriblement impraticable puisque ses processus idéalisés prennent tellement de temps pour produire une quantité significative de travail. Comme le dit Schroeder, « ne vous donnez pas la peine d’installer un moteur de Carnot dans votre voiture ; certes, il augmenterait votre consommation d’essence, mais vous vous feriez doubler par des piétons ».
Pour en savoir plus sur le moteur de Carnot, visitez le site de la NASA ou celui d’hyperphysics.