Stabilità degli intermedi di carbocationi
Sappiamo che il passo limitante la velocità di una reazione SN1 è il primo passo: la formazione di questo intermedio di carbocationi. La velocità di questo passo – e quindi, la velocità della reazione di sostituzione globale – dipende dall’energia di attivazione per il processo in cui il legame tra il carbonio e il gruppo di partenza si rompe e si forma un carbocatione. Secondo il postulato di Hammond (sezione 6.2B), più stabile è l’intermedio carbocationico, più velocemente avverrà questo primo passo di rottura del legame. In altre parole, la probabilità che una reazione di sostituzione nucleofila proceda con un meccanismo dissociativo (SN1) dipende in larga misura dalla stabilità dell’intermedio carbocationico che si forma.
La domanda critica ora diventa: cosa stabilizza un carbocation?
Quindi, se ci vuole un gruppo che sottrae elettroni per stabilizzare una carica negativa, cosa stabilizzerà una carica positiva? Un gruppo donatore di elettroni!
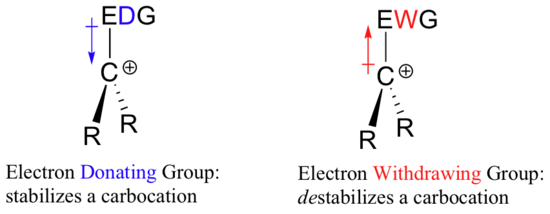
Una specie carica positivamente come un carbocation è molto povera di elettroni, e quindi tutto ciò che dona densità di elettroni al centro di povertà elettronica aiuterà a stabilizzarla. Al contrario, un carbocation sarà destabilizzato da un gruppo che toglie elettroni.
I gruppi alchilici – metile, etile e simili – sono gruppi deboli che donano elettroni, e quindi stabilizzano i carbocationi vicini. Ciò significa che, in generale, i carbocationi più sostituiti sono più stabili: un carbocationo tert-butilico, per esempio, è più stabile di un carbocationo isopropilico. I carbocationi primari sono altamente instabili e non si osservano spesso come intermedi di reazione; i carbocationi metilici sono ancora meno stabili.
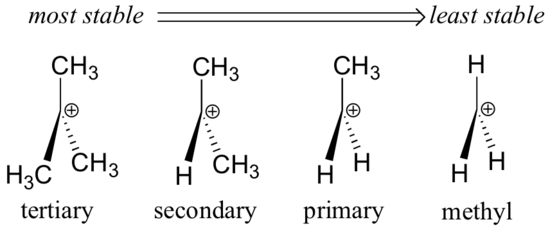
I gruppi alchilici donano elettroni e stabilizzano i carbocationi perché gli elettroni attorno ai carboni vicini sono attirati verso la vicina carica positiva, riducendo così leggermente la povertà di elettroni del carbonio con carica positiva.
Non è esatto dire, tuttavia, che i carbocationi con maggiore sostituzione sono sempre più stabili di quelli con meno sostituzione. Così come i gruppi elettron-donatori possono stabilizzare un carbocatione, i gruppi elettron-donatori agiscono per destabilizzare i carbocationi. I gruppi carbonilici sono elettron-detrattori per effetto induttivo, a causa della polarità del doppio legame C=O. È possibile dimostrare in laboratorio (vedi sezione 16.1D) che il carbocatione A è più stabile del carbocatione B, anche se A è un carbocatione primario e B è secondario.
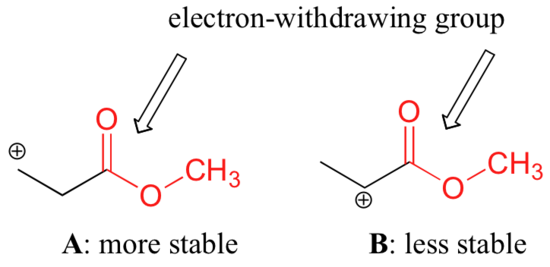
La differenza di stabilità può essere spiegata considerando l’effetto induttivo di rimozione di elettroni del carbonile estere. Ricordiamo che gli effetti induttivi – sia che si tratti di elettroni che sottraggono o donano – sono trasmessi attraverso legami covalenti e che la forza dell’effetto diminuisce rapidamente all’aumentare del numero di legami intermedi. In altre parole, l’effetto diminuisce con la distanza. Nella specie B la carica positiva è più vicina al gruppo carbonilico, quindi l’effetto destabilizzante dell’elettrone-rifiuto è più forte che nella specie A.
Nel prossimo capitolo vedremo come l’effetto destabilizzante dei carbocationi dei sostituenti del fluoro con elettroni-rifiuto può essere usato in esperimenti progettati per risolvere la questione se una reazione di sostituzione nucleofila biochimica sia SN1 o SN2.
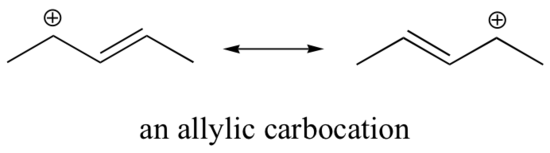
La stabilizzazione di un carbocatione può avvenire anche attraverso effetti di risonanza, e come abbiamo già discusso nel capitolo acido-base, gli effetti di risonanza come regola sono più potenti degli effetti induttivi. Consideriamo il semplice caso di un carbocatione benzilico:
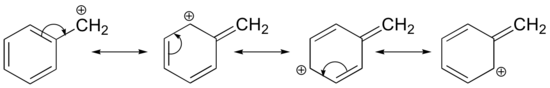
Questo carbocatione è relativamente stabile. In questo caso, la donazione di elettroni è un effetto di risonanza. Tre strutture di risonanza supplementari possono essere disegnate per questo carbocation in cui la carica positiva si trova su uno dei tre carboni aromatici. La carica positiva non è isolata sul carbonio benzilico, ma è delocalizzata intorno alla struttura aromatica: questa delocalizzazione di carica provoca una stabilizzazione significativa. Di conseguenza, i carbocationi benzilici e allilici (dove il carbonio con carica positiva è coniugato a uno o più doppi legami non aromatici) sono significativamente più stabili anche dei carbocationi alchilici terziari.
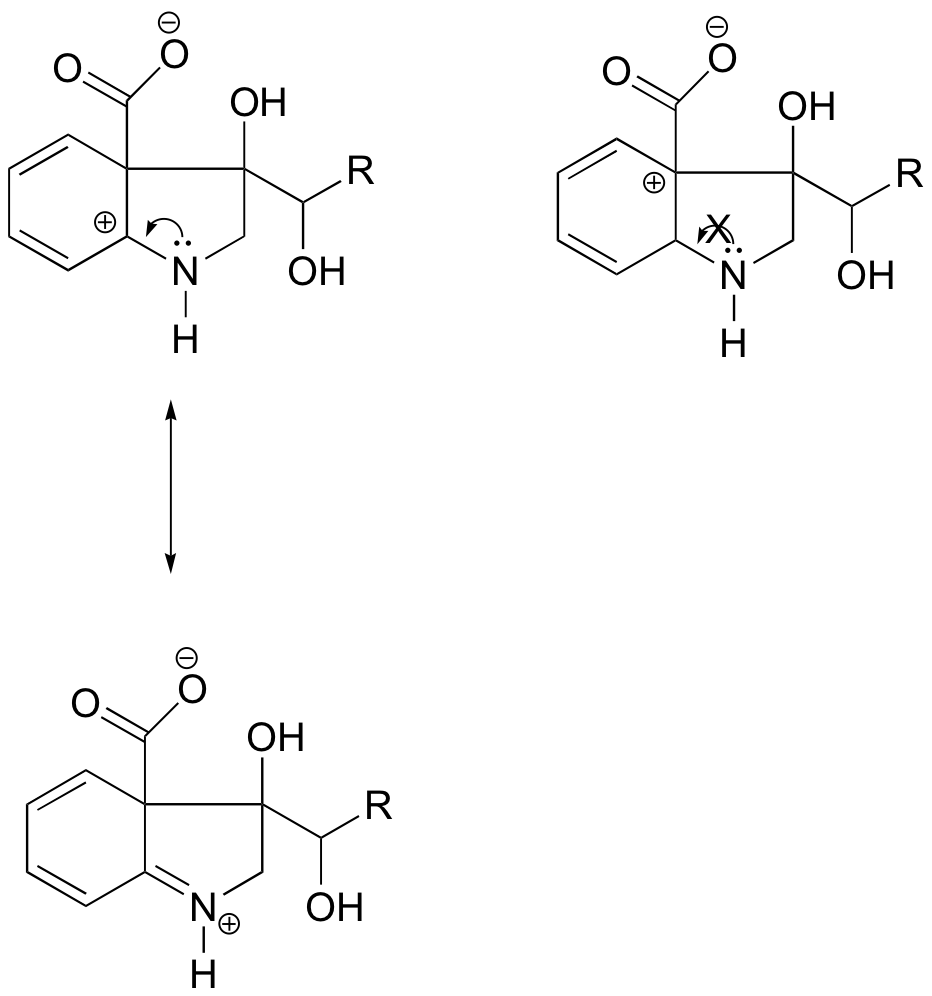
Perché gli eteroatomi come l’ossigeno e l’azoto sono più elettronegativi del carbonio, ci si potrebbe aspettare che siano per definizione gruppi che ritirano elettroni e destabilizzano i carbocationi. In realtà, è spesso vero il contrario: se l’atomo di ossigeno o di azoto è nella posizione corretta, l’effetto complessivo è la stabilizzazione dei carbocationi. Ciò è dovuto al fatto che anche se questi eteroatomi sono gruppi che sottraggono elettroni per induzione, sono gruppi che donano elettroni per risonanza, ed è questo effetto di risonanza che è più potente. (Abbiamo già incontrato questa stessa idea quando abbiamo considerato l’acidità e la basicità relativa dei fenoli e delle ammine aromatiche nella sezione 7.4). Consideriamo le due coppie di specie di carbocationi seguenti:
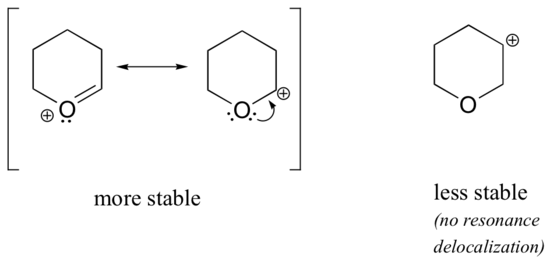
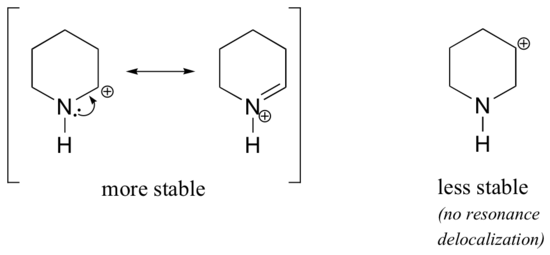
Nelle carbocationi più stabili, l’eteroatomo agisce come gruppo donatore di elettroni per risonanza: in effetti, la coppia solitaria sull’eteroatomo è disponibile per delocalizzare la carica positiva. Nelle carbocationi meno stabili, il carbonio con carica positiva si trova a più di un legame di distanza dall’eteroatomo, e quindi non sono possibili effetti di risonanza. Infatti, in queste specie di carbocationi gli eteroatomi destabilizzano effettivamente la carica positiva, perché ritirano elettroni per induzione.
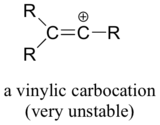
Infine, i carbocationi vinilici, in cui la carica positiva risiede su un carbonio a doppio legame, sono molto instabili e quindi è improbabile che si formino come intermedi in qualsiasi reazione.
Esempio 7.9.1
In quale delle strutture che seguono il carbocationo dovrebbe essere più stabile? Spiega.
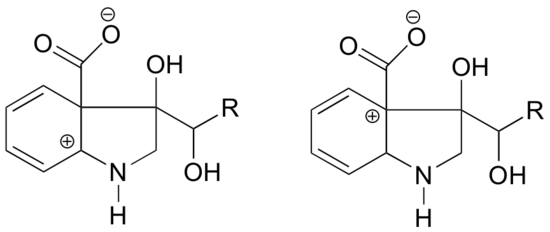
Risposta
Nel carbocation sulla sinistra, la carica positiva si trova in una posizione relativa all’azoto tale che la coppia solitaria di elettroni sull’azoto può essere donata per riempire l’orbitale vuoto. Questo non è possibile per la specie di carbocation sulla destra.
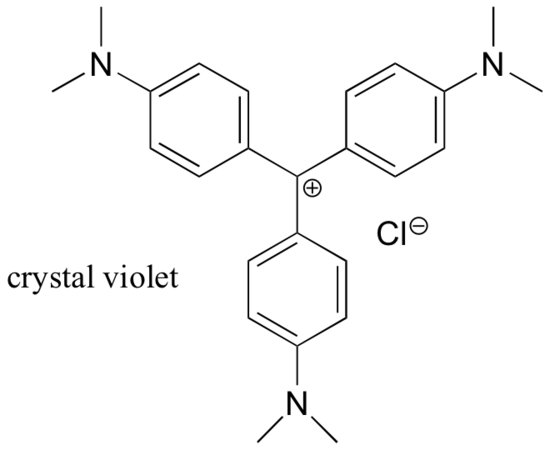
Per la maggior parte, i carbocation sono specie intermedie ad alta energia e transitorie nelle reazioni organiche. Tuttavia, ci sono alcuni esempi insoliti di carbocationi molto stabili che prendono la forma di sali organici. Il violetto di cristallo è il nome comune per il sale di cloruro del carbocatione la cui struttura è mostrata qui sotto. Notate le possibilità strutturali per un’estesa delocalizzazione di risonanza della carica positiva, e la presenza di tre gruppi amminici elettron-donanti.
Esempio 7.9.2
Disegna una struttura di risonanza del catione crystal violet in cui la carica positiva è delocalizzata su uno degli atomi di azoto.
Risposta 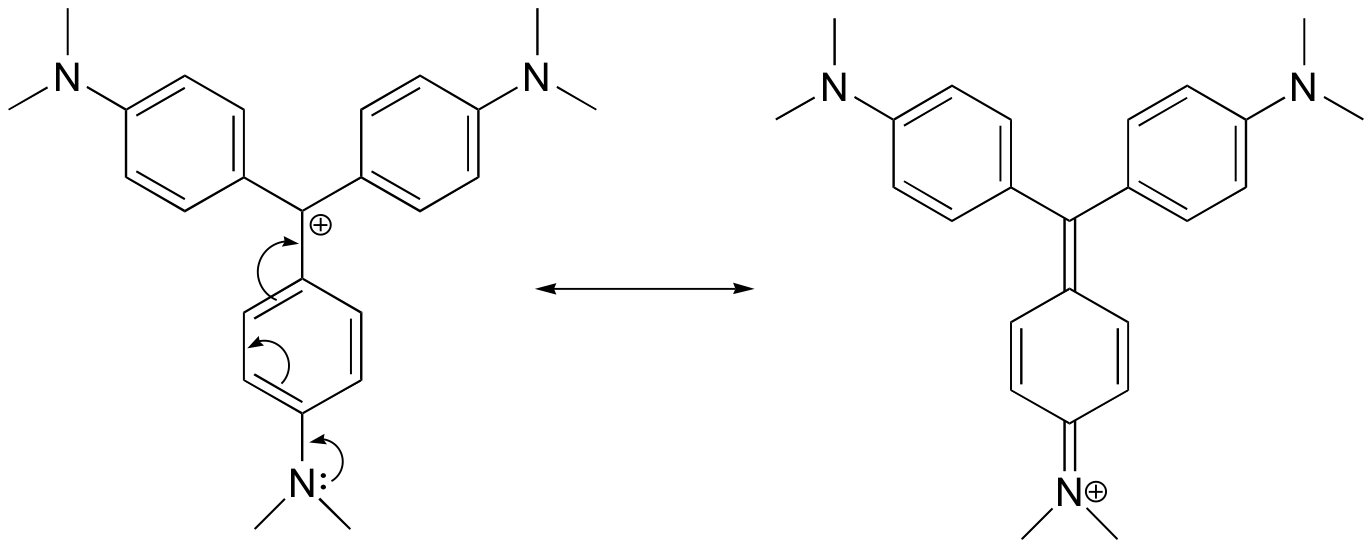
Quando si considera la possibilità che una reazione di sostituzione nucleofila proceda attraverso una via SN1, è fondamentale valutare la stabilità dell’ipotetico intermedio di carbocation. Se questo intermedio non è sufficientemente stabile, un meccanismo SN1 deve essere considerato improbabile, e la reazione probabilmente procede con un meccanismo SN2. Nel prossimo capitolo vedremo diversi esempi di reazioni SN1 biologicamente importanti in cui l’intermedio caricato positivamente è stabilizzato da effetti induttivi e di risonanza inerenti alla sua stessa struttura molecolare.
Esempio 7.9.3
Dimostra quale carbocation in ogni coppia sottostante è più stabile, o se si prevede che siano approssimativamente uguali. Spiega il tuo ragionamento.
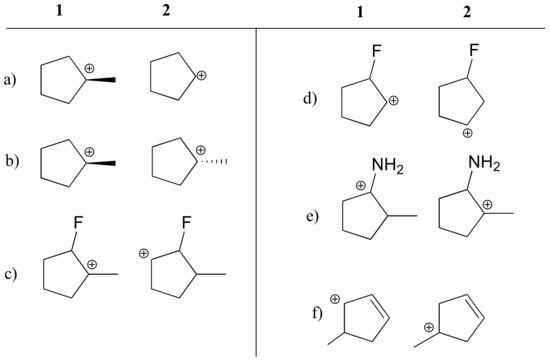
Risposta
a) 1 (carbocationi terziario vs. secondario)
b) uguale
c) 1 (carbocationi terziario vs. secondario)
. secondario)
d) 2 (la carica positiva è più lontana dal fluoro che sottrae elettroni)
e) 1 (la coppia solitaria sull’azoto può donare elettroni per risonanza)
f) 1 (carbocation allilico – la carica positiva può essere delocalizzata su un secondo carbonio)
.