Ione azide: Struttura, proprietà e reazioni di sostituzione
Lo ione azide (N3- ) è una di quelle entità chimiche che sembra semplicemente strana.

- Tre nitrogeni in fila? controllare
- Due cariche negative e una carica positiva, per una carica netta di -1? controllare
- Stabile? controllare (finché è trattato delicatamente).
Come si è scoperto, lo ione azide può essere estremamente utile per formare legami C-N nelle reazioni di sostituzione nucleofila.
Tabella dei contenuti
- Lo ione azide è un grande nucleofilo
- Azidi organiche come ammine “mascherate”
- Esplodono sulla rampa di lancio
- Sostituzione nucleofila acilica con sali di azide: Azidi aciliche
- Riarrangiamento di azidi aciliche: Il riarrangiamento di Curtius
- Altri esempi di azidi nucleofili: Apertura dell’epossido e addizione coniugata
- Note
- (Avanzate) Riferimenti e ulteriori letture
- 1. Lo ione azide è un grande nucleofilo nelle reazioni SN2
- 2. Azidi organiche come “ammine mascherate”
- Esplodere sulla rampa di lancio
- 4. La sostituzione acilica nucleofila con sali azidici produce azidi aciliche
- 5. Riarrangiamento degli azidi acilici: Il riarrangiamento di Curtius
- Altri esempi di nucleofili azidi: Apertura di epossidi e addizione coniugata
- Note
- (Advanced) References and Further Reading
1. Lo ione azide è un grande nucleofilo nelle reazioni SN2
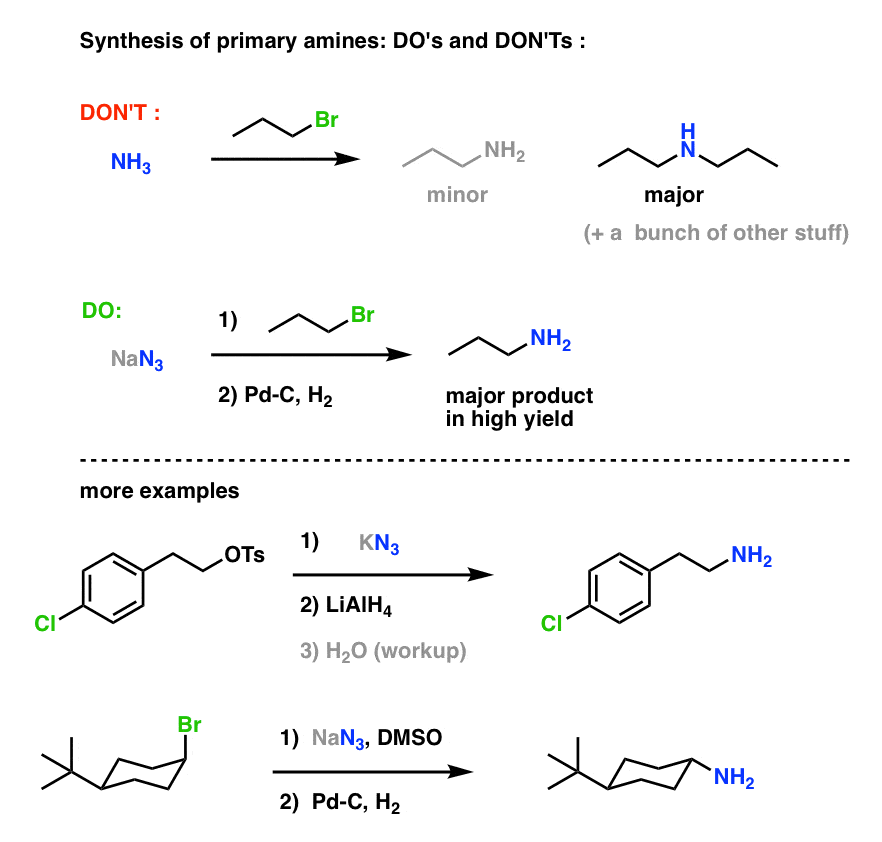
Lo ione azide è la base coniugata dell’acido idrazoico, HN3. Nonostante sia solo debolmente basico (il pKa di HN3 è solo 4,6) N3 è un ottimo nucleofilo – secondo una misura, più nucleofilo di qualsiasi ammina (vedi post: Nucleofilia delle ammine). Non è difficile razionalizzare perché questo possa essere quando ci si ferma a pensarci. Con quattro coppie solitarie nucleofile confinate in un volume molto piccolo, la probabilità di una collisione con un elettrofilo che risulta in una reazione è molto più alta di quanto lo sarebbe per un’ammina con gruppi alchilici voluminosi, per fare solo un esempio.
Puoi pensare a N3- come a un missile a punta di azoto, magro e cattivo, che consegna il suo carico sul carbonio in modo rapido, efficiente e senza reazioni collaterali significative.
Nelle reazioni SN2, gli alogenuri e i solfonati alchilici primari e secondari sono facilmente spostati da N3-, ottenendo alchil azidi:
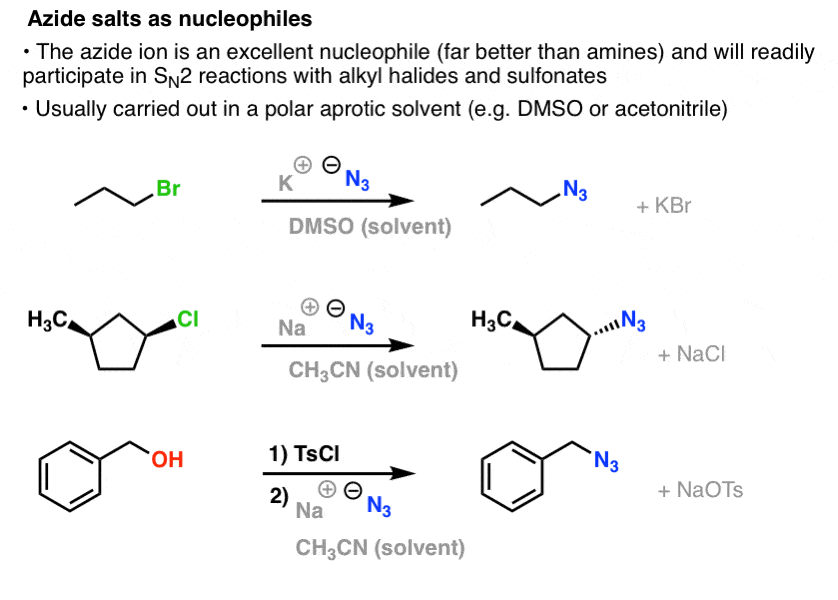
La procedura usuale è di usare un sale di azide come NaN3 o KN3 con l’alogenuro alchilico appropriato in un solvente polare aprotico come l’acetonitrile (CH3CN) o il dimetilsolfossido (DMSO).
I prodotti organici dell’azide sono ragionevolmente stabili, anche se hanno un aspetto un po’ strano. Alcuni hanno persino trovato impiego come prodotti farmaceutici (ad esempio AZT, in basso a destra) o come utili sonde per lo studio della biologia chimica. .
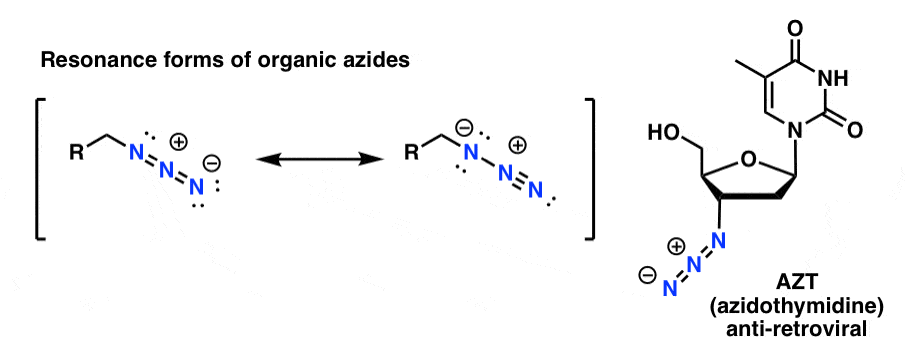
Per i nostri scopi la proprietà più utile delle azidi organiche è che servono come ammine “mascherate”.
2. Azidi organiche come “ammine mascherate”
Nota la forma di risonanza sopra con un triplo legame azoto-azoto. Se trattati con un agente riducente, come LiAlH4 o anche idrogenazione catalitica (Pd/C, H2) gli azidi organici possono essere ridotti ad ammine primarie, liberando N2 nel processo.
Questo rende un percorso molto utile per le ammine primarie da alogenuri alchilici!
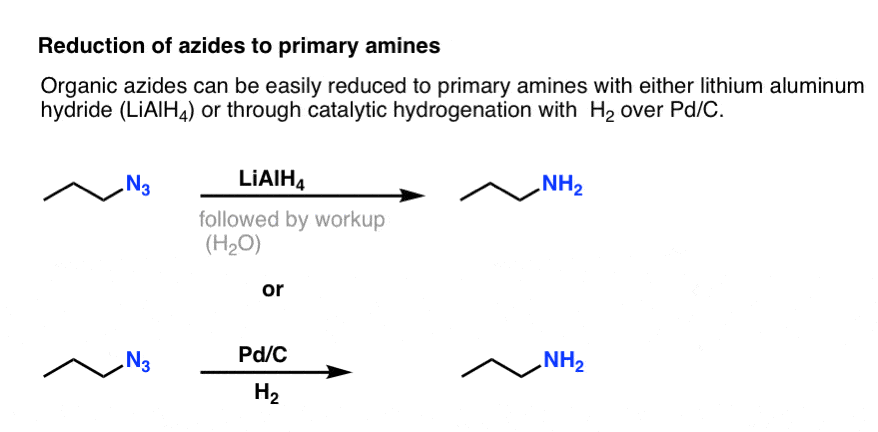
Abbiamo già esplorato la sintesi Gabriel come via per le ammine primarie, ma questa via è superiore perché l’azide può essere ridotta all’ammina in condizioni delicate (per esempio idrogenazione). Nessuna di quella scissione ad alta temperatura della ftalimmide con idrazina di cui preoccuparsi.
Abbiamo anche visto che fare ammine primarie attraverso il trattamento diretto di alogenuri alchilici con NH3 spesso non si ottiene il prodotto desiderato, perché di ammine hanno una tendenza Cookie-Monster-like a reagire più volte con alogenuri alchilici: poiché i prodotti ammina tendono ad essere più nucleofili dei reagenti, è difficile ottenere ammine per fermare a sgranocchiare solo un alogenuro alchilico.
Esplodere sulla rampa di lancio
Se N3 è un “missile a punta d’azoto”, come abbiamo commentato sopra, vale la pena ricordare cosa succede quando un missile non viene maneggiato con cura: è essenzialmente una bomba.
NaN3 e KN3 sono polveri bianche che possono essere conservate indefinitamente a temperatura ambiente ed estratte al banco senza problemi. Lo stesso vale per l’esposizione di questi sali di azidi all’acido, che forma HN3 potenzialmente esplosivo.
E NaN3 e KN3 sono i simpatici azidi! Se mescolati con sali metallici di piombo, mercurio, cadmio, zinco o argento, si possono ottenere composti azotati ancora più esplosivi. Questi azidi metallici sono esplosivi di contatto, alcuni dei quali sono così sensibili che esplodono se qualcuno scorreggia a sei metri nel corridoio. Alcuni chimici pazzi fanno addirittura queste cose di proposito, ma non ci avvicineremo mai e poi mai al raggio di esplosione di quell’argomento su questo blog.
NaN3 e KN3 dovrebbero essere usati a concentrazioni ragionevolmente diluite, dietro uno scudo antideflagrante su scala preparativa, e per inciso mai usati con il solvente CH2Cl2, che può dare luogo a diazidometano altamente esplosivo.
Ora, ci sono momenti in cui un’improvvisa esplosione di gas azoto è utile – e potenzialmente salvavita. Potresti aver già trascorso una parte della tua giornata in prossimità del sodio azide senza nemmeno rendertene conto. Questo perché NaN3 è uno dei diversi propellenti che trova impiego negli airbag; una volta innescato da un accelerometro, la detonazione di NaN3 espelle gas N2 a oltre 200 mph, gonfiando la borsa in 1/25 di secondo.
Sì per i sali di azidi!
via GIPHY
(Ma non essere questo tipo):
via GIPHY
Fondo: Le reazioni SN2 tra alogenuri alchilici o solfonati con azidi sono probabilmente il modo migliore per sintetizzare ammine primarie da alogenuri alchilici. Sicuramente batte la sintesi di Gabriel.
4. La sostituzione acilica nucleofila con sali azidici produce azidi aciliche
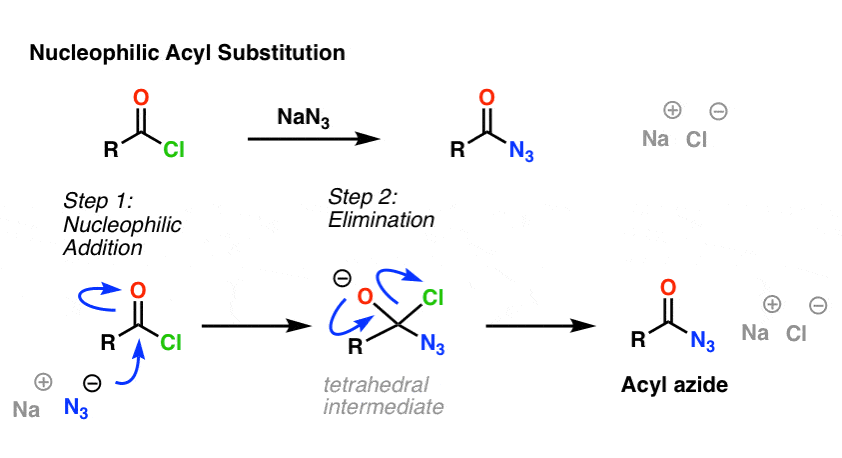
La reazione SN2 non è l’unico tipo di reazione di sostituzione che abbiamo esplorato. C’è anche la sostituzione acilica nucleofila. Un carbonile attaccato ad un buon gruppo lasciante (come un cloruro acido o un’anidride) subirà una sostituzione quando un appropriato nucleofilo viene aggiunto.
Nel primo passo del meccanismo, il nucleofilo (Nu) attacca il carbonio carbonile, formando C-Nu e rompendo C-O (pi). Questo dà origine a un intermedio tetraedrico. Nel secondo passo, il legame C-O pi viene riformato, e il legame carbonio-(gruppo lasciante) viene rotto, dando luogo al prodotto di sostituzione acilica nucleofila.
Ecco un esempio di reazione di sostituzione acilica nucleofila tra un cloruro acido e lo ione N3 per dare un azide acilica:
5. Riarrangiamento degli azidi acilici: Il riarrangiamento di Curtius
L’uso più comune per le azidi aciliche è che al riscaldamento, si riarrangiano per dare isocianati in una reazione nota come riarrangiamento di Curtius.
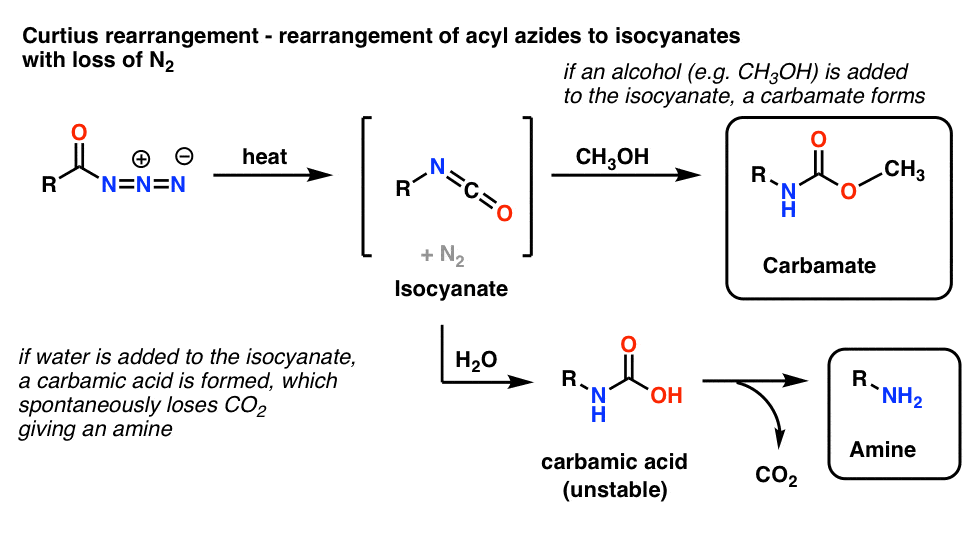
- Se il Curtius viene eseguito in presenza di un alcool come il metanolo, si forma un carbammato.
- Se invece si aggiunge acqua, si forma brevemente un acido carbamico instabile, che poi perde anidride carbonica per dare un’ammina primaria.
Perché questo potrebbe essere utile? Ecco un modo.
Ci sono molti metodi per fare acidi carbossilici aromatici, ma non molti modi per formare legami C-N su anelli aromatici. Diciamo che avete un acido benzoico (come l’acido p-metilbenzoico) ma avete bisogno di formare un’ammina aromatica (protetta). Il protocollo Curtius rappresenta un bel modo di formare un nuovo legame C-N sull’anello senza dover ricorrere alla nitrazione + riduzione.
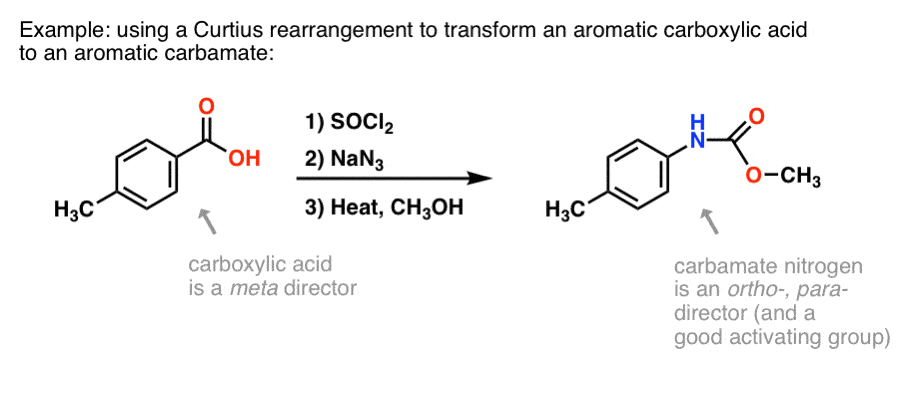
(In questo modo è in qualche modo analogo a un equivalente azotato dell’ossidazione Baeyer-Villiger. )
Altri esempi di nucleofili azidi: Apertura di epossidi e addizione coniugata
Altre due applicazioni dello ione azide come nucleofilo includono l’apertura di epossidi (in quello che è essenzialmente un processo SN2 – si noti l’inversione di configurazione) e anche l’addizione coniugata su chetoni insaturi alfa,beta:
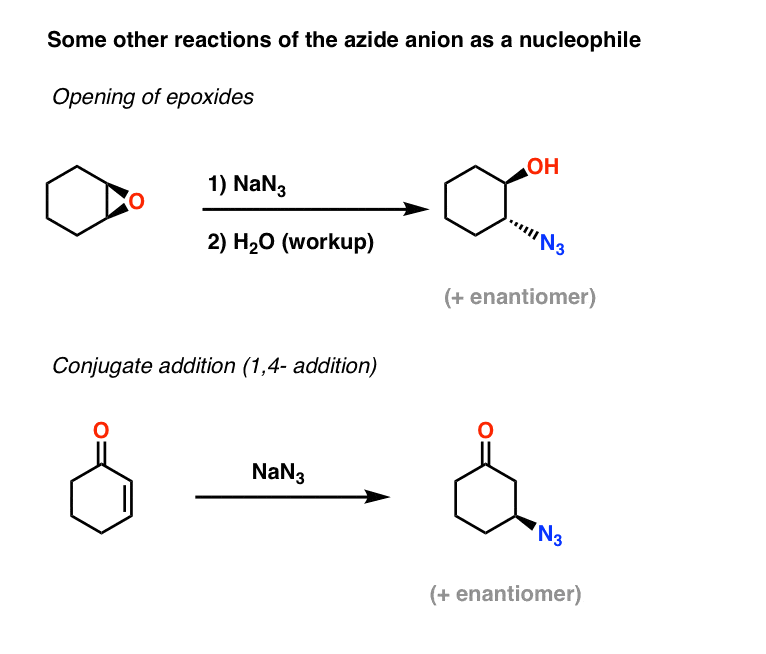
Gli alchil azidi risultanti possono poi essere ridotti ad ammine primarie usando i metodi trattati sopra.
Note
Nota: Azide-Alkyne Cycloadditions, a.k.a. “Un’interessante e utile applicazione degli azidi organici che non è ancora entrata nei libri di testo introduttivi di chimica organica (ma probabilmente lo farà nel prossimo futuro) è un processo tecnicamente chiamato “ciclocloaddizione azide-alchidina catalizzata dal rame”, ma più comunemente chiamato “reazione click alchidica-azide”.
Quando un alchene terminale è trattato con un catalizzatore di rame in presenza di un’azide organica, si ottiene rapidamente una cicloaddizione che porta alla formazione di un 1,2,3-triazolo.
Non ci addentreremo nei dettagli, ma questa reazione di formazione dell’anello coinvolge 6 elettroni pi ed è un cugino della reazione Diels-Alder (i pignoli noteranno giustamente che la versione catalizzata dal rame non è tecnicamente un processo concertato, ma la versione non catalizzata lo è)
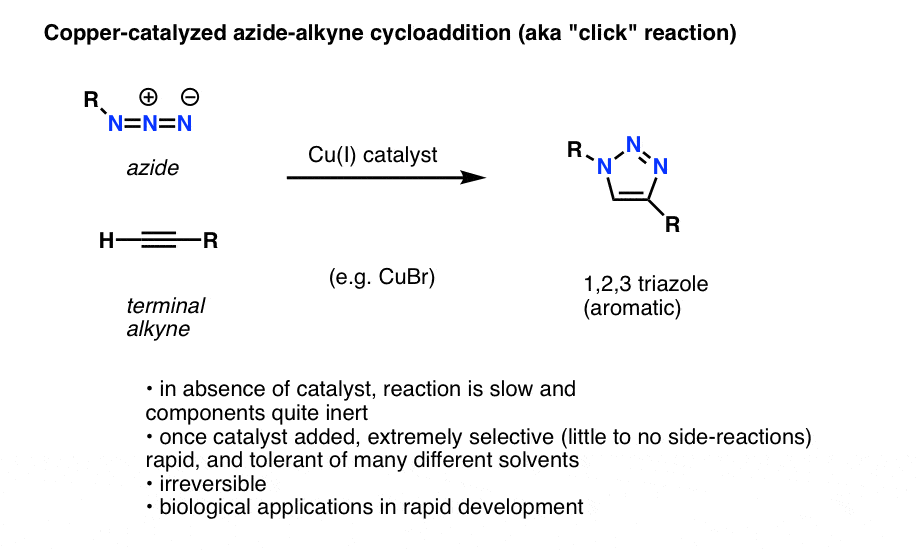
La reazione è notevole per alcune ragioni:
- i partner reattivi (alchine terminali e azidi organiche) sono relativamente inerti in assenza di un catalizzatore nella maggior parte delle condizioni.
- una volta aggiunto il rame, la reazione avviene estremamente rapidamente in condizioni blande e in una varietà di solventi (compresa l’acqua).
- è estremamente selettiva in queste condizioni, i partner alchine e azidi reagiscono solo tra loro, irreversibilmente.
- Il prodotto, un anello triazolico, è aromatico e stabile
È stata chiamata una reazione “click” da uno dei suoi creatori, Barry Sharpless, perché è una delle cose più vicine che i chimici hanno a una reazione che è come il “click insieme” di due blocchi lego complementari.
Quello che ha reso questa reazione particolarmente utile di recente è che i partner azidi e alcheni possono essere installati in molecole di interesse biologico, e “cliccati” insieme quando desiderato.
Per esempio:
- Mettendo un acetilene nella posizione 5′ di uno zucchero e un azide nella posizione 3′ è stato usato per fare DNA “cliccato”, dove il triazolo sostituisce l’organofosfato.
- Incredibilmente, un gruppo ha fatto il DNA “cliccato”, lo ha messo nelle cellule umane ed è riuscito a farlo trascrivere dall’RNA messaggero.
- L’AZT contenente azidi (sopra) agisce bloccando il meccanismo di trascrizione. Alcune persone intelligenti hanno trovato un modo per applicare la reazione click azide-alchine al sequenziamento rapido del genoma, una tecnica nota come ClickSeq.
Takata ha usato l’azide di sodio nei primi anni ’90, per poi passare al tetrazolo e poi al nitrato di ammonio.
Da “Sixty Million Car Bombs: Inside Takata’s Air Bag Crisis”.
Il nitrato di ammonio era circa un decimo del prezzo del tetrazolo, secondo Upham, che ha anche esaminato i brevetti dell’industria. Ma il nitrato di ammonio aveva un difetto critico che, secondo lui, ha portato altri produttori di airbag a rinunciare: Il nitrato di ammonio ha cinque fasi di densità variabile che lo rendono difficile da mantenere stabile nel tempo. Un propellente fatto con nitrato d’ammonio si gonfierebbe e si ridurrebbe con i cambiamenti di temperatura, e alla fine la compressa si romperebbe in polvere. L’acqua e l’umidità accelererebbero il processo. La polvere brucia più rapidamente di una pastiglia, quindi un air bag il cui propellente si è sbriciolato avrebbe la probabilità di dispiegarsi in modo troppo aggressivo. L’esplosione controllata sarebbe solo un’esplosione. “Tutti hanno preso una certa strada, e solo Takata ha preso un’altra strada”, dice Jochen Siebert, che ha seguito l’industria degli air bag dagli anni ’90 e ora è amministratore delegato di JSC Automotive Consulting. “Se si leggono i documenti delle conferenze di allora, si può effettivamente vedere che la gente diceva: ‘No, non si dovrebbe. È pericoloso”. “
Le schegge degli airbag difettosi hanno ucciso 13 persone in tutto il mondo e ne hanno ferite più di 100.
Il 25 giugno 2017, di fronte a passività di oltre 11 miliardi di dollari, Takata ha presentato istanza di fallimento.
Sintesi delle ammine primarie “Do’s and Don’ts” :
(Advanced) References and Further Reading
Gli azidi sono utili nella sintesi organica, e un highlight della chimica degli azidi è dato nei riferimenti seguenti.
- Reattività nucleofila dello ione azide in vari solventi
Thanh Binh Phan, Herbert Mayr
Phys. Org. Chem. 2006, 19 (11), 706-713
DOI: 10.1002/poc.1063
Prof. Herbert Mayr (LMU, Monaco, Germania) ha trascorso la sua carriera contribuendo alla chimica organica fisica fondamentale quantificando l’elettrofilia e la nucleofilia, e sviluppando scale per confrontare la reattività di vari nucleofili ed elettrofili. - Gli spostamenti SN2 a 2-norbornyl brosylates
Klaus Banert e Wolfgang Kirmse
Journal of the American Chemical Society 1982, 104 (13), 3766-3767
DOI: 1021/ja00377a057 - Una sintesi migliorata di Azidothymidine
I. Balagopala, A. P. Ollapally, & H. J. Lee
Nucleosidi, Nucleotidi & Nucleic Acids 1996, 4, 899-906
DOI: 10.1080/07328319608002136
Gli azidi possono essere usati come nucleofili nelle reazioni SN2. Rif. #3 mostra l’uso dello ione azide nella sintesi dell’AZT (azidotimidina). La conversione di 1 a 5 attraverso 3 nel rif. #3 utilizza la reazione di Mitsunobu, che permette lo spostamento di un gruppo -OH con un nucleofilo con inversione di configurazione. - Riduzione di azidi organiche ad ammine primarie con idruro di alluminio di litio
H. Boyer
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
DOI: 10.1021/ja01156a507
La riduzione di azidi organiche ad ammine primarie è un metodo conveniente per la sintesi di ammine primarie, che sono altrimenti difficili da sintetizzare selettivamente con metodi standard. - La sensibilità esplosiva delle azidi metalliche all’impatto
P. G. Fox
J. Solid State Chem. 1970, 2 (4), 491-502
DOI: 10.1016/0022-4596(70)90043-5
Un’indagine sulla sensibilità agli urti di NaN3, TlN3 e Pb(N3)2. - La reazione di Curtius
Smith, P. A. S. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
Una vecchia ma completa revisione della reazione di Curtius, che include la storia della scoperta di questo riarrangiamento, la portata del substrato, i limiti, il confronto con altre reazioni simili e le procedure sperimentali. - Metodi e reazioni sintetiche. 121. Preparazione catalizzata da ioduro di zinco di aroyl azidi da cloruri di aroyl e trimetilsilile azide
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi, and George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051b
Una procedura conveniente per la preparazione di aril azidi aromatiche dal premio Nobel Prof. George A. Olah. Questi possono poi essere usati per i riarrangiamenti di Curtius.
Apertura dell’epossido e aggiunta coniugata:
- CICLOESENE IMINA (7-AZA-BICITANO)
Iain D. G. Watson, Nicholas Afagh e Andrei K. Yudin
Org. Synth. 2010, 87, 161-169
DOI: 10.15227/orgsyn.087.0161
Questa è una procedura particolarmente utile, poiché è una reazione di Staudinger per convertire gli epossidi in NH-aziridine (l’analogo azotato degli epossidi). La sintesi può essere difficile, ma un sacco di dettagli è stato fornito qui in modo che questo può essere riprodotto, come l’adattamento di una procedura in Organic Syntheses. - Aggiunta catalizzata da ammina dello ione azide a composti carbonilici α,β-insaturi
David J. Guerin, Thomas E. Horstmann, and Scott J. Miller
Organic Letters 1999, 1 (7), 1107-1109
DOI: 10.1021/ol9909076
Questo articolo è interessante perché rappresenta una prima forma di organocatalisi e probabilmente procede attraverso un intermedio di ione imina o iminio. Sfortunatamente il termine non è usato da nessuna parte nel documento – questi autori avrebbero potuto battere il Prof. MacMillan al pugno! - Click Chemistry: Diverse funzioni chimiche da poche buone reazioni
Hartmuth C. Kolb Dr. M. G. Finn Prof. K. Barry Sharpless Prof.
Angew Chem. Int. Ed. 2001, 40 (11), 2004-2021
DOI: 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5
La cicloaddizione catalizzata da Cu di azidi con alchini è stata definita una reazione ‘click’ dal premio Nobel prof. K. Barry Sharpless (The Scripps Research Institute, La Jolla, CA) a causa della sua semplicità, alta resa, cinetica veloce e compatibilità con un’ampia gamma di condizioni e substrati. Le reazioni senza Cu sono anche possibili se vengono utilizzati alchini filtrati (ad esempio cicloitti).