Chemguide: Supporto per CIE A level Chemistry
Obiettivo di apprendimento 11.2(f)
Questa dichiarazione riguarda i coefficienti di partizione.
Prima di continuare, dovresti trovare e leggere la dichiarazione nella tua copia del syllabus.
Partizione
Se hai due liquidi immiscibili come l’etere e l’acqua, e li agiti in un imbuto separatore, ovviamente formano due strati. L’etere è meno denso dell’acqua, e quindi forma lo strato superiore.
Ora supponiamo di agitare una miscela di etere e acqua contenente una sostanza che è solubile in entrambi. Supponiamo che la sostanza, X, sia più solubile nell’etere che nell’acqua.
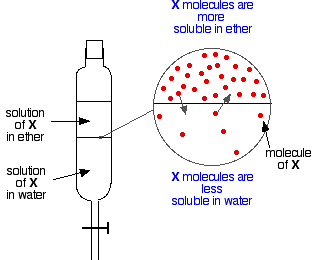
Particelle di X attraverseranno il confine tra i due strati liquidi, e si avrà presto un equilibrio dinamico. Per ogni particella che si muove nello strato superiore, una tornerà indietro in quello inferiore.
Si potrebbe scrivere un’equazione per questo:
![]()
![]()
. . e come ogni altro equilibrio, si può trovare una costante di equilibrio:
![]()
![]()
Questa costante di equilibrio è chiamata coefficiente di partizione, ed è spesso indicata con il simbolo Kpc.
Come altre costanti di equilibrio, i coefficienti di partizione sono costanti a una temperatura costante, ma hanno anche alcune altre restrizioni. Funzionano correttamente solo per soluzioni abbastanza diluite, e il soluto deve essere nella stessa forma chimica in entrambi i solventi. Non deve reagire, o ionizzarsi o associarsi (unirsi in dimeri, per esempio).
Calcoli del coefficiente di partizione
Una nota sulle unità
Nota che il coefficiente di partizione è un semplice rapporto di due concentrazioni. Non importa quali unità di concentrazione usi – basta che usi le stesse in alto e in basso.
Potresti usare mol dm-3, ma più spesso si usano g cm-3 – grammi per centimetro cubo.
Tecnicamente, le parentesi quadre possono essere usate solo per la concentrazione in mol dm-3, ma l’Application Support Booklet e i mark schemes della CIE le usano anche per altre unità.
Non sono disposto a farlo, e quindi userò il termine “concentrazione di X” piuttosto che dove si usano unità di concentrazione non standard.
Calcolare un coefficiente di partizione
Quando una soluzione di 1,00 g di X in 100 cm3 di acqua è stata agitata con 10 cm3 di etere, 0,80 g di X è stato trasferito nello strato di etere. Calcola il coefficiente di partizione di X tra etere e acqua.
Se ti viene chiesto di calcolare un coefficiente di partizione tra due solventi, la concentrazione del primo solvente menzionato va in cima all’espressione Kpc. Quindi in questo caso:
![]()
![]()
Hai abbastanza informazioni per calcolare entrambe le concentrazioni in g cm-3.
![]() concentrazione di X in etere = 0,80/10 g cm-3
concentrazione di X in etere = 0,80/10 g cm-3
Se 0,80 g sono stati trasferiti nell’etere, 1,00 – 0,80 g = 0.20 g sono rimasti nell’acqua.
![]() concentrazione di X nell’acqua = 0,20/100 g cm-3
concentrazione di X nell’acqua = 0,20/100 g cm-3
Quindi:
![]()
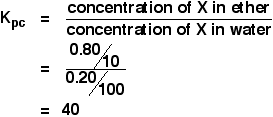
Ovviamente, potresti calcolare le concentrazioni in etere e in acqua come numeri reali prima di inserirli nell’espressione. Fallo come ti senti più a tuo agio.
I coefficienti di partizione come questo non hanno unità – le unità si annullano perché sono le stesse in alto e in basso.
Calcoli che coinvolgono i coefficienti di partizione
Il syllabus CIE dice specificamente che si dovrebbe essere in grado di calcolare un coefficiente di partizione (in altre parole, quello che abbiamo appena fatto). Non dice assolutamente nulla sull’usarli per calcolare altre cose. Questi calcoli extra sono discussi nell’Application Support Booklet e sono stati chiesti due volte negli esami fino a giugno 2013 (entrambi nel 2009).
Il Coursebook non li include (correttamente!) perché il syllabus non li menziona, e questo libro è stato approvato dagli esaminatori CIE come una “copertura completa e precisa” del syllabus. Questo significa che la CIE non farà più domande in futuro? Non contateci!
Un esempio di base
Utilizzeremo lo stesso caso di prima – gli stessi solventi, lo stesso X e lo stesso coefficiente di ripartizione che abbiamo appena calcolato.
Questa volta calcoleremo quanto sarebbe stato estratto nello strato di etere se avessimo agitato la soluzione originale di 1,00 g di X in 100 cm3 di acqua con soli 5 cm3 di etere.
Stiamo cercando di calcolare la massa di X estratta. Chiamiamola m.
Elabora ora un’espressione per la concentrazione della soluzione di X in etere.
![]() concentrazione di X in etere = m/5 g cm-3
concentrazione di X in etere = m/5 g cm-3
E l’acqua? Ci saranno (1,00 – m) g di X rimasti nell’acqua. Quindi:
![]() concentrazione di X in acqua = (1,00 – m)/100 g cm-3
concentrazione di X in acqua = (1,00 – m)/100 g cm-3
Ora puoi mettere tutto questo nell’espressione del coefficiente di partizione. Ricorda che abbiamo già calcolato il coefficiente di partizione di X tra l’etere e l’acqua come 40.
![]()
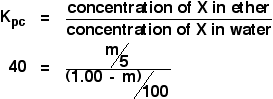
Si è quindi solo di fronte a un semplice, ma leggermente noioso, pezzo di algebra:
![]()
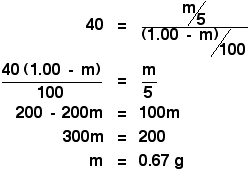
Più noioso!
Nel calcolo originale per trovare il coefficiente di ripartizione, ti è stato detto che se hai agitato la soluzione originale di 1,00 g di X in 100 cm3 di acqua con 10 cm3 di etere, hai estratto 0,80 g di X.
Allungandola con 5 cm3 di etere, abbiamo appena calcolato che avresti estratto 0,67 g di X.
Ci sarebbero rimasti 0,33 g di X nei 100 cm3 di acqua. Supponiamo che tu abbia conservato con cura questa soluzione, e poi l’abbia agitata con un secondo 5 cm3 fresco di etere.
Quanto di X estrarresti in totale usando l’etere in due lotti separati di 5 cm3 invece dei 10 cm3 in una volta sola?
Chiamiamo la massa di X estratta dal secondo lotto di etere n – così non ci confondiamo.
Elabora un’espressione per la concentrazione della soluzione di X in etere.
![]() concentrazione di X in etere = n/5 g cm-3
concentrazione di X in etere = n/5 g cm-3
E l’acqua? Ci saranno (0,33 – n) g di X rimasti nell’acqua dopo la seconda estrazione. Quindi:
![]() concentrazione di X in acqua = (0,33 – n)/100 g cm-3
concentrazione di X in acqua = (0,33 – n)/100 g cm-3
Ora puoi mettere tutto questo nell’espressione del coefficiente di partizione di X tra etere e acqua come prima.
![]()

Questo significa che se tu dovessi combinare i due lotti da 5 cm3 di etere, avresti estratto un totale di 0,67 + 0,22 g di X. Cioè 0.89 g.
Ti è stato detto originariamente che se avessi fatto questo solo una volta, usando l’etere come un singolo lotto di 10 cm3, avresti estratto solo 0,80 g.
Ottieni un’estrazione più efficiente dividendo il tuo solvente in volumi più piccoli come sopra.
Si usa questo tipo di tecnica nella preparazione di alcuni composti organici. Si estrae ciò che si sta cercando di fare da una soluzione disordinata in acqua in modo che finisca in un solvente organico. Poi si rimuove il solvente con un’attenta distillazione.
CIE ha fatto una domanda simile a questa nel documento 4 Q8 del giugno 2009. Si doveva calcolare un valore per il coefficiente di partizione, e poi usarlo in un’estrazione a due fasi esattamente come sopra. Il calcolo valeva 4 punti. Questo può essere noioso e (a parte il calcolo del coefficiente di partizione) non fa parte del programma, ma non potete permettervi di non essere in grado di farlo.