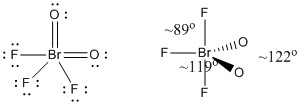Intermediate Inorganic Chemistry
University of Rhode Island
Fall 2013
Exam 1
1. Scrivi la configurazione elettronica (usando la notazione dei gas rari per i gusci chiusi) e il Term Symbol dello stato fondamentale per i seguenti: a) Sc; b) Sc+; c) Sc2+; d) Sc3+; e) Sc-.
a) Sc
4s23d1
Solo l’elettrone 3d contribuisce al termine simbolo: L = 2 e S = ½ dando 2D
b) Sc+
3d2
L = 3 e S = 1 dando 3F
c) Sc2+
3d1
L = 2 e S = ½ dando 2D
d) Sc3+
L = 0 e S = 0 dando 1S
d) Sc-
4s23d2
L = 3 e S = 1 dando 3F
2. Scrivi la struttura a punti di Lewis, dai le cariche formali su tutti gli atomi, prevedi la geometria molecolare, stima tutti gli angoli di legame, e dai il probabile orbitale ibrido per i seguenti: a) BrO2-; b) BrO3-; c) BrO2F3.
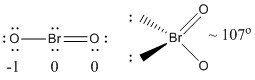
a) BrO2-
Struttura di Lewis:
Le cariche formali sono date sulla struttura di Lewis
Struttura: piano piegato con un angolo di legame di ~107°
Orbitale ibrido su Br: sp3
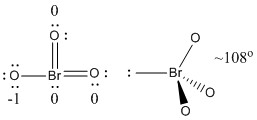
b) BrO3-
Struttura di Lewis:
Le cariche formali sono date sulla struttura di Lewis
Struttura: piramidale con angoli di legame O-Br-O ~108°
Orbitale ibrido su Br: sp3
c) BrO2F3
Struttura di Lewis:
Le cariche formali sono date sulla struttura di Lewis
Struttura: bipiramidale trigonale con angoli di legame mostrati in figura
Orbitale ibrido su Br: dsp3
3. La durezza assoluta di un atomo è definita come η = ½(IP – EA), IP è il potenziale di ionizzazione e EA è l’affinità elettronica. Prevedi l’andamento periodico di η e fornisci un ragionamento per la tua previsione.
Per quasi tutti gli atomi IP >> EA, quindi η seguirà le tendenze periodiche di IP: aumentando man mano che ci si sposta verso destra nella Tavola Periodica (seguendo Z*) e diminuendo leggermente man mano che ci si sposta verso il basso nella Tavola Periodica all’aumentare del raggio atomico.
4. Cr2 ha una configurazione elettronica di σ2π4δ4δ*2. Qual è l’ordine di legame e quanti spins spaiati sono previsti? Ti aspetteresti che Cr2 assorba la luce nella regione visibile dello spettro? Perché o perché no?
L’ordine di legame = ½(2 + 4 + 4 – 2) = 4 con 2 spin spaiati (poiché ci sono 2 orbitali δ ci devono essere anche 2 orbitali δ*, che hanno un elettrone ciascuno in base alle regole di Hund). La sovrapposizione laterale degli orbitali d per formare gli orbitali δ è scarsa, per cui la scissione tra gli orbitali δ e δ* sarà piccola. Questo suggerisce che l’energia richiesta per spostare un elettrone dall’HOMO al LUMO è anch’essa piccola, il che predice un assorbimento nella parte visibile dello spettro.