Obiettivi di apprendimento
- Utilizzare la notazione di cella per descrivere le celle galvaniche
- Descrivere i componenti di base delle celle galvaniche
Le celle galvaniche, note anche come celle voltaiche, sono celle elettrochimiche in cui reazioni spontanee di ossidoriduzione producono energia elettrica. Nello scrivere le equazioni, è spesso conveniente separare le reazioni di ossido-riduzione in mezze reazioni per facilitare il bilanciamento dell’equazione complessiva e per enfatizzare le effettive trasformazioni chimiche.
Considerate cosa succede quando un pezzo di rame metallico pulito viene messo in una soluzione di nitrato d’argento (Figura 1). Non appena il rame metallico viene aggiunto, l’argento metallico comincia a formarsi e gli ioni di rame passano nella soluzione. Il colore blu della soluzione all’estrema destra indica la presenza di ioni di rame. La reazione può essere divisa nelle sue due semi-reazioni. Le mezze reazioni separano l’ossidazione dalla riduzione, quindi ciascuna può essere considerata singolarmente.
L’equazione per la semi-reazione di riduzione doveva essere raddoppiata in modo che il numero di elettroni “guadagnati” nella semi-reazione di riduzione fosse uguale al numero di elettroni “persi” nella semi-reazione di ossidazione.

Le celle galvaniche o voltaiche coinvolgono reazioni elettrochimiche spontanee in cui le mezze reazioni sono separate (Figura 2) in modo che la corrente possa fluire attraverso un filo esterno. Il becher sul lato sinistro della figura è chiamato una semicella, e contiene una soluzione 1 M di nitrato di rame (II) con un pezzo di rame metallico parzialmente immerso nella soluzione. Il rame metallico è un elettrodo. Il rame è in fase di ossidazione, quindi l’elettrodo di rame è l’anodo. L’anodo è collegato ad un voltmetro con un filo e l’altro terminale del voltmetro è collegato ad un elettrodo d’argento con un filo. L’argento è in fase di riduzione, quindi l’elettrodo d’argento è il catodo. La semicella sul lato destro della figura consiste nell’elettrodo d’argento in una soluzione 1 M di nitrato d’argento (AgNO3). A questo punto, non scorre corrente, cioè non si verifica alcun movimento significativo di elettroni attraverso il filo perché il circuito è aperto. Il circuito viene chiuso usando un ponte di sale, che trasmette la corrente con ioni in movimento. Il ponte di sale consiste in una soluzione elettrolitica concentrata e non reattiva, come la soluzione di nitrato di sodio (NaNO3) usata in questo esempio. Mentre gli elettroni scorrono da sinistra a destra attraverso l’elettrodo e il filo, gli ioni di nitrato (anioni) passano attraverso il tappo poroso a sinistra nella soluzione di nitrato di rame(II). Questo mantiene il becher a sinistra elettricamente neutrale neutralizzando la carica degli ioni di rame(II) che sono prodotti nella soluzione quando il rame metallico è ossidato. Allo stesso tempo, gli ioni di nitrato si muovono verso sinistra, gli ioni di sodio (cationi) si muovono verso destra, attraverso il tappo poroso, e nella soluzione di nitrato d’argento sulla destra. Questi cationi aggiunti “rimpiazzano” gli ioni d’argento che vengono rimossi dalla soluzione quando sono stati ridotti in argento metallico, mantenendo il becher sulla destra elettricamente neutrale. Senza il ponte salino, gli scomparti non rimarrebbero elettricamente neutri e non scorrerebbe alcuna corrente significativa. Tuttavia, se i due scomparti sono in contatto diretto, un ponte di sale non è necessario. Nell’istante in cui il circuito è completato, il voltmetro legge +0,46 V, questo è chiamato il potenziale della cella. Il potenziale di cella si crea quando i due metalli dissimili sono collegati, ed è una misura dell’energia per unità di carica disponibile dalla reazione di ossido-riduzione. Il volt è l’unità SI derivata per il potenziale elettrico
In questa equazione, A è la corrente in ampere e C la carica in coulombs. Si noti che i volt devono essere moltiplicati per la carica in coulombs (C) per ottenere l’energia in joule (J).
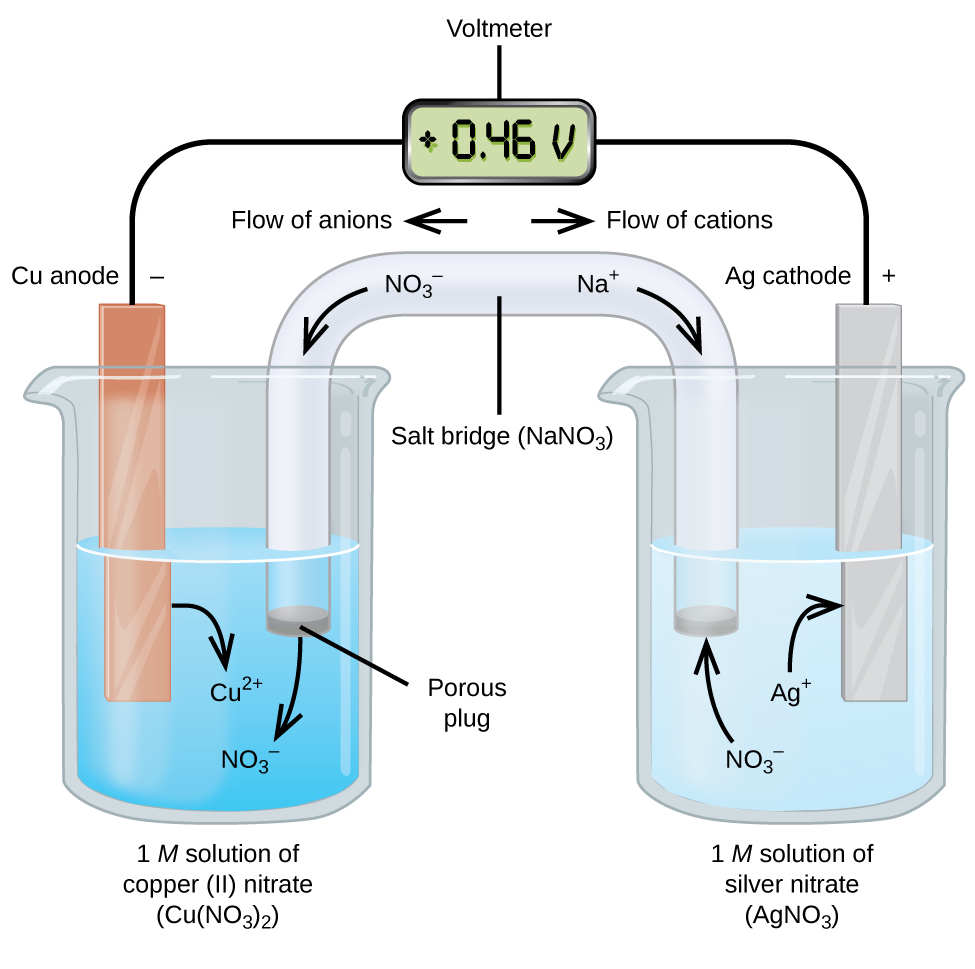
Quando la cella elettrochimica è costruita in questo modo, un potenziale di cella positivo indica una reazione spontanea e che gli elettroni stanno fluendo da sinistra a destra. Ci sono molte cose che accadono nella figura 2, quindi è utile riassumere le cose per questo sistema:
- Gli elettroni fluiscono dall’anodo al catodo: da sinistra a destra nella cella galvanica standard in figura.
- L’elettrodo nella semicella sinistra è l’anodo perché qui avviene l’ossidazione. Il nome si riferisce al flusso di anioni nel ponte salino verso di esso.
- L’elettrodo nella semicella destra è il catodo perché qui avviene la riduzione. Il nome si riferisce al flusso di cationi nel ponte salino verso di esso.
- L’ossidazione avviene all’anodo (la semicella sinistra nella figura).
- La riduzione avviene al catodo (la semicella destra nella figura).
- Il potenziale della cella, +0.46 V, in questo caso, risulta dalle differenze intrinseche nella natura dei materiali usati per fare le due semicelle.
- Il ponte salino deve essere presente per chiudere (completare) il circuito e sia un’ossidazione che una riduzione devono avvenire perché la corrente scorra.
Ci sono molte possibili celle galvaniche, così una notazione abbreviata è solitamente usata per descriverle. La notazione della cella (a volte chiamata diagramma della cella) fornisce informazioni sulle varie specie coinvolte nella reazione. Questa notazione funziona anche per altri tipi di cellule. Una linea verticale, │, denota un confine di fase e una doppia linea, ‖, il ponte salino. Le informazioni sull’anodo sono scritte a sinistra, seguite dalla soluzione anodica, poi il ponte salino (se presente), poi la soluzione catodica e, infine, le informazioni sul catodo a destra. La notazione di cella per la cella galvanica in figura 2 è quindi
Nota che gli ioni spettatori non sono inclusi e che è stata usata la forma più semplice di ogni semi-reazione. Quando sono note, le concentrazioni iniziali dei vari ioni sono solitamente incluse.
Una delle celle più semplici è la cella di Daniell. È possibile costruire questa batteria mettendo un elettrodo di rame sul fondo di un barattolo e coprendo il metallo con una soluzione di solfato di rame. Una soluzione di solfato di zinco viene fatta galleggiare sopra la soluzione di solfato di rame; poi un elettrodo di zinco viene posto nella soluzione di solfato di zinco. Collegando l’elettrodo di rame all’elettrodo di zinco si fa scorrere una corrente elettrica. Questo è un esempio di cella senza ponte salino, e gli ioni possono fluire attraverso l’interfaccia tra le due soluzioni.
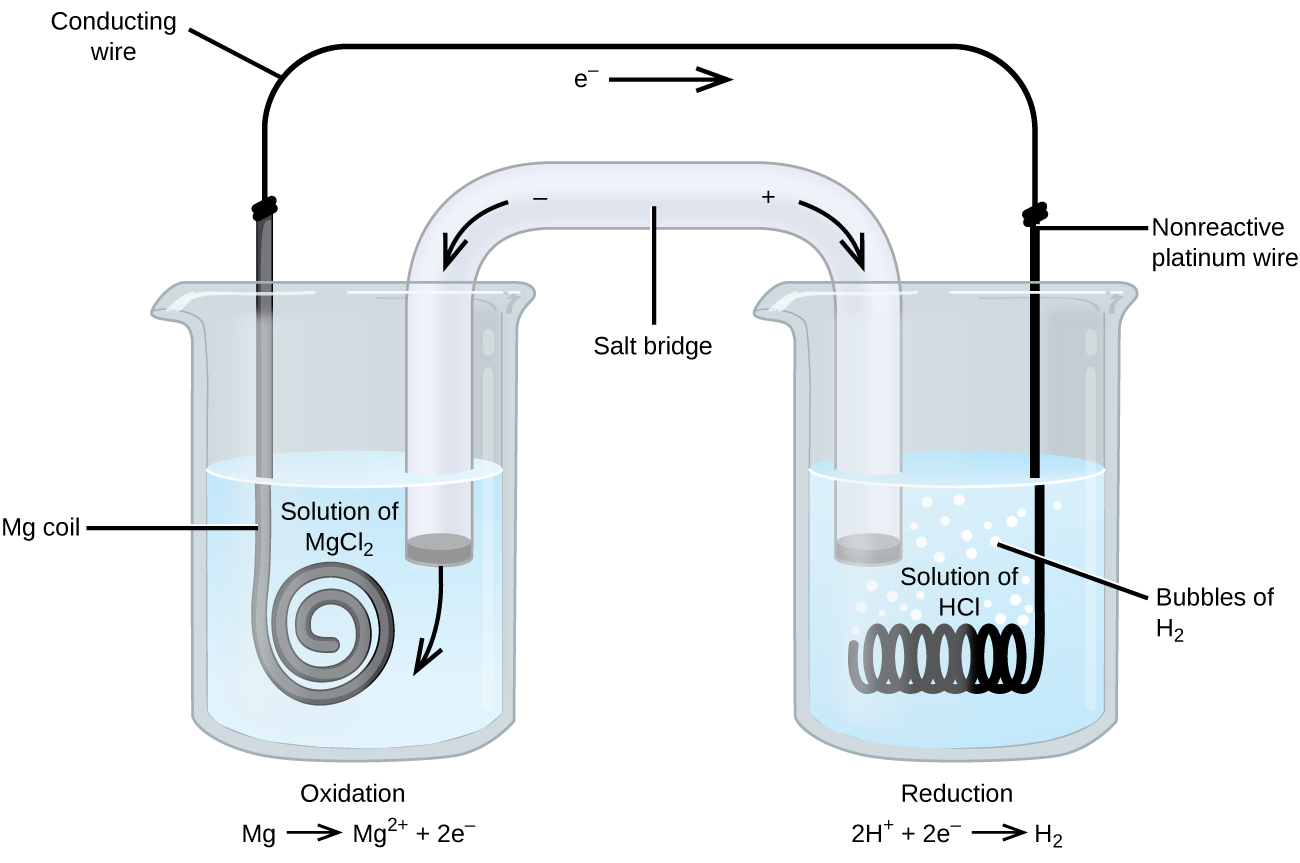
Alcune reazioni di ossido-riduzione coinvolgono specie che sono poveri conduttori di elettricità, e quindi viene usato un elettrodo che non partecipa alle reazioni. Spesso, l’elettrodo è di platino, oro o grafite, che sono tutti inerti a molte reazioni chimiche. Uno di questi sistemi è mostrato nella figura 3. Il magnesio subisce l’ossidazione all’anodo a sinistra nella figura e gli ioni di idrogeno subiscono la riduzione al catodo a destra. La reazione può essere sintetizzata come
La cella usava un filo di platino inerte per il catodo, quindi la notazione della cella è
L’elettrodo di magnesio è un elettrodo attivo perché partecipa alla reazione di ossido-riduzione. Gli elettrodi inerti, come l’elettrodo di platino nella figura 3, non partecipano alla reazione di ossido-riduzione e sono presenti in modo che la corrente possa fluire attraverso la cella. Il platino o l’oro sono generalmente buoni elettrodi inerti perché sono chimicamente non reattivi.
Esempio 1
Considera una cella galvanica composta da
Scrivi le semi-reazioni di ossidazione e riduzione e scrivi la reazione usando la notazione di cella. Quale reazione avviene all’anodo? Al catodo?
Soluzione
Per ispezione, Cr è ossidato quando tre elettroni sono persi per formare Cr3+, e Cu2+ è ridotto quando guadagna due elettroni per formare Cu. Bilanciando la carica si ottiene
La notazione della cella usa la forma più semplice di ciascuna delle equazioni, e inizia con la reazione all’anodo. Non sono state specificate le concentrazioni, quindi: \text{Cr}(s){\mid}\text{Cr}^{3+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s). L’ossidazione avviene all’anodo e la riduzione al catodo.
Considera una cella galvanica composta da
Scrivi le semi-reazioni di ossidazione e riduzione e scrivi la reazione usando la notazione di cella. Quale reazione avviene all’anodo? Al catodo?
Soluzione
Aspettando, Fe2+ subisce l’ossidazione quando un elettrone viene perso per formare Fe3+, e MnO4- si riduce quando guadagna cinque elettroni per formare Mn2+. Bilanciando la carica si ottiene
La notazione della cella usa la forma più semplice di ciascuna delle equazioni, e inizia con la reazione all’anodo. È necessario usare un elettrodo inerte, come il platino, perché non c’è nessun metallo presente per condurre gli elettroni dall’anodo al catodo. Non sono state specificate le concentrazioni, quindi: \text{Pt}(s){\mid}\text{Fe}^{2+}(aq)\text{,}\;\text{Fe}^{3+}(aq){\parallel}\text{MnO}_4^{\;\;-}(aq)\text{,}\;\text{H}^{+}(aq)\text{,}\;\text{Mn}^{2+}(aq){\mid}\text{Pt}(s). L’ossidazione avviene all’anodo e la riduzione al catodo.
Controlla il tuo apprendimento
Usa la notazione di cella per descrivere la cella galvanica dove gli ioni di rame(II) si riducono a rame metallico e lo zinco metallico si ossida a ioni di zinco.
Rispondi:
Dalle informazioni date nel problema:
begin{array}{lr @{{}longrightarrow{} l} \testo{anode};(ossidazione):} & \testo{Zn}(s) & \testo{Zn}^{2+}(aq)\testo{2};+\testo{2}^{2}-} \testo{catodo};(riduzione):} & \text{Cu}^{2+}(aq)\;+\;2\text{e}^{-} & \testo{Cu}(s) \testo \linea \testo \tutto:} & \testo{Zn}(s)\+;+;\testo{Cu}^{2+}(aq) & \testo{Zn}^{2+}(aq)\;+;\testo{Cu}(s) \end{array}
Usando la notazione di cella:
\text{Zn}(s){\mid}\text{Zn}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s).
Le celle elettrochimiche consistono tipicamente di due semicelle. Le semicelle separano la mezza reazione di ossidazione dalla mezza reazione di riduzione e rendono possibile il flusso di corrente attraverso un filo esterno. Una semicella, normalmente rappresentata sul lato sinistro in una figura, contiene l’anodo. L’ossidazione avviene all’anodo. L’anodo è collegato al catodo nell’altra semicella, spesso rappresentata sul lato destro in una figura. La riduzione avviene al catodo. L’aggiunta di un ponte salino completa il circuito permettendo alla corrente di fluire. Gli anioni nel ponte salino fluiscono verso l’anodo e i cationi nel ponte salino fluiscono verso il catodo. Il movimento di questi ioni completa il circuito e mantiene ogni mezza cella elettricamente neutra. Le celle elettrochimiche possono essere descritte usando la notazione di cella. In questa notazione, le informazioni sulla reazione all’anodo appaiono a sinistra e le informazioni sulla reazione al catodo a destra. Il ponte salino è rappresentato da una doppia linea, ‖. Le fasi solida, liquida o acquosa all’interno di una semicella sono separate da una singola linea, │. La fase e la concentrazione delle varie specie sono incluse dopo il nome della specie. Gli elettrodi che partecipano alla reazione di ossido-riduzione sono chiamati elettrodi attivi. Gli elettrodi che non partecipano alla reazione di ossido-riduzione ma sono lì per permettere alla corrente di scorrere sono elettrodi inerti. Gli elettrodi inerti sono spesso fatti di platino o oro, che sono inalterati da molte reazioni chimiche.
Esercizi di fine capitolo
- Scrivi le seguenti reazioni bilanciate usando la notazione di cella. Usa il platino come elettrodo inerte, se necessario.
(a) \text{Mg}(s)\;+\;\text{Ni}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Ni}(s)
(b) 2\text{Ag}^{+}(aq)\;+\;\text{Cu}(s)\;{\longrightarrow}\;\text{Cu}^{2+}(aq)\;+\;2\text{Ag}(s)
(c) \text{Mn}(s)\;+\;\text{Sn(NO}_3)_2(aq)\;{\longrightarrow}\;\text{Mn(NO}_3)_2(aq)\;+\;\text{Au}(s)
(d) 3\text{CuNO}_3(aq)\;+\;\text{Au(NO}_3)_3(aq)\;{\longrightarrow}\;3\text{Cu(NO}_3)_2(aq)\;+\;\testo{Au}(s)
- Viste le seguenti notazioni di cella, determina le specie ossidate, le specie ridotte, e l’agente ossidante e l’agente riducente, senza scrivere le reazioni bilanciate.
(a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s)
(b) \testo{Ni}(s){mid}testo{Ni}^{2+}(aq){\parallelo}testo{Ag}^{+}(aq){mid}testo{Ag}(s)
- Per le notazioni di cella del problema precedente, scrivi le corrispondenti reazioni bilanciate.
- Bilancia le seguenti reazioni e scrivi le reazioni usando la notazione di cella. Ignora gli elettrodi inerti, poiché non fanno mai parte delle semireazioni.
(a) \text{Al}(s)\;+\;\text{Zr}^{4+}(aq)\;{\longrightarrow}\;\text{Al}^{3+}(aq)\;+\;\text{Zr}(s)
(b) \text{Ag}^{+}(aq)\;+\;\text{NO}(g)\;{\longrightarrow}\;\text{Ag}(s)\;+\;\text{NO}_3^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(acidic\;solution)}
(c) \text{SiO}_3^{\;\;2-}(aq)\;+\;\text{Mg}(s)\;{\longrightarrow}\;\text{Si}(s)\;+\;\text{Mg(OH)}_2(s)\;\;\;\;\;\;\;\text{(basic\;solution)}
(d) \text{ClO}_3^{\;\;-}(aq)\;+\;\text{MnO}_2(s)\;{\longrightarrow}\;\text{Cl}^{\;\;-}(aq)\;+\;\text{MnO}_4^{\;\;-}(aq)\;\;\;\;\;\;
- Identifica la specie ossidata, la specie ridotta, l’agente ossidante e l’agente riducente per tutte le reazioni del problema precedente.
- Dalle informazioni fornite, usa la notazione di cella per descrivere i seguenti sistemi:
(a) In una semicella, una soluzione di Pt(NO3)2 forma Pt metallo, mentre nell’altra semicella, Cu metallo va in una soluzione di Cu(NO3)2 con tutte le concentrazioni di soluto 1 M.
(b) Il catodo consiste in un elettrodo di oro in una soluzione 0,55 M Au(NO3)3 e l’anodo è un elettrodo di magnesio in 0.75 M Mg(NO3)2.
(c) Una semicella consiste in un elettrodo d’argento in una soluzione 1 M AgNO3, e nell’altra semicella, un elettrodo di rame in 1 M Cu(NO3)2 viene ossidato.
- Perché è necessario un ponte salino nelle celle galvaniche come quella in figura 2?
- Si è scoperto che un elettrodo attivo (metallico) perde massa quando si lascia procedere la reazione di ossido-riduzione. L’elettrodo faceva parte dell’anodo o del catodo? Spiega.
- Gli elettrodi attivi partecipano alla reazione di ossido-riduzione. Poiché i metalli formano cationi, l’elettrodo perderebbe massa se gli atomi di metallo nell’elettrodo si ossidassero e andassero in soluzione. L’ossidazione avviene all’anodo.
- La massa di tre diversi elettrodi metallici, ognuno proveniente da una diversa cella galvanica, è stata determinata prima e dopo che la corrente generata dalla reazione di ossido-riduzione in ogni cella è stata lasciata scorrere per alcuni minuti. Il primo elettrodo di metallo, indicato con l’etichetta A, è risultato essere aumentato di massa; il secondo elettrodo di metallo, indicato con l’etichetta B, non è cambiato di massa; e il terzo elettrodo di metallo, indicato con l’etichetta C, è risultato aver perso massa. Fai un’ipotesi educata su quali elettrodi erano attivi e quali erano elettrodi inerti, e quali erano anodo(i) e quali erano catodo(i).
Lossario
elettrodo attivo elettrodo che partecipa alla reazione di ossido-riduzione di una cella elettrochimica; la massa di un elettrodo attivo cambia durante la reazione di ossido-riduzione elettrodo anodico in una cella elettrochimica in cui avviene l’ossidazione; le informazioni sull’anodo sono registrate sul lato sinistro del ponte di sale in notazione di cella elettrodo catodico in una cella elettrochimica in cui avviene la riduzione; le informazioni sul catodo sono registrate sul lato destro del ponte di sale in notazione di cella notazione di cella modo sintetico per rappresentare le reazioni in una cella elettrochimica differenza di potenziale elettrico che si verifica quando metalli dissimili sono collegati; la forza motrice per il flusso di carica (corrente) nelle reazioni di ossido-riduzione cella galvanica cella elettrochimica che comporta una reazione spontanea di ossido-riduzione; celle elettrochimiche con potenziali di cella positivi; chiamata anche cella voltaica elettrodo inerte elettrodo che permette alla corrente di fluire, ma che non partecipa altrimenti alla reazione di ossido-riduzione in una cella elettrochimica; la massa di un elettrodo inerte non cambia durante la reazione di ossido-riduzione; gli elettrodi inerti sono spesso fatti di platino o oro perché questi metalli sono chimicamente non reattivi. cella voltaica altro nome per una cella galvanica
Soluzioni
Risposte agli esercizi di fine capitolo di chimica
1. (a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Ni}^{2+}(aq){\mid}\text{Ni}(s); (b) \text{Cu}(s){\mid}\text{Cu}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s); (c) \text{Mn}(s){\mid}\text{Mn}^{2+}(aq){\parallel}\text{Sn}^{2+}(aq){\mid}\text{Sn}(s); (d) \text{Pt}(s){\mid}\text{Cu}^{+}(aq)\text{,\;Cu}^{2+}(aq){\parallel}\text{Au}^{3+}(aq){\mid}\text{Au}(s)
3. (a) \text{Mg}(s)\;+\;\text{Cu}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Cu}(s); (b) 2\text{Ag}^{+}(aq)\;+\;\text{Ni}(s)\;{\longrightarrow}\;\text{Ni}^{2+}(aq)\;+\;2\text{Ag}(s)
5. Specie ossidate = agente riducente: (a) Al(s); (b) NO(g); (c) Mg(s); e (d) MnO2(s); Specie ridotte = agente ossidante: (a) Zr4+(aq); (b) Ag+(aq); (c) \testo{SiO}_3^{\testo;\testo;2-}(aq); e (d) \testo{ClO}_3^{\testo;\testo;-}(aq)
7. Senza il ponte di sale, il circuito sarebbe aperto (o rotto) e nessuna corrente potrebbe scorrere. Con un ponte di sale, ogni semicella rimane elettricamente neutra e la corrente può scorrere attraverso il circuito.
9. Si è scoperto che un elettrodo attivo (di metallo) guadagnava massa man mano che la reazione di ossido-riduzione veniva lasciata procedere. L’elettrodo faceva parte dell’anodo o del catodo? Spiegare.