Al suo più semplice, una cella elettrochimica consiste di due conduttori di elettroni separati da un conduttore ionico e collegati da un conduttore di elettroni.
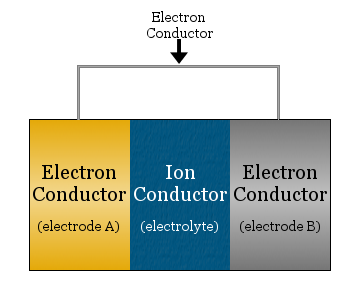
- il conduttore ionico è chiamato elettrolita
- i conduttori di elettroni separati dall’elettrolita sono chiamati elettrodi
- il conduttore di elettroni usato per collegare gli elettrodi è spesso un filo metallico, come i fili di rame
Due tipi di cella
Ci sono due tipi fondamentali di cella elettrochimica: galvanica ed elettrolitica.
La conversione di energia è ottenuta tramite reazioni redox spontanee (ΔG < 0) che producono un flusso di elettroni.
Un flusso di elettroni guida reazioni redox non spontanee (ΔG ≥ 0).
Esempi
- Una batteria che alimenta qualcosa è un esempio di cella galvanica.
- Le batterie ricaricabili sono esempi di entrambi i tipi di cellule: funzionano come cellule galvaniche quando alimentano un dispositivo e come cellule elettrolitiche quando vengono ricaricate.
- Esempi di cellule elettrolitiche includono anche quelle usate per dividere l’acqua in idrogeno e ossigeno, e quelle che convertono il minerale di alluminio in alluminio metallico.
Una fonte di dati termodinamici
Oltre agli usi pratici, come quelli descritti sopra, le celle elettrochimiche forniscono un modo eccellente di raccogliere dati termodinamici. Per esempio, esse permettono di determinare potenziali redox standard, da cui si possono ottenere comodamente dati standard di entalpia, entropia standard ed energia libera di Gibbs per le reazioni.
Ripartizione di reazioni
Le celle elettrochimiche possono:
- fornire elettricità, o
- convertire i minerali metallici in metallo, o
- fornire dati termodinamici,
perché le reazioni redox avvengono separatamente.
esempio: La cella Daniell
Nelle celle elettrochimiche, le reazioni avvengono in elettrodi separati – e in effetti gli elettrodi stessi possono essere collocati in recipienti diversi.Consideriamo una delle prime celle galvaniche, la cella Daniell.
La fonte di energia della cella Daniell è la reazione spontanea dello zinco metallico con il solfato di rame per produrre solfato di zinco e rame metallico.
ΔG° = -212.6 kJ mol-1
Quando i materiali sono messi insieme:
- a contatto diretto in un recipiente, l’energia potenziale chimica è convertita in energia termica e il recipiente di reazione si riscalda
- in una cella elettrochimica, l’energia potenziale chimica è convertita in energia elettrica
La cella Daniell
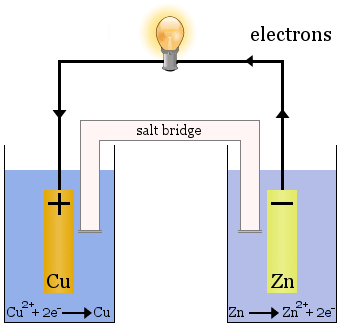
La cella Daniell è composta da due semicelle: gli ioni di rame si riducono in una e lo zinco si ossida nell’altra.
Quando la cella funziona, Cu2+ viene rimosso da una cella e Zn2+ viene prodotto nell’altra cella.L’elettrodo di rame comincia a crescere mentre viene placcato con metallo di rame appena depositato, e l’elettrodo di zinco comincia a diminuire a causa della perdita di zinco come ioni in soluzione.
Il ponte salino nel caso sopra è un tubo di vetro pieno di soluzione satura di KNO3.Ha delle fritte alle estremità che impediscono la miscelazione delle soluzioni in ciascuna delle semicelle, ma permette agli ioni di passare attraverso per completare il circuito elettrico e mantenere ogni semicella elettricamente neutra.
La forza motrice è la stessa ΔG° = -212.6 kJ mol-1 che si ottiene mescolando semplicemente i reagenti in un recipiente; separando le due semireazioni, gli elettroni devono viaggiare attraverso il filo e possiamo usare l’energia elettrica.
