- Review Article
- Fistola enterocutanea: Evidence-based Management
- Abstract
- Introduzione
- Tabella 1
- Tabella 1: Classificazione.
- Tabella 2
- Tabella 2: Variabili prognostiche ECF.
- Classificazione
- Fattori prognostici per ECF
- Diagnosi
- Figura 1
- Gestione
- Rianimazione
- Controllo della fonte
- Gestione dell’effluente
- Cura della ferita
- Tabella 3
- Tabella 3: Tempi di gestione definitiva.
- Nutrizione
- Conclusione
Review Article
Fistola enterocutanea: Evidence-based Management
Ryan P Dumas1*, Sarah A Moore1 e Carrie A Sims2
1Department of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
2Dipartimento di Chirurgia, Divisione di Traumatologia, Cure Critiche Chirurgiche & Chirurgia d’Emergenza, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
*Autore corrispondente: Ryan P Dumas, Department ofTraumatology, Surgical Critical Care& Emergency Surgery, Perelman School of Medicine at the University ofPennsylvania, 51 N. 39th Street, MOBSuite 120, Philadelphia, PA 19104,USA
Abstract
La gestione della fistola enterocutanea (ECF) è una competenza clinica che dovrebbe essere nell’armamentario di ogni chirurgo generale. Anche se il trattamento definitivo si basa spesso sulla chiusura chirurgica, la cura pre-operatoria e la diligenza sono fondamentali per garantire un esito positivo. La cura di questi pazienti dovrebbe concentrarsi su quattro fasi chiave. La prima fase è caratterizzata da un adeguato riconoscimento e rianimazione. Durante la seconda fase, si intraprende una valutazione e un piano nutrizionale completo. La valutazione radiografica durante la terza fase aiuta a definire l’anatomia della ECF. Infine, la quarta fase è caratterizzata dalla chiusura definitiva nel caso in cui la fistola non riesca a guarire spontaneamente. Questa revisione si concentrerà sugli aspetti chiave che definiscono ogni fase e che aiutano il chirurgo generale a massimizzare le possibilità di un esito positivo.
Introduzione
Lo sviluppo di una fistola enterocutanea (ECF), definita come una connessione anomala tra il lume intestinale e la cute esterna, è una fonte significativa di morbilità e mortalità nonostante i progressi sia chirurgici che medici. L’incidenza complessiva di ECF, tuttavia, è unknownwith la maggior parte dei dati riguardanti ECF provenienti in forma di grande istituzionale retrospettiva orsurgeon-specific serie. Notevole, solo il 25% di tutti gli ECF sono secondari alla malattia infiammatoria intestinale, patologia diverticolare, trauma, radiazioni e malignità. Al contrario, quasi il 75% di tutte le ECF sono il risultato diretto della chirurgia laparoscopica o aperta con una perdita astomotica a seguito dienterectomia che è responsabile di oltre il 50% di queste fistole. Le lesioni iatrogene involontarie come le enterotomie o le lesioni termiche non riconosciute subite nel corso di un’operazione sono responsabili delle restanti fistole. Poiché l’ECF è più comunemente un problema creato dal chirurgo, l’onere della prevenzione così come la gestione appropriata, la pianificazione e il trattamento definitivo ricadono giustamente sul chirurgo.
Morbidità e mortalità dopo l’ECF sono estremamente elevate. Si stima che il 90% dei pazienti sperimenterà una morbilità legata all’ECF che va dall’escoriazione della pelle, alla disidratazione, alla sepsi; inoltre, la mortalità attribuibile a un ECF varia dal 5 al 20% e dipende da una serie di fattori tra cui l’infezione sottostante e la posizione della fistola. Poiché la principale causa di morte nei pazienti con ECF è la sepsi, il controllo della fonte rimane una delle pietre miliari della terapia. In serie retrospettive, si è notato che la mortalità aumenta di 16 volte in caso di sepsi e di 22 volte in caso di infezione incontrollata. Come tale, il trattamento precoce e definitivo delle raccolte non drenate in combinazione con antimicrobici a breve termine ha il potenziale di migliorare significativamente gli esiti. Nella maggior parte delle serie, la mortalità sembra anche correlata all’uscita e alla posizione della fistola. La mortalità aumenta dal 26% nelle fistole a basso rendimento al 50% per quelle ad alto rendimento, a causa delle sfide in termini di fluidi, elettroliti e nutrizione associate alla gestione dell’ECF. La mortalità è anche correlata alla posizione e diminuisce con le fistole più distali. Mentre le fistole digiunali hanno la mortalità più alta al 29% e sono significativamente più difficili da gestire, la mortalità da fistola colonica è la più bassa al 6%. Si stima che il costo della gestione della ECF sia ben superiore a 500.000 dollari e richiede un team multidisciplinare di nutrizionisti, infermieri per la cura delle ferite e chirurghi per garantire un buon risultato. L’importanza dei centri di trattamento ad alta specializzazione non dovrebbe essere sottovalutata e ha dimostrato di ridurre significativamente la mortalità dal 42% al 20%.
Tabella 1

| Anatomica | Prossimale o distale | Gastrica, duodenale, digiunale, ileale, colonico |
| Fisiologico | Gestione alta, moderata, bassa | Gestione alta >500 cc/giorno Moderata 200-500cc/giorno Gestione bassa < 200cc/giorno |
| Eziologia | Iatrogena vs. spontanea Traumatica |
Maligna Radiazioni Malattia infiammatoria intestinale Diverticolare |
Tabella 1: Classificazione.
Tabella 1
Classificazione.
Tabella 2

| Favorevole | INFAVOREVOLE |
|---|---|
| Nutrizionalmente completo | Nutrizionalmente povero |
| – Albumina >3.0 | Bassa albumina, bassa transferrina |
| Tratto di fistola lunga (>2cm) | Fistola corta, fistole multiple e complesse |
| Fistola diverticolare | Grande difetto enterale (>1cm), mucosa visibile |
| Bassa produzione | Alta produzione (>500cc/giorno) |
| Fistola singola | Radiazioni precedenti |
| Continuità intestinale | Più operazioni precedenti |
| Operazione indice eseguita nello stesso centro | Riferimento esterno a un centro ad alto |
Tabella 2: Variabili prognostiche ECF.
Tabella 2
Variabili prognostiche ECF.
Classificazione
Non esiste uno schema di classificazione universale o ben stabilito per le ECF. Le fistole sono generalmente classificate anatomicamente, fisiologicamente o per processo patologico. Le fistole possono inoltre essere classificate in base alla quantità di uscita giornaliera. È imperativo che la produzione della fistola sia accuratamente documentata poiché la quantità può dettare cambiamenti nella gestione. La tabella 1 dettaglia tre diversi paradigmi di classificazione.
Fattori prognostici per ECF
I fattori prognostici per ECF sono stati descritti molto bene e sono coerenti con il dogma chirurgico standard. I pazienti con una fistola prossimale ad alto rendimento accompagnata da una bassa albumina (. Al contrario, i pazienti senza comorbidità che hanno fistole che sono il risultato di una procedura chirurgica e sono a basso rendimento si comportano più favorevolmente con una maggiore chiusura spontanea. La tabella 2 dettaglia molte delle variabili che possono predire un esito positivo.
L’importanza del supporto istituzionale e della competenza multidisciplinare come fattore prognostico positivo non può essere enfatizzata eccessivamente.molteplici studi hanno confermato l’esperienza istituzionale e il volume come fattori critici nella diminuzione della morbilità e nel miglioramento della mortalità. Recentemente, la Canadian Association for EnterostomalTherapy ha codificato l’importanza delle cure multidisciplinari identificando nove membri essenziali del team nelle loro raccomandazioni di “ECF Best Practice”. Spaziando dai chirurghi ai farmacisti ai cappellani, questo approccio integrato del team riconosce l’esperienza che ogni specialità porta nella cura di questi pazienti complessi.
Diagnosi
Un decorso post-operatorio complicato da ileo e lo sviluppo di un’infezione post-operatoria della ferita è foriero di ECF. Una volta che una fistola è sospettata o è stata identificata all’esame fisico, gli studi radiologici sono complementi necessari e il 97% di tutti i pazienti viene sottoposto a qualche forma di valutazione radiologica. La TAC con contrasto è essenziale in quanto valuta la presenza di un ascesso associato o di una raccolta non drenata. Una volta che il controllo della fonte è stato ottimizzato, la fistulografia fluoroscopica gioca un ruolo importante nella definizione dell’anatomia della fistola. Un fistologramma aiuterà a localizzare l’origine, determinare la lunghezza, valutare la presenza di ostruzione distale e determinare se la fistola è in continuità con il resto dell’intestino. Una volta che la diagnosi di una ECF è stata confermata, l’attenzione dovrebbe spostarsi sulla gestione.
Figura 1
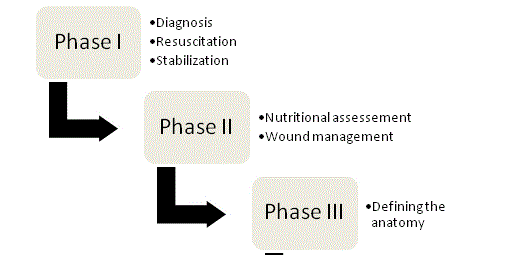
Figura 1
Quattro fasi di gestione dell’ECF.
Gestione
I principi della gestione dell’ECF sono stati sostenuti per la prima volta da Chapman e colleghi nel 1964 e ad oggi rimangono le pietre miliari della terapia. Nel loro articolo originale, Chapman et al. identificarono quattro fattori chiave: rianimazione dei fluidi, controllo della fonte, gestione degli effluenti e protezione della pelle. L’importanza della nutrizione è emersa recentemente come quinto elemento chiave. Un approccio organizzato e sistematico dovrebbe essere intrapreso con ogni paziente con fistola per ottimizzare le possibilità di successo; la gestione può essere suddivisa in quattro fasi (Figura 1).
Rianimazione
La rianimazione di un paziente con una nuova diagnosi di ECF segue molti degli stessi principi della rianimazione dei pazienti settici e i principi della Surviving Sepsis Campaign dovrebbero servire come quadro di riferimento. La cura iniziale dovrebbe concentrarsi sulla rianimazione aggressiva dei fluidi, sulla rapida valutazione e correzione degli squilibri elettrolitici e sulla normalizzazione dell’acidosi lattica. I pazienti con ECF sono comunemente iponatriemici, ipokaliemici e acidotici a causa delle perdite gastrointestinali in corso. I pazienti con fistole ad alto rendimento dovrebbero avere perdite di fluidi, elettroliti e bicarbonato sostituiti per via endovenosa per evitare la disidratazione e la profonda instabilità metabolica durante il periodo di stabilizzazione iniziale. Un attento monitoraggio della produzione di urina e la sostituzione mirata dell’effluente della fistola ogni 4-8 ore preverranno la disidratazione in corso.
Controllo della fonte
Una volta che il paziente è stato rianimato, l’attenzione dovrebbe spostarsi verso la determinazione del controllo della fonte. Come menzionato in precedenza, una TAC con contrasto è utile per identificare le raccolte non drenate e gli ascessi. Nei pazienti post-operatori, il controllo della fonte è molto probabilmente realizzato dalla radiologia interventistica. Tuttavia, di fronte a raccolte inaccessibili o a sepsi intra-addominali incontrollate, un’operazione può essere inevitabile. Gli antibiotici empirici ad ampio spettro per via venosa non dovrebbero essere usati di routine per trattare l’ECF a meno che non vi siano prove di raccolte intra-addominali o di infezione della ferita con una cellulite associata. Quando possibile, gli antibiotici dovrebbero essere mirati a dati di coltura specifici e limitati a non più di 2 settimane.
Gestione dell’effluente
La gestione dell’effluente di successo può avere un impatto significativo sullo stato del volume, sull’equilibrio elettrolitico, sulla nutrizione e sull’integrità della pelle.L’uso di inibitori della pompa protonica può raggiungere entrambi gli obiettivi e la dose dovrebbe essere titolata fino a quando il pH dell’effluente è maggiore di 6 e il volume di uscita è inferiore a 1L/giorno. Anche se lo psillio può essere estremamente utile per gonfiare l’effluente e aumentare il tempo di transito, gli agenti antimotili e antisecretori, tra cui loperamide, atropinedifenossilato, codeina, tintura di oppio e persino metadone, sono il pilastro della riduzione del volume. Dato il suo ruolo di inibitore universale dell’ormone gastrointestinale, una grande quantità di ricerche è stata spesa per studiare gli effetti della somatostatina esogena sui pazienti con ECF. Nonostante un numero significativo di studi randomizzati controllati, conclusioni significative sono difficili da delucidare secondaria alla dimensione smallsample e disegno di studio incoerente. Octreotide, un analogo più duraturo della somatostatina, è stato anche studiato come congiunzione ECFad con risultati promettenti. Octreotide 100 mcg tre volte al giorno può ridurre il volume dell’effluente e ha dimostrato di diminuire il tempo di chiusura spontanea in alcuni studi. Come tale, un trial di terapia con octreotide per 72 ore con stretto monitoraggio dell’uscita della fistola può essere garantito, in particolare nei casi in cui altre terapie non sono riuscite a diminuire il volume di uscita. Gli effetti collaterali comuni includono iperglicemia, mal di testa e colelitiasi.
Mentre i dati sono chiari che le fistole a basso output hanno un tasso maggiore di chiusura spontanea, è meno chiaro che diminuire il volume di output migliorerà la chiusura della fistola. Ciononostante, diminuire il volume di uscita può alleviare significativamente il peso della gestione delle fistole e avere un impatto positivo sul benessere del paziente.
Cura della ferita
Forse uno degli aspetti più impegnativi e che richiede risorse della gestione della ECF è il controllo locale degli effluenti. Il successoenterico può rompere rapidamente la pelle e causare irritazioni difficili da trattare. Come tale, la gestione appropriata della pelle con creme barriera, barriere di umidità, apparecchi di imbustamento e dispositivi di aspirazione sono fondamentali. Le fistole ad alto rendimento, in particolare, spesso richiedono una rete intricata di drenaggi, sacche e aspirazione per controllare adeguatamente gli effluenti. Squadre altamente specializzate per la cura delle ferite e terapisti enterostomali sono inestimabili sia per la gestione delle ferite che per il comfort del paziente. Con l’uso onnipresente della terapia a pressione negativa (NPT) per la gestione delle ferite e degli addomi aperti, non è sorprendente che la NPT sia diventata parte dell’armamentario chirurgico per trattare le ECF. Nella più grande serie fino ad oggi, Wainstein et al. hanno riportato la loro esperienza con 91 pazienti con fistole ad alto rendimento trattati con una pressione negativa che va da -350 a -600 mmHg. Oltre a diminuire significativamente la produzione di effluenti da una media di 1400 cc/giorno a 138 cc/giorno, la chiusura spontanea è stata raggiunta nel 46% dei pazienti.Nel 2016, Misky et al. hanno pubblicato una meta-analisi sull’uso della NPT nella ECF. Utilizzando dieci studi retrospettivi con un totale di 151 pazienti, questi autori hanno scoperto che il tasso mediano di chiusura spontanea era del 65% (variando dal 7% al 100%) con un tempo mediano alla chiusura di 58 giorni. Questi ricercatori hanno anche riportato un tasso di nuove fistole del 4,4%, una complicazione nota che ha fatto riflettere alcuni professionisti.Mentre sono chiaramente necessarie ulteriori indagini per determinare se la NPT può migliorare definitivamente i tassi di chiusura dell’ECF o diminuire il tempo di chiusura spontanea, i benefici di queste medicazioni non dovrebbero essere trascurati. Come minimo, questa tecnologia può facilitare la gestione dell’ECF controllando l’effluente, proteggendo la pelle e diminuendo la frequenza dei cambi di medicazione.
Tabella 3

| Investigatori | Pratica istituzionale |
|---|---|
| Hollington | 8 mesi |
| Evenson | 4 mesi |
| Rahbour | 12 Mesi |
| Datta | 6 Mesi |
| Lynch | 6 Mesi |
| Li | 6 mesi |
| Mcintyre | 6 mesi |
Tabella 3: Tempi di gestione definitiva.
Tabella 3
Tempistica per la gestione definitiva.
Nutrizione
ValutazioneLo stato nutrizionale di un paziente ECF è di fondamentale importanza. Prima dell’avvento delle formule enterali a base di peptidi e della nutrizione parenterale totale (TPN), le serie storiche retrospettive evidenziano il peso della malnutrizione nei pazienti con ECF. In una serie di 157 pazienti negli anni ’50 e ’60, quasi il 75% dei pazienti con fistole prossimali erano malnutriti. Risultati simili sono stati riportati da Chapman et al. che hanno scoperto che solo una piccola minoranza di pazienti aveva una nutrizione ottimale; e che una volta che la nutrizione è stata migliorata, la mortalità legata alla ECF è scesa dal 55% al 12-16%.
Una valutazione nutrizionale completa dovrebbe essere eseguita su ogni paziente con una ECF. Sebbene l’equazione di Harris-Benedict fornisca un buon punto di partenza per calcolare i requisiti nutrizionali, è ampiamente accettato che i pazienti con ECF sono catabolici e ipermetabolici. In generale, questi pazienti richiedono un maggiore supporto calorico con almeno 25-30 kcal/kg/giorno in carboidrati e grassi e 1,5-2 grammi di proteine/kg/giorno. Oltre ai pesi giornalieri, dovrebbero essere seguiti i laboratori di nutrizione regolari come l’albumina, la prealbumina, il trasferimento e la CRP. L’albumina preoperatoria, in particolare, ha dimostrato di essere il più forte predittore di mortalità e morbilità dopo l’intervento di chirurgia generale e l’ipoalbuminemia rimane un significativo predittore di cattivi esiti nei pazienti ECF. Forse la proteina più studiata nell’ECF, tuttavia, è la transferrina e livelli superiori a 140 sono stati associati a un aumento dei tassi di chiusura spontanea e a una mortalità ridotta. Anche se il bilancio dell’azoto può essere uno strumento utile, questa misura standard può essere difficile in pazienti con fistole ad alta uscita. Ulteriori test come la calorimetria indiretta possono essere presi in considerazione nei casi più complessi che non rispondono alle cure standard.
Nutrizione parenterale vs. nutrizione enterale
La nutrizione parenterale ha giocato un ruolo critico nella gestione dell’ECF con il suo uso fermamente stabilito da Dudrick nel 1969.Nel suo articolo sentinella che descrive la gestione ottimale della TPN, Dudrick ha concluso che: “con l’uso esclusivo dell’iperalimentazione parenterale, l’aumento di peso, il bilancio dell’azoto positivo, la crescita e lo sviluppo si ottengono regolarmente”. Da allora, la TPN è stata universalmente adottata come mezzo per fornire nutrizione mentre promuove il “riposo intestinale” e semplifica la gestione degli effluenti. Mentre la TPN riduce le secrezioni GI del 30%-50%, riducendo così l’incidenza della disidratazione e degli squilibri elettrolitici, non ci sono studi randomizzati che affrontano l’impatto della TPN sulla conversione anabolica, sui tassi di chiusura spontanea o sulla mortalità. Ciononostante, la TPN rimane una modalità popolare di trattamento a lungo termine, nonostante le gravi complicazioni tra cui l’infezione e la disfunzione epatica.
Più recentemente, tuttavia, l’uso della nutrizione enterale in ECF ha guadagnato terreno. L’uso della nutrizione enterale ha una serie di vantaggi, tra cui un costo ridotto, meno infezioni e una migliore funzione immunologica rispetto alla TPN. Inoltre, anche fornendo solo il 20% delle calorie attraverso una via enterale può aiutare a mantenere la flora intestinale e diminuire la traslocazione batterica. Diverse serie hanno riportato un successo sorprendente con l’alimentazione enterale nei pazienti ECF. In una serie retrospettiva di Li et al. l’86,4% di 1168 pazienti sono stati gestiti efficacemente con la nutrizione enterale, che può anche essere utilizzata con successo nell’impostazione della fistola ad alto rendimento se combinata con formule elementari, agenti antimotilità e agenti di carica della fibra. In una serie di 335 pazienti con fistole ad alto rendimento, Levy et al. sono stati in grado di raggiungere con successo l’indipendenza dalla TPN nell’85% della loro coorte utilizzando l’alimentazione enterale. È interessante notare che, nonostante la nutrizione enterale e la mancanza di “riposo intestinale”, la mortalità e i tassi di chiusura spontanea sono stati simili alle serie precedenti.
Nel contesto di una ECF ad alto rendimento con un arto mucocutaneo distale, la fistuloclisi può essere un importante complemento all’alimentazione enterale standard. La pratica della fistuloclisi ha avuto origine dalla pratica della rialimentazione del chimo nei neonati e può riferirsi sia alla rialimentazione di successo che all’integrazione di ulteriori alimentazioni enterali mediante un catetere inserito nell’arto distale di un ECF. Teubner et al. hanno descritto per la prima volta la fistuloclisi come terapia per l’ECF nel 2004 in una serie di casi di dodici pazienti con fistole prossimali. Da allora, una serie di case report e piccole serie hanno dimostrato l’efficacia nutrizionale di questa tecnica. Rispetto a una coorte corrispondente di pazienti che ricevono TEN senza fistuloclisi, i pazienti con fistole ad alto rendimento trattati con fistuloclisi avevano parametri nutrizionali e di funzionalità epatica significativamente migliorati. La fistuloclisi può essere particolarmente utile nei pazienti che sviluppano complicazioni legate alla TPN, tra cui infezioni, problemi di accesso venoso o insufficienza epatica. Complicationshowever, può verificarsi e può includere l’ostruzione dovrebbe l’attività peristaltica del piccolo intestino avanzare il catetere fistola distalmente in thesmall bowel.
Vitamine e minerali sono spesso impoverito in ECF patients.Deficiencies in vitamine liposolubili sono comuni, mentre deficienciesin vitamine idrosolubili sono rare a meno che la fistola è all’interno del digiuno prossimale. Inoltre, poiché la vitamina B12 viene assorbita solo nei 50-60 cm terminali dell’ileo, la vitamina B12 iniettabile può essere necessaria in molti pazienti ECF. Il magnesio è spesso sprecato nelle fistole ad alto rendimento e dovrebbe essere reintegrato con solfato di magnesio per via endovenosa o cloruro di magnesio per via orale per un migliore assorbimento enterale. Infine, è stata raccomandata una dose elevata di zinco e vitamina C. Mentre l’Omega-3 e l’olio di pesce sono stati studiati in terapia intensiva con qualche beneficio, questi integratori non sono mai stati valutati in pazienti con ECF e non sono usati abitualmente. Questa vasta gamma di tassi di chiusura riflette probabilmente le differenze nelle popolazioni di pazienti e nei modelli di pratica istituzionale. Le fistole hanno significativamente meno probabilità di chiudersi spontaneamente oltre le 4 settimane e solo il 10% delle fistole si chiude dopo due mesi. Poiché i tassi di chiusura spontanea dell’ECF sono bassi, l’intervento chirurgico è spesso l’unica strategia di gestione definitiva.
La decisione di operare un ECF, tuttavia, non dovrebbe essere presa alla leggera poiché i tassi di recidiva dopo la rimozione dell’ECF vanno dal 13 al 34%. Anche se i principi dell’intervento chirurgico per la ECF coinvolgono molti dei principi fondamentali della chirurgia generale, il tempo di intervento è forse il fattore più importante da considerare. Fazioet al hanno dimostrato l’importanza della gestione dell’attesa quando si tratta di pazienti con ECF. Quando l’intervento è avvenuto a meno di 6 settimane dal momento della formazione dell’ECF, la mortalità superava il 20%. Ritardando l’intervento più di 6 settimane, tuttavia, la mortalità è scesa all’11%. In una serie di Lynch et al., i pazienti operati tra 2 e 12 settimane formazione ECF aveva un tasso di recidiva del 28%, mentre un ritardo più lungo di 12 settimane diminuito questo tasso al 15%. La tabella 3 mostra la lunghezza del tempo che gli autori esperti suggeriscono di aspettare prima di considerare l’intervento chirurgico per un ECF non cicatrizzante.
La gestione operativa dovrebbe essere perseguita solo con il pieno investimento e la comprensione sia del paziente che del chirurgo. Le ECF sono casi lunghi e tecnicamente impegnativi con il rischio di complicazioni significative. Le operazioni spesso richiedono la completa smobilitazione dell’intestino dal legamento di Treitz al retto. Dato che il 36% delle fistole ricorrenti sono il risultato di lesioni create durante l’operazione di chiusura dell’ECF, grande attenzione dovrebbe essere presa durante la lisi delle aderenze per evitare qualsiasi lesione involontaria dell’intestino sano. La gestione dell’intestino fistoloso dovrebbe sempre comportare una resezione intestinale e un’astomosi primaria. Sopra la cucitura o la resezione del bordo della fistola si traduce invariabilmente in una maggiore recidiva (36% vs 16%).
Conclusione
La fistola entero cutanea è una delle più impegnative complicazioni che il chirurgo generale deve affrontare. L’utilizzo di un approccio attento, sistematico e centrato sul paziente aiuterà a massimizzare i risultati clinici di successo. Nonostante la coerenza dei principi della gestione dell’ECF tra i pazienti, ogni fistola è unica e la sua gestione è definita in gran parte dalla sua produzione, nonché dalla sua localizzazione e dalle co-morbidità del paziente. Anche se i chirurghi e i pazienti possono avere un forte desiderio di procedere con la chiusura chirurgica, i pazienti sono meglio serviti da almeno 6 mesi di gestione non operativa. In definitiva, la cura a lungo termine dei pazienti ECF richiede, multi-disciplinare spesso coordinato dal chirurgo.
- Hollington P, Mawdsley J, Lim W, Gabe SM, Forbes A, Windsor AJ. Un’esperienza di 11 anni di fistola enterocutanea. Br J Surg. 2004; 91:1646-51.
- Li J, Ren J, Zhu W, Yin L, Han J. Gestione delle fistole enterocutanee: 30 anni di esperienza clinica. Chin Med J (Engl). 2003;116:171-5.
- McIntyre PB, Ritchie JK, Hawley PR, Bartram CI, Lennard-Jones JE. Gestione delle fistole enterocutanee: Una revisione di 132 casi. Br J Surg. 1984;71:293-6.
- Soeters PB, Ebeid AM, Fischer JE. Revisione di 404 pazienti con fistole gastrointestinali. Impatto della nutrizione parenterale. Ann Surg. 1979;190:189-202.
- Rahbour G, Gabe SM, Ullah MR, Thomas GP, Al-Hassi HO, Yassin NA, et al. Sette anni di esperienza di fistola enterocutanea con analisi univariata e multivariata dei fattori associati alla guarigione: sviluppo di un sistema di punteggio convalidato. Colorectal Dis. 2013;15:1162-70.
- Gonzalez-Pinto I, Gonzalez EM. Ottimizzare il trattamento delle fistole gastrointestinali superiori. Gut. 2001;49 Suppl 4:iv22-31.
- Lloyd DA, Gabe SM, Windsor AC. Nutrizione e gestione della fistola enterocutanea. Br J Surg. 2006;93:1045-55.
- Berry SM, Fischer JE. Classificazione e fisiopatologia delle fistole enterocutanee. Surg Clin North Am. 1996;76:1009-18.
- Fischer JE. La fisiopatologia delle fistole enterocutanee. World J Surg. 1983;7:446-50.
- Draus JM, Jr., Huss SA, Harty NJ, Cheadle WG, Larson GM. Fistola enterocutanea: i trattamenti stanno migliorando? Chirurgia. 2006;140:570-6.
- Martinez JL, Luque-de-Leon E, Mier J, Blanco-Benavides R, Robledo F. Systematic management of post-perative enterocutaneous fistulas: factors related to outcomes. World J Surg. 2008;3:436-43.
- Misky A, Hotouras A, Ribas Y, Ramar S, Bhan C. Una revisione sistematica della letteratura sull’uso della chiusura sotto vuoto per la fistola enterocutanea. Colorectal Dis. 2016;18:846-51.
- Campos AC, Andrade DF, Campos GM, Matias JE, Coelho JC. Un modello multivariato per determinare i fattori prognostici nelle fistole gastrointestinali. J Am Coll Surg. 1999;188:483-90.
- Levy E, Frileux P, Cugnenc PH, Honiger J, Ollivier JM, Parc R. Fistole esterne ad alto rendimento del piccolo intestino: gestione con nutrizione enterale continua. Br J Surg. 1989;76:676-9.
- Lundy JB, Fischer JE. Prospettive storiche nella cura dei pazienti con fistola enterocutanea. Clin Colon Rectal Surg. 2010;23:133-41.
- Bleier JI, Hedrick T. Supporto metabolico del paziente con fistola enterocutanea. Clin Colon Rectal Surg. 2010;23:142-8.
- Teixeira PGR, Inaba K, Dubose J, Salim A, Brown C, Rhee P, et al. Fistola enterocutanea complicante la laparotomia del trauma: Un importante onere di risorse. Am Surg. 2009;75:30-2.
- Irving M, White R, Tresadern J. Tre anni di esperienza con un’unità di insufficienza intestinale. Ann R Coll Surg Engl. 1985;67:2-5.
- Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. Fistole enteriche: principi di gestione. J Am Coll Surg. 2009;209:484-91.
- Gribovskaja-Rupp I, Melton GB. Fistola enterocutanea: strategie collaudate e aggiornamenti. Clin Colon Rectal Surg. 2016;29:130-7.
- McNaughton V, Canadian Association for Enterostomal Therapy ECFBPRP, Brown J, Hoeflok J, Martins L, McNaughton V, et al. Summary of best practice recommendations for management of enterocutaneous fistulae from the Canadian Association for Enterostomal Therapy ECF Best Practice Recommendations Panel. J Wound Ostomy Continence Nurs. 2010;37:173-84.
- Evenson AR, Fischer JE. Gestione attuale della fistola enterocutanea. Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract. 2006;10:455-64.
- Chapman R, Foran R, Dunphy JE. Gestione delle fistole intestinali. Am J Surg. 1964;108:157-64.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41:580-637.
- Hesse U, Ysebaert D, de Hemptinne B. Ruolo della somatostatina-14 e dei suoi analoghi nella gestione delle fistole gastrointestinali: dati clinici. Gut. 2001;49:iv11-21.
- Wainstein DE, Fernandez E, Gonzalez D, Chara O, Berkowski D. Trattamento di fistole enterocutanee ad alto rendimento con un dispositivo di compattazione a vuoto. Un’esperienza decennale. World J Surg. 2008;32:430-5.
- Edmunds LH, Jr., Williams GM, Welch CE. Fistole esterne derivanti dal tratto gastro-intestinale. Ann Surg. 1960;152:445-71.
- Polk TM, Schwab CW. Supporto metabolico e nutrizionale del paziente con fistola enterocutanea: un approccio in tre fasi. World J Surg. 2012;36:524-33.
- Gibbs J, Cull W, Henderson W, Daley J, Hur K, Khuri SF. Livello di albumina sierica preoperatoria come predittore di mortalità e morbilità operativa: risultati del National VA Surgical Risk Study. Arch Surg. 1999;134:36-42.
- Martinez JL, Luque-de-Leon E, Ballinas-Oseguera G, Mendez JD, Juarez-Oropeza MA, Roman-Ramos R. Fattori predittivi di recidiva e mortalità dopo la riparazione chirurgica della fistola enterocutanea. Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract. 2012;16:156-63; 63-4.
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE. Può l’alimentazione endovenosa come unico mezzo di supporto nutrizionale crescita nel bambino e ripristinare la perdita di peso in un adulto? Una risposta affermativa. Ann Surg. 1969;169:974-84.
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. Nutrizione enterale versus parenterale in pazienti critici: una revisione sistematica aggiornata e una meta-analisi di studi randomizzati controllati. Crit Care. 2016;20:117.
- Teubner A, Morrison K, Ravishankar HR, Anderson ID, Scott NA, Carlson GL. La fistuloclisi può sostituire con successo l’alimentazione parenterale nel supporto nutrizionale dei pazienti con fistola enterocutanea. British Journal of Surgery. 2004;91:625-31.
- Ham M, Horton K, Kaunitz J. Fistuloclysis: case report and literature review. Nutr Clin Pract. 2007;22:553-7.
- Wu Y, Ren J, Wang G, Zhou B, Ding C, Gu G, et al. La fistuloclisi migliora la funzione epatica e lo stato nutrizionale nei pazienti con fistola enterica superiore ad alto rendimento. Gastroenterol Res Pract. 2014;2014.
- Schecter WP. Gestione delle fistole enterocutanee. Surg Clin North Am. 2011;91:481-91.
- Haffejee AA. Gestione chirurgica delle fistole enterocutanee ad alto rendimento: un’esperienza di 24 anni. Curr Opin Clin Nutr Metab Care. 2004;7:309-16.
- Ross H. Operative surgery for enterocutaneous fistula. Clin Colon Rectal Surg. 2010;23:190-4.
- Lynch AC, Delaney CP, Senagore AJ, Connor JT, Remzi FH, Fazio VW. Esito clinico e fattori predittivi di recidiva dopo la chirurgia della fistola enterocutanea. Ann Surg. 2004;240:825-31.
- Runstrom B, Hallbook O, Nystrom PO, Sjodahl R, Olaison G. Esito di 132 operazioni ricostruttive consecutive per fistola intestinale – operazione a tappe senza anastomosi primaria migliorato risultato in analisi retrospettiva. Scand J Surg. 2013;102:152-7.
- Reber HA, Roberts C, Way LW, Dunphy JE. Gestione delle fistole gastrointestinali esterne. Ann Surg. 1978;188:460-7.