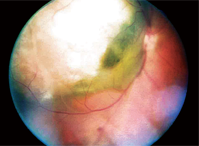
1. Una fotografia del fundus del nostro paziente. Una fotografia del fundus dell’occhio destro del nostro paziente.
Un detenuto maschio bianco di 65 anni si è presentato alla clinica oculistica di un istituto correzionale statale con una lamentela di “bug” nella visione del suo occhio sinistro. Questo accadeva da circa tre settimane; ha negato la fotopsia. La storia sistemica del paziente era significativa per l’ipertensione, i problemi cardiaci (avendo avuto due sostituzioni di valvole) e il diabete di tipo 2 che era controllato con farmaci orali.
L’anamnesi oculare era significativa per una cecità “di lunga data” dell’occhio destro.
In seguito a ulteriori domande su questa cecità di lunga data, abbiamo appreso che, 15 anni prima, il paziente aveva visto uno specialista della retina, che gli disse che aveva una “lentiggine” nell’occhio. Ha riferito di aver perso la vista nell’occhio destro circa 10 anni fa, ma di non aver più visto uno specialista da quella visita di 15 anni fa.
Dati diagnostici
All’esame, l’acutezza visiva del paziente era di sola percezione luminosa O.D., e 20/25 O.S. Le pupille misuravano 4mm O.D. e 3mm O.S. ed erano entrambe rotonde e reattive, con un difetto afferente 3+ O.D. La valutazione del segmento anteriore era notevole per la cataratta sclerotica nucleare. Abbiamo eseguito un esame del fondo dilatato e abbiamo constatato che il reclamo principale del paziente era dovuto a un distacco posteriore del vitreo O.S., che ha causato una sineresi densa e centrale del vitreo. Non abbiamo trovato rotture retiniche o qualsiasi altra cosa di significato clinico in quell’occhio.
L’esame del fondo dilatato dell’occhio destro ha rivelato una grande lesione elevata, di circa 12 diametri del disco, che si estende dal disco ottico temporale, incluso, oltre la macula temporale e oltre l’arcata superiore. Era di colore grigio-bianco con quello che sembrava essere un contenuto fluido nell’aspetto inferiore-nasale (figura 1).
Diagnosi
Abbiamo fatto una diagnosi provvisoria di melanoma coroideale con distacco di retina sierosa, e l’abbiamo documentata con foto del fundus.
Trattamento e follow-up
Abbiamo indirizzato il paziente all’oftalmologo dello staff della struttura per ulteriori valutazioni e trattamenti. Circa due settimane dopo, l’oculista lo ha visto e ha fatto un angiogramma con fluoresceina e un’ecografia A e B-scan. I rapporti di interpretazione per queste procedure erano abbastanza rudimentali; affermavano che le scansioni A e B rivelavano una “massa solida”, e la fluoresceina mostrava che la massa si era riempita di colorante all’inizio e poi era lentamente scomparsa. Dopo questi studi, l’oculista ha posto differenziali di melanoma maligno o degenerazione maculare disciforme. Ha indirizzato il paziente a uno specialista della retina, che lo ha visto pochi giorni dopo la sua consultazione oftalmologica.
Lo specialista della retina ha immediatamente diagnosticato un melanoma coroideale e ha inviato il paziente a uno specialista di oculoplastica quel giorno per discutere il trattamento. I risultati dei test diagnostici dello specialista della retina e dell’oculista non erano disponibili nella cartella del paziente. Sono stati ordinati anche una TAC addominale con contrasto e una radiografia del torace.
Il paziente e lo specialista in oculoplastica hanno deciso per il trattamento con l’enucleazione, e il paziente è stato programmato per l’intervento la settimana successiva. L’enucleazione ebbe successo; tuttavia, il paziente purtroppo ebbe difficoltà con l’anestesia e morì due giorni dopo l’enucleazione. La TAC addominale e le radiografie del torace non erano ancora state completate.
Discussione
I melanomi coroideali sono relativamente rari, con un’incidenza di circa cinque o sei casi su un milione di persone, che equivale a circa 1.400 casi negli Stati Uniti ogni anno.1,2 Si trovano principalmente negli adulti (con il picco intorno ai 55 anni), generalmente non sono familiari e mostrano una leggera predilezione maschile nella maggior parte dei gruppi di età.1,3,4 Si verificano per lo più in persone dalla pelle chiara con iride blu o verde, e si trovano raramente in neri o asiatici.1,4
I pazienti con melanomi coroideali sono spesso asintomatici, ma possono presentare una diminuzione della vista, difetti del campo visivo, floaters, fotopsie o, in rari casi, dolore.4,5 Se si verifica il dolore, di solito è il risultato di un glaucoma secondario o della necrosi del tumore; i melanomi coroideali possono anche causare dolore impattando sui sottostanti nervi ciliari posteriori, ma questo si verifica raramente.3,5
Queste lesioni di solito sono elevate e possono apparire chiazzate, marrone scuro, grigio opaco, grigio-verde o giallo (amelanotico).4-6 Possono assumere una forma a fungo o a cupola con vasi sanguigni congestionati all’interno del tumore – questa configurazione rappresenta il 20% dei melanomi coroideali che erompono attraverso la membrana di Bruch e l’epitelio pigmentato retinico (RPE).1,4,5
I melanomi coroideali spesso mostrano una brusca elevazione dalla coroide, liquido sottoretinico, pigmentazione arancione sulla superficie della lesione e crescita nel tempo.4 Il fluido sottoretinico con conseguente distacco sieroso della retina sottostante è il risultato della rottura dell’RPE. Questi distacchi sierosi spesso si spostano e possono sembrare contenere sangue se il tumore ha attraversato la membrana di Bruch.5
La pigmentazione arancione sottostante è la lipofuscina; questo pigmento è composto da proteine, lipidi e piccoli cromofori, e si accumula nel RPE come risultato della degenerazione cellulare e della digestione incompleta dei segmenti esterni dei fotorecettori.6,7 La lipofuscina non è specifica dei melanomi; può anche essere associata ai nevi coroideali o ad altri tumori coroideali benigni. Tuttavia, la lipofuscina è molto più comunemente vista nei melanomi che nelle controparti benigne.5
Altri possibili segni associati ai melanomi coroideali includono emorragie vitreali o cellule vitree pigmentate, drusen sulla superficie del tumore, membrane neovascolari coroideali o anche proptosi se il tumore invade l’orbita.4
Diagnosi differenziali
Esiste una pletora di diagnosi differenziali per i melanomi coroideali melanotici e amelanotici, che variano sul continuum prognostico di gravità.
– I nevi coroidei sono una differenziale importante. Sono comuni tumori melanocitari benigni e si trovano in circa il 2%-6,5% della popolazione bianca.8-10 I nevi sono di solito grigio ardesia e relativamente piatti (meno di 2 mm di spessore), anche se c’è una significativa sovrapposizione di dimensioni tra i piccoli melanomi e i nevi più grandi.8,9 Come i melanomi coroideali, essi possono anche mostrare drusen o lipofuscina sovrapposti (figura 2). Statisticamente, di ogni 500 nevi coroideali, uno andrà incontro a trasformazione maligna se seguito per 10 anni; il tasso annuale stimato di trasformazione maligna è di uno su 8.845.6,9
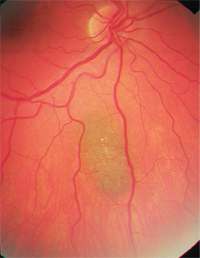
2. Nevo coroideale con sovrastante drusen o lipofuscina Ci sono molteplici fattori di rischio noti per tale trasformazione (vedere “Trasformazione maligna”).4,8 Il più importante sembra essere lo spessore iniziale del nevo superiore a 2 mm, ma anche un grande diametro della base (superiore a 7 mm) suggerisce una premalignità del nevo.8,9 L’assenza di drusen è un buon indicatore prognostico.7
Se i melanomi coroideali tendono a crescere relativamente rapidamente, i nevi coroideali possono ingrandirsi lentamente per un periodo di diversi anni, non necessariamente indicando una trasformazione maligna. Tale crescita non maligna è più comune nei pazienti più giovani e tende a stabilizzarsi con l’età.11 Quindi, la crescita lenta dei nevi coroideali non è invariabilmente un segno di malignità, soprattutto nei pazienti più giovani senza altri fattori di rischio.11
Interessante, le lesioni pigmentate coroideali con nessuno dei fattori di rischio di cui sopra hanno il 3% di possibilità di crescita in cinque anni; tali lesioni sono solitamente nevi coroideali.9 La presenza di uno dei fattori di cui sopra comporta il 38% di possibilità di crescita, e più del 50% di possibilità di crescita esiste se sono presenti due o più fattori di rischio.9 Il rischio relativo di crescita sale da 1,9 volte a 27,1 volte per la presenza di uno rispetto a tutti e cinque i fattori di rischio.9
– Le metastasi coroideali si riferiscono a un tumore che si è diffuso alla coroide per via ematogena da una neoplasia primaria in un’altra parte del corpo. Quindi, non sono tumori primari come il melanoma coroideale – il più delle volte, sono metastasi dal cancro al seno o al polmone. Queste lesioni di solito appaiono a forma di cupola e di colore giallo crema, e spesso inducono distacchi di retina. Le metastasi coroideali sono spesso bilaterali o multifocali e non appaiono a forma di fungo, a differenza dei melanomi amelonatici.1
– L’ipertrofia congenita del RPE si presenta come lesioni singole o multifocali, pigmentate di scuro, piatte, spesso con lacune ipopigmentate. Sono benigni, di solito non cambiano con il tempo e non richiedono alcun trattamento.1
Il conseguente distacco sieroso della retina e l’elevazione della retina secondaria alla degenerazione maculare legata all’età essudativa (AMD) pone un altro differenziale per il melanoma coroideale. AMD può mostrare emorragie sottoretiniche, essudazione lipidica o torbida, edema maculare grigio sporco o giallo, pieghe coroideali, distacchi epiteliali del pigmento o cicatrici disciformi.1 L’angiografia con fluoresceina aiuta a differenziare tra queste condizioni.
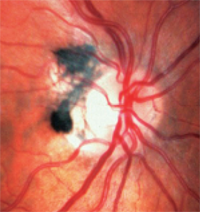
3. I melanocitomi sono scuramente pigmentati e si trovano sul disco ottico o intorno ad esso. A differenza dei melanomi, sono congeniti e spesso si presentano in individui con pigmenti scuri. Di solito sono inattivi, ma possono crescere e raramente svilupparsi in melanomi.1
– Gli emangiomi coroideali sono dilatazioni benigne dei vasi sanguigni coroideali e sono spesso associati alla sindrome di Sturge-Weber. Appaiono elevati e sono di colore rosso-arancione. Come i melanomi coroideali, possono indurre distacchi sierosi della retina.1
– Gli osteomi coroideali sono masse placoidi di colore giallo-arancio. È interessante notare che sono composti da tessuto osseo maturo. Possono permettere lo sviluppo di neovascolarizzazione coroideale e di emorragia sottoretinica. I tratti molto caratteristici li rendono facili da differenziare dai melanomi coroideali utilizzando l’ecografia o la TAC.1
– Ulteriori differenziali per i melanomi coroideali amelonotici o melanotici includono distacco coroideale, linfoma, carcinoma metastatico, ematoma sottoretinico o sub-RPE, ematoma sopracoroidale localizzato, sclerite posteriore nodulare, iperplasia reattiva del RPE o gliosi massiva della retina.4,5
Test aggiuntivi
Vari strumenti possono aiutare nella diagnosi dei melanomi coroideali.
L’ecografia A e B-scan non solo aiuta nella diagnosi, ma può anche fornire misurazioni più accurate del tumore. L’A-scan di solito rivela una bassa riflettività interna al tumore; l’oscillazione in altezza degli echi all’interno della lesione può corrispondere al polso del paziente, il che indica la presenza di vascolarizzazione intralesionale.1,5
Il B-scan mostra una massa solida con un aspetto anteriore acusticamente luminoso con oscurità interna e basale; la forma della sezione trasversale è tipicamente biconvessa, ma può apparire a fungo. Si possono vedere anche scavi coroideali e ombreggiature orbitali.1,5
L’angiografia con fluoresceina mostra tipicamente l’iperfluorescenza dei vasi del tumore e una diffusa colorazione tardiva.1 Tuttavia, il pattern della fluoresceina dipende dalle dimensioni del tumore, dalla forma, dalla pigmentazione, dall’integrità del RPE e dall’eventuale presenza di un corrispondente distacco sieroso della retina, tra le altre variabili.5 L’angiografia con fluoresceina non fornisce segni patognomonici del melanoma coroideale.3
In questo particolare paziente, il melanoma coroideale è stato diagnosticato sulla base dell’esame fundoscopico, degli ultrasuoni A- e B-scan e dell’angiografia con fluoresceina (senza biopsia).
La sola presentazione clinica di questo paziente era altamente suggestiva – in modo inequivocabile – di melanoma coroideale. Egli possedeva quattro dei cinque fattori di rischio sopra menzionati per la malignità: spessore > 2mm, liquido sottoretinico, sintomi/perdita visiva, e una posizione < 3mm dal disco ottico. Anche se le dimensioni della lesione melanotica basata sull’ecografia non sono disponibili, era chiaramente ispessita più di 2mm e aveva un diametro basale maggiore di 7mm (i limiti superiori ampiamente accettati dei nevi benigni).8,12
Inoltre, la massa mostrava caratteristiche palesemente invasive, come lo sconfinamento sul disco ottico.8,12
Gestione e prognosi
Quando viene trovata una massa oculare sospetta, è importante chiedere al paziente se ha subito un intervento chirurgico oculare o un trauma; una storia di cancro; o qualsiasi sintomo sistemico di cancro, come anoressia, perdita di peso, affaticamento generale, malessere o malattia. Mentre il 98% dei pazienti con melanomi coroideali non ha una malattia metastatica rilevabile al momento della diagnosi, le metastasi devono essere escluse.5 Questo sarebbe più appropriatamente gestito da un oncologo oculare, quindi un tale riferimento dovrebbe essere fatto.
I test includono un emocromo completo, enzimi epatici, TAC addominale, risonanza magnetica o ecografia, e una radiografia del torace.4,5 Diverse opzioni di trattamento sono disponibili per i melanomi coroideali, ma molte hanno rischi elevati; pertanto, il medico curante deve valutare attentamente molte variabili quando seleziona la modalità di trattamento appropriata per ogni particolare paziente. Alcuni fattori da considerare sono le dimensioni e la posizione del tumore, lo stato delle metastasi, lo stato visivo degli occhi colpiti e non colpiti, l’età del paziente e la sua salute generale.5 A seconda di questi fattori, l’osservazione può essere un piano di gestione valido se il paziente ha gravi problemi medici concomitanti, ma generalmente non è consigliata.
Trasformazione maligna
I fattori di rischio per la trasformazione maligna dei nevi coroideali includono:4
– Spessore > 2mm.
– Liquido sottoretinico.
– Presenza di sintomi.
– Pigmento arancione evidente sopra la lesione.
– Posizione < 3mm dal disco ottico.
*Se due o più fattori sono presenti, la lesione è probabilmente un melanoma coroideale.
Un trattamento molto aggressivo è l’enucleazione, ma comporta rischi significativi. La metà dei pazienti che sono trattati con l’enucleazione alla fine muoiono di melanoma metastatico. Questa opzione di trattamento invasivo è più spesso discussa se l’occhio colpito è cieco, doloroso, mostra un coinvolgimento del disco ottico, o se il tumore è molto grande.5
La maggior parte dei piccoli melanomi coroideali sono trattati con terapie distruttive locali, come la termoterapia, la radioterapia o l’irradiazione.12 Diversi tipi di radiazioni possono essere utilizzati come trattamento.4,5 Il più comune è la brachiterapia a placche, che utilizza una placca radioattiva che viene suturata sulla superficie del globo all’esterno del tumore.
Questo è più comunemente tentato con i tumori più piccoli che sono 3 diametri del disco o più lontano dal disco e dalla fovea. Circa il 10%-15% dei pazienti trattati in questo modo sperimentano una ricaduta locale del tumore dopo il trattamento. Dopo il trattamento, la vista del paziente di solito rimane la stessa di prima del trattamento, ma c’è la possibilità che possa migliorare. Tuttavia, la vista può essere successivamente ridotta a causa di effetti secondari, come retinopatia da radiazioni, papillopatia ottica, cataratta o glaucoma neovascolare.
La fotocoagulazione può essere tentata per piccoli tumori (< 3mm di spessore, < 7mm di diametro basale).4,5 Come la fotocoagulazione per qualsiasi altra ragione, nelle aree fotocoagulate si avrà uno scotoma permanente. Possono essere utilizzati anche altri trattamenti laser, tra cui la termoterapia transpupillare, che utilizza un laser a infrarossi a bassa potenza e lunga durata.5,12 Questa tecnica può essere utilizzata insieme alla radioterapia a placche, ma non ha dimostrato un miglioramento significativo nel controllo locale del tumore.13
Altri trattamenti meno comuni includono la resezione locale, la terapia fotodinamica o la crioterapia.4,5 Spesso, trattamenti multipli sono usati come parte di un approccio combinato.
Sfortunatamente, la prognosi per i pazienti con melanoma coroideale è spesso scarsa. Nonostante il trattamento, dal 30% al 50% dei pazienti alla fine sviluppano la malattia metastatica; questo si verifica preferibilmente al fegato, ma anche ai polmoni, alle ossa, alla pelle, ai linfonodi o al sistema nervoso centrale.3,11,14 La stessa percentuale di pazienti morirà entro 10 anni dalla diagnosi, di solito a causa della diffusione metastatica.3,11
Una volta metastatizzata, la fatalità è quasi certa.11 La più alta incidenza di metastasi è entro un anno dalla diagnosi di melanoma coroideale, anche se può non verificarsi fino ad anni dopo. Diversi fattori sono correlati ad un aumento del tasso di mortalità, tra cui le maggiori dimensioni del melanoma, la localizzazione anteriore, l’estensione extrasclerale, la crescita attraverso la membrana di Bruch, l’estensione del nervo ottico, la mancanza di pigmentazione e il tipo di cellule aggressive e/o l’attività mitotica.3
E’ evidente che questo paziente non ha ricevuto cure adeguate al suo primo appuntamento con la clinica optometrica; tuttavia, nonostante gli opportuni rinvii dopo il secondo appuntamento, le possibilità di un esito positivo si sono ridotte notevolmente.
Anche se un ritardo nell’invio di alcuni mesi potrebbe non aver alterato significativamente gli esiti in questo caso, questa situazione sottolinea l’importanza di un’anamnesi accurata e di un’efficace comunicazione medico-paziente. Sottolinea anche l’importanza di rinvii appropriati e di ulteriori esami, indipendentemente dalla natura “di lunga data” di una condizione.
Mentre la prognosi per i pazienti con melanoma coroideale può sembrare desolante, i professionisti della cura degli occhi devono istituire un trattamento appropriato non appena scoprono una tale lesione per migliorare le possibilità del paziente di avere esiti secondari positivi, compresa la conservazione della vista.
Il dottor Weidmayer esercita con un gruppo di optometristi presso Eye Center of Lenawee, P.C., ad Adrian e Brooklyn, Mich.
1. Spaide RF. Malattie della retina e del vitreo. 1a ed. Filadelfia: W.B. Saunders; 1999:262-65.
2. Margo CE. Lo studio collaborativo sul melanoma oculare: una panoramica. Cancer Control. 2004 Sep-Oct;11(5):304-9.
3. Garcia-Valenzuela E, Pons ME, Puklin JE, Davidson CA. Melanoma coroidale EMedicine Oftalmologia. Riferimento Medscape. 24 giugno 2009. http://emedicine.medscape.com/article/1190564-overview. Accesso 17 agosto 2010.
4. Nevo coroideale e melanoma maligno della coroide. In: Ehlers JP, Shah CP (eds). Il manuale dell’occhio di Wills: Office and Emergency Room Diagnosis and Treatment of Eye Disease. 5° ed. Philadelphia: Lippincott Williams & Wilkins; 2008:330-3.
5. Augsburger JJ, Damato BE, Bornfeld N. Uveal Melanoma. In: Yanoff M, Duker JS, eds. Ophthalmology. 1a ed. Londra: Mosby;1999:1052-63.
6. Jones WL. Oftalmoscopia. In: Terry JE (ed). Malattia oculare: Detection, Diagnosis, and Treatment. 1a ed. Boston: Butterworth Publishers; 1984:155-57.
7. Materin MA, Raducu R, Bianciotto C, Shields CL. Risultati dell’autofluorescenza del fondo e della tomografia a coerenza ottica nelle lesioni melanocitiche coroideali. Medio Oriente Afr J Ophthalmol. 2010 Jul;17(3): 201-6.
8. Augsburger JJ, Correa ZM, Trichopoulos N, Shaikh A. Sovrapposizione di dimensioni tra nevi coroideali melanocitici benigni e melanomi maligni coroideali. Invest Ophthalmol Vis Sci. 2008 Jul;49(7):2823-8.
9. Kaiserman I, Kaiserman N, Pe’er J. Follow up ultrasonico a lungo termine dei naevi coroideali e la loro trasformazione in melanomi. Br J Ophthalmol. 2006 Aug;90(8):994-8.
10. Mashayekhi A, Siu S, Shields CL, Shields JA. Allargamento lento dei nevi coroideali: uno studio di follow-up a lungo termine. Ophthalmology. 2011 Feb;118(2):382-8.
11. Onken MD, Worley LA, Tuscan MD, Harbour JW. Un accurato, clinicamente fattibile test di espressione multi-gene per prevedere le metastasi nel melanoma uveale. J Mol Diagn. 2010 luglio;12(4):461-8.
12. Augsburger JJ, Correa ZM, Schneider S, et al. Biopsia transvitreale diagnostica con ago sottile di piccoli tumori coroideali melanocitari nella categoria nevo contro melanoma. Trans Am Ophthalmol Soc. (2002);100:225-34.
13. Sagoo MS, Shields CL, Mashayekhi A, et al. Radioterapia a placche per il melanoma coroideale juxtapapillare: controllo del tumore in 650 casi consecutivi. Ophthalmology 2011 Feb;118(2):402-7.
14. Finger PT, Kurli M, Reddy S, et al. Whole body PET/CT for initial staging of choroidal melanoma. Br J Ophthalmol. 2005 Oct;89(10):1270-74.