Nel braccio mediato dalle cellule della risposta immunitaria adattativa, brevi peptidi sono legati da molecole del complesso maggiore di istocompatibilità (MHC) di classe I e classe II e presentati alla superficie cellulare dove vengono riconosciuti dai recettori antigenici dei linfociti T. Il legame di un recettore delle cellule T (TCR) che riconosce un particolare complesso MHC-peptide induce i linfociti naïve a differenziarsi in cellule effettrici (cellule T citotossiche e helper) che distruggono le cellule ospiti infette o stimolano la produzione di anticorpi, e in cellule di memoria che forniscono un’immunità protettiva contro la reinfezione.
Struttura e funzione delle molecole MHC
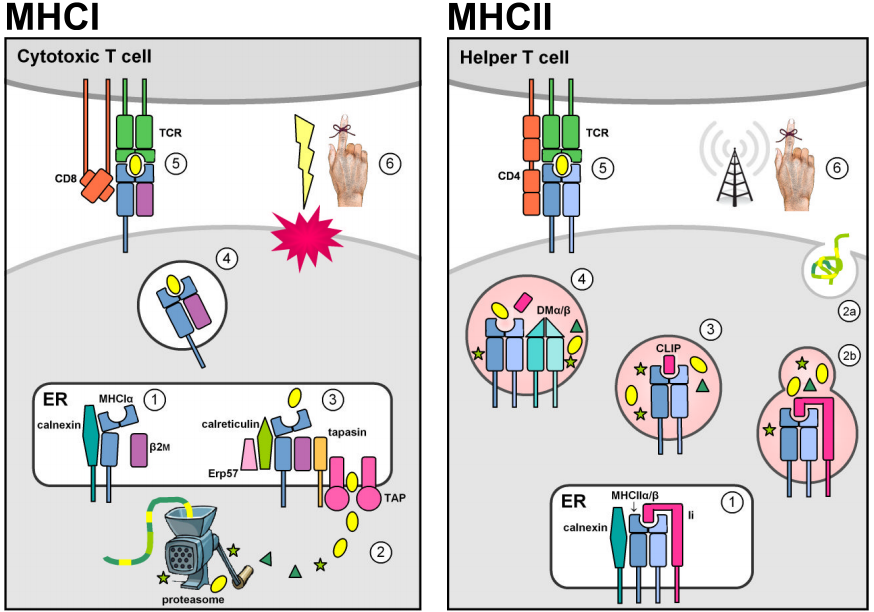
Due famiglie multigeniche situate all’interno della regione genomica MHC codificano molecole leganti l’antigene che presentano peptidi stranieri sulla superficie cellulare. In realtà, le molecole MHC presentano anche peptidi auto-derivati. Tuttavia, la selezione timica negativa contro le cellule T autoreattive impedisce che i complessi MHC-self-peptide suscitino una risposta immunitaria. Le molecole MHC di classe I sono espresse sulla maggior parte delle cellule nucleate e tipicamente presentano peptidi endogeni derivati da patogeni intracellulari che si replicano nel citosol (per esempio i virus). Le proteine citosoliche sono degradate in brevi frammenti peptidici dal proteasoma, e sono prima trasportate nel reticolo endoplasmatico (ER) dai trasportatori ATP-dipendenti TAP1 & 2 per il caricamento MHCI, e poi alla superficie cellulare per la presentazione alle cellule T citotossiche CD8+ circolanti la cui funzione è di indurre l’apoptosi e la lisi della cellula bersaglio infettata. (Le figure sono adattate da Murphy et al. (2008) Figg. 3.12, 3.25, 5.5, & 5.11.)
L’espressione costitutiva dei loci MHC di classe II è limitata alle cellule presentanti l’antigene del sistema immunitario (APC, ad esempio macrofagi, cellule dendritiche e linfociti B). Le molecole MHCII sono stabilizzate e non possono legare l’antigene mentre risiedono nell’ER attraverso l’associazione con la catena invariante di classe II (Ii, o CD74), e sono poi reindirizzate dalla via secretoria predefinita alla via endocitica. Lì, incontrano peptidi derivati da agenti patogeni che si replicano all’interno di vescicole intracellulari o da agenti patogeni extracellulari e proteine che vengono trasportate nella cellula. Il legame stabile del peptide è catalizzato dal dimero nonclassico MHCII DMα/β e permette ai complessi MHCII-peptide di sfuggire alla via endocitica per la presentazione alla superficie cellulare. Il riconoscimento da parte delle cellule T CD4+ attiva la cellula ospite bersaglio per stimolare meccanismi antibatterici (nei macrofagi) o per innescare la produzione di anticorpi e la risposta immunitaria umorale.
Le somiglianze strutturali delle molecole MHCI e MHCII riflettono probabilmente la loro discendenza da un antenato comune. Le molecole MHC mature sono glicoproteine integrali di membrana di tipo I composte da un solco di legame peptidico e domini simili alle immunoglobuline, transmembrana e citoplasma. Le porzioni extracellulari delle molecole MHC sono costituite da due domini distali di membrana che insieme formano una cavità legante i peptidi che è delimitata da due eliche α interrotte che poggiano su un foglio β antiparallelo, e due domini immunoglobulino-simili (Ig-like) prossimali di membrana che partecipano al legame dei corecettori CD4 e CD8.
Nonostante queste similitudini strutturali, le subunità proteiche sono codificate in modo diverso per le molecole di classe I e II. Le molecole MHCI sono eterodimeri formati dall’associazione non covalente tra una catena pesante MHCIα e la β2-microglobulina (β2m), che è codificata da un locus ampiamente invariante situato al di fuori della regione genomica MHC. La catena pesante contribuisce sia alla fessura di legame peptidico che a uno dei domini Ig-like, mentre la β2m fornisce solo una seconda regione Ig-like che manca di un’ancora transmembrana. Le molecole MHC di classe II sono eterodimeri formati dall’associazione non covalente di una catena α e una β, che contribuiscono entrambe a singoli domini Ig-like legati ai peptidi e ancorati alla membrana, e ciascuna delle quali è trascritta da un locus distinto che si trova tipicamente all’interno della regione MHC.
I membri della famiglia genica MHC possono essere ulteriormente suddivisi in loci classici o non classici, oltre agli pseudogeni non funzionali. I loci MHC Ia classici sono ampiamente espressi e sono tipicamente associati ad un’alta variabilità di sequenza e alla selezione positiva che agisce sulle sostituzioni nei residui della regione di legame peptidico (PBR). I loci MHC Ib non classici hanno invece un’espressione ridotta o una distribuzione tissutale limitata, un polimorfismo inferiore e possono avere funzioni limitate o modificate. Per i geni di classe II, “classico” si riferisce tipicamente a tutti i loci di presentazione dell’antigene, mentre il termine “non classico” è riservato a geni come DMα/β che svolgono ruoli accessori nella via di presentazione dell’antigene. Anche se questa categorizzazione funzionale dei membri della famiglia di geni fornisce un utile vocabolario di lavoro, il confine tra loci classici e non classici non è sempre chiaro in pratica e alcuni loci MHCI non classici sono polimorfici, ampiamente espressi, o legano ligandi peptidici nel modo tradizionale dei geni classici.
L’estremo polimorfismo a livello di popolazione e le prove di selezione equilibrante indicano che una sostanziale variazione allelica dei geni MHC è probabilmente necessaria per riconoscere e rispondere a un diverso assemblaggio di patogeni. Tuttavia, nonostante l’estesa duplicazione genica in alcune specie, gli individui esprimono tipicamente solo un numero moderato di loci MHC classici e la reversione all’eredità disomica si osserva anche in alcune specie poliploidi di Xenopus. I vincoli alla variazione intra-individuale MHC (almeno per i loci classici altamente espressi) si pensa riflettano un compromesso funzionale tra l’aumento del repertorio allelico per presentare una maggiore varietà di peptidi patogeni contro la riduzione accompagnata del repertorio delle cellule T che sarebbe necessario per mantenere l’auto-tolleranza. Le singole molecole MHC devono quindi essere in grado di legare peptidi permissivi per riconoscere adeguatamente una vasta gamma di antigeni stranieri. Tuttavia, c’è anche la necessità di generare complessi MHC-peptide stabili che persistono per una durata sufficiente a permettere il riconoscimento delle cellule T e che non scambiano peptidi sulla superficie cellulare, il che potrebbe portare alla distruzione delle cellule non infette. Tale stabilità è generalmente associata a interazioni intermolecolari ad alta affinità, e quindi restrittive.
Le molecole MHC conciliano questi requisiti di legame concorrenti attraverso un’elegante soluzione strutturale: i contatti tra i residui altamente conservati della regione di legame peptidico (PBR) della molecola MHC e gli atomi della catena principale del peptide stabilizzano il legame promiscuo della maggior parte dei ligandi peptidici, mentre i residui polimorfi che rivestono il solco di legame peptidico creano tasche irregolari con diversa stereochimica che ospitano i residui peptidici in modo dipendente dalla sequenza. Le restrizioni imposte dalle tasche di legame delle catene laterali variano sia tra gli alleli che tra le tasche all’interno di una singola molecola MHC. Le tasche che impongono requisiti di legame più rigorosi sono dette per ospitare residui peptidici di “ancoraggio primario”, mentre gli “ancoraggi secondari” sono più flessibili nelle loro preferenze di legame. Insieme, queste specificità determinano il motivo di legame peptidico di un particolare allele MHC per conferire selettività alla presentazione dell’antigene.