Nome generico: naftifina cloridrato
Forma farmaceutica: gel
Medicamente rivisto da Drugs.com. Ultimo aggiornamento: 1 aprile 2020.
- Panoramica
- Effetti collaterali
- Dosaggio
- Professionale
- Gravidanza
- Più
- Indicazioni e Uso per Naftin Gel
- Naftin Gel Dosaggio e Amministrazione
- Forme di dosaggio e forze
- Contraindicazioni
- Avvertenze e precauzioni
- Reazioni avverse locali
- Reazioni avverse
- Esperienza negli studi clinici
- Esperienza post-marketing
- USO IN POPOLAZIONI SPECIFICHE
- Gravidanza
- Allattamento
- Uso pediatrico
- Uso geriatrico
- Naftin Gel Descrizione
- Naftin Gel – Farmacologia Clinica
- Meccanismo d’azione
- Farmacodinamica
- Farmacocinetica
- Microbiologia
- Tossicologia non clinica
- Carcinogenesi, Mutagenesi, Danneggiamento della fertilità
- Studi clinici
- Come viene fornito/conservazione e manipolazione
- Informazioni per il paziente
- Pannello espositivo principale – Tubo 45g Cartone
- PRINCIPAL DISPLAY PANEL – 60 g Tube Carton
- Più informazioni su Naftin (naftifine topical)
- Risorse per i consumatori
- Risorse professionali
- Altre formulazioni
- Guide ai trattamenti correlati
Indicazioni e Uso per Naftin Gel
NAFTIN ® Gel è un antimicotico alllamina indicato per il trattamento della tinea pedis interdigitale causata dagli organismi Trichophyton rubrum, Trichophyton mentagrophytes e Epidermophyton floccosum.
Naftin Gel Dosaggio e Amministrazione
Applicare un sottile strato di NAFTIN ® Gel una volta al giorno alle aree interessate più un margine di circa ½ pollice di pelle sana circostante per 2 settimane.
Solo per uso topico. NAFTIN ® Gel non è per uso oftalmico, orale o intravaginale.
Forme di dosaggio e forze
Gel, 2%. Ogni grammo contiene 20 mg di cloridrato di naftifina in un gel da incolore a giallo.
Contraindicazioni
Nessuno.
Avvertenze e precauzioni
Reazioni avverse locali
Se si sviluppa irritazione o sensibilità con l’uso di NAFTIN ® Gel, il trattamento deve essere interrotto.
Reazioni avverse
Esperienza negli studi clinici
Perché gli studi clinici sono condotti in condizioni molto diverse, i tassi di reazione avversa osservati negli studi clinici di un farmaco non possono essere direttamente paragonati ai tassi negli studi clinici di un altro farmaco e possono non riflettere i tassi osservati nella pratica clinica.
In due studi randomizzati, controllati con veicolo, 1143 soggetti sono stati trattati con NAFTIN ® Gel contro 571 soggetti trattati con il veicolo. I soggetti dello studio avevano da 12 a 92 anni, erano principalmente maschi (76%), ed erano 59% caucasici, 38% neri o afroamericani, e 23% ispanici o latini. I soggetti hanno ricevuto dosi una volta al giorno, per via topica, per 2 settimane per coprire le aree cutanee interessate più un margine di mezzo pollice di pelle sana circostante. Le reazioni avverse più comuni sono state le reazioni al sito di applicazione che si sono verificate al tasso del 2% nel braccio Naftin Gel contro l’1% nel braccio del veicolo. La maggior parte delle reazioni avverse erano di lieve gravità.
In uno studio di farmacocinetica e sicurezza pediatrica in aperto 22 soggetti pediatrici 12-17 anni di età con tinea pedis interdigitale hanno ricevuto NAFTIN ® Gel. L’incidenza delle reazioni avverse nella popolazione pediatrica era simile a quella osservata nella popolazione adulta.
I test di irritazione cumulativa hanno rivelato il potenziale di NAFTIN ® Gel di causare irritazione. Non ci sono state prove che NAFTIN ® Gel causi sensibilizzazione da contatto, fototossicità o fotoallergenicità nella pelle sana.
Esperienza post-marketing
Perché queste reazioni sono riportate volontariamente da una popolazione di dimensioni incerte, non è sempre possibile stimare in modo affidabile la loro frequenza o stabilire una relazione causale all’esposizione al farmaco. Le seguenti reazioni avverse sono state identificate durante l’uso post-approvazione della naftifina cloridrato: vesciche, sensazione di bruciore, croste, secchezza, eritema/rossore, infiammazione, irritazione, macerazione, dolore, prurito, eruzione e gonfiore.
USO IN POPOLAZIONI SPECIFICHE
Gravidanza
Riassunto del rischio
Non ci sono dati disponibili sull’uso di NAFTIN® Gel in donne incinte per valutare un rischio associato al farmaco di gravi difetti alla nascita, aborto spontaneo o esiti materni o fetali avversi.
Negli studi sulla riproduzione animale, non sono stati osservati effetti avversi sullo sviluppo embriofetale a dosi orali somministrate durante il periodo di organogenesi fino a 37 volte la dose massima raccomandata per l’uomo (MRHD) nei ratti gravidi o a dosi sottocutanee somministrate durante il periodo di organogenesi fino a 4 volte la MRHD nei ratti gravidi o 7 volte la MRHD nei conigli gravidi (vedi Dati).
Tutte le gravidanze hanno un rischio di fondo di difetti di nascita, perdita o altri esiti avversi. Il rischio di fondo stimato di gravi difetti alla nascita e di aborto spontaneo per la popolazione indicata non è noto. Nella popolazione generale degli Stati Uniti, il rischio di fondo stimato di gravi difetti alla nascita e di aborto spontaneo in gravidanze clinicamente riconosciute va dal 2 al 4% e dal 15 al 20%, rispettivamente.
Dati
Dati sugli animali
Studi sullo sviluppo embriofetale sistemico sono stati condotti su ratti e conigli. Per il paragone delle dosi animali a quelle umane, l’MRHD è fissato a 4 g 2% di gel al giorno (1,33 mg/kg/giorno per un individuo di 60 kg).
Dosi orali di 30, 100 e 300 mg/kg/giorno di naftifina cloridrato sono state somministrate durante il periodo di organogenesi a ratti femmina gravidi. Nessun effetto legato al trattamento sulla tossicità embriofetale è stato notato a dosi fino a 300 mg/kg/giorno (37 volte l’MRHD basato sul confronto mg/m 2). Dosi sottocutanee di 10 e 30 mg/kg/giorno di naftifina cloridrato sono state somministrate durante il periodo dell’organogenesi a ratti femmine gravide. Nessun effetto legato al trattamento sulla tossicità embriofetale è stato notato a 30 mg/kg/giorno (4 volte l’MRHD basato sul confronto mg/m 2). Dosi sottocutanee di 3, 10 e 30 mg/kg/giorno di cloridrato di naftifina sono state somministrate durante il periodo dell’organogenesi a conigli femmine gravide. Nessun effetto legato al trattamento sulla tossicità embriofetale è stato notato a 30 mg/kg/giorno (7 volte l’MRHD basato sul confronto mg/m 2).
È stato condotto uno studio sullo sviluppo peri e post-natale nei ratti. Dosi orali di 30, 100 e 300 mg/kg/giorno di cloridrato di naftifina sono state somministrate a ratti femmina dal 14° giorno di gestazione al 21° giorno di allattamento. Un ridotto aumento del peso corporeo delle femmine durante la gestazione e della prole durante l’allattamento è stato notato a 300 mg/kg/giorno (37 volte l’MRHD basato sul confronto mg/m 2). Nessuna tossicità per lo sviluppo è stata notata a 100 mg/kg/giorno (12 volte l’MRHD basato sul confronto mg/m 2).
Allattamento
Riassunto del rischio
Non ci sono informazioni disponibili sulla presenza di naftifina cloridrato nel latte umano, sugli effetti del farmaco sul neonato allattato al seno, o sugli effetti del farmaco sulla produzione di latte dopo l’applicazione topica di Naftin Gel alle donne che allattano. Non è noto se la naftifina cloridrato sia escreta nel latte umano. Poiché molti farmaci sono escreti nel latte umano, cautela deve essere esercitata quando naftifina cloridrato viene somministrato a una donna che allatta.
La mancanza di dati clinici durante l’allattamento preclude una chiara determinazione del rischio Naftin Gel per un bambino durante l’allattamento. Pertanto, i benefici per lo sviluppo e la salute dell’allattamento al seno devono essere considerati insieme al bisogno clinico della madre per Naftin Gel e qualsiasi potenziale effetto avverso sul bambino allattato al seno da Naftin Gel o dalla condizione materna sottostante.
Uso pediatrico
La sicurezza e l’efficacia di NAFTIN® Gel sono state stabilite nel gruppo di età da 12 a 18 anni di età con tinea pedis interdigitale.
L’uso di NAFTIN® Gel in questo gruppo di età è supportato da prove da studi adeguati e ben controllati negli adulti con ulteriori dati di sicurezza e PK da uno studio in etichetta aperta, condotto in 22 adolescenti ≥12 anni di età che sono stati esposti a NAFTIN® Gel ad una dose di circa 4 g al giorno .
Sicurezza ed efficacia in pazienti pediatrici <12 anni di età non sono state stabilite.
Uso geriatrico
Durante gli studi clinici, 99 soggetti (9%) di età pari o superiore a 65 anni sono stati esposti a NAFTIN® Gel. La sicurezza e l’efficacia sono state simili a quelle riportate dai soggetti più giovani.
Naftin Gel Descrizione
NAFTIN ® Gel è un gel da chiaro a giallo solo per uso topico. Ogni grammo di NAFTIN ® Gel contiene 20 mg di naftifina cloridrato, un composto antifungino sintetico allilamino.
Chimicamente, la naftifina HCl è (E)-N-Cinnamyl-N-methyl-1-napthalenemethylamine cloridrato.
La formula molecolare è C 21H 21N∙HCl con un peso molecolare di 323,86.
La formula strutturale della naftifina cloridrato è :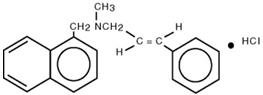
NAFTIN ® Gel contiene i seguenti ingredienti inattivi: alcol, alcol benzilico, edetato disodico, idrossietilcellulosa, acqua purificata, glicole propilenico, polisorbato 20 e trolamina.
Naftin Gel – Farmacologia Clinica
Meccanismo d’azione
NAFTIN ® Gel è un farmaco antifungino topico.
Farmacodinamica
La farmacodinamica di NAFTIN ® Gel non è stata stabilita.
Farmacocinetica
Studi di biodisponibilità in vitro e in vivo hanno dimostrato che la naftifina penetra nello strato corneo in concentrazione sufficiente per inibire la crescita dei dermatofiti.
L’analisi farmacocinetica di campioni di plasma di 32 soggetti con tinea pedis trattati con una dose media di 3,9 grammi di NAFTIN ® Gel applicato una volta al giorno su entrambi i piedi per 14 giorni ha mostrato un aumento dell’esposizione durante il periodo di trattamento, con una media geometrica (CV%) AUC 0-24 (area sotto la curva concentrazione plasma-versamento tempo dal tempo 0 alle 24 ore) di 10,5 (118) ng∙hr/mL il giorno 1 e una AUC 0-24 di 70 (59) ng∙hr/mL il giorno 14. Il rapporto di accumulo basato sull’AUC era approssimativamente 6.
Anche la concentrazione massima (C max) è aumentata durante il periodo di trattamento; la media geometrica (CV%) C max dopo una singola dose era 0,9 (92) ng/mL il giorno 1; C max il giorno 14 era 3,7 (64) ng/mL. Il T max mediano era di 20,0 ore (range: 8, 20 ore) dopo una singola applicazione il giorno 1 e di 8,0 ore (range: 0, 24 ore) il giorno 14. Le concentrazioni plasmatiche di base sono aumentate durante il periodo di prova e hanno raggiunto lo stato stazionario dopo 11 giorni. Nello stesso studio farmacocinetico la frazione di dose escreta nelle urine durante il periodo di trattamento è stata inferiore o uguale allo 0,01% della dose applicata.
In un secondo studio, la farmacocinetica di NAFTIN ® Gel è stata valutata in 22 soggetti pediatrici 12-17 anni di età con tinea pedis. I soggetti sono stati trattati con una dose media di 4,1 grammi di NAFTIN ® Gel applicato sulla zona interessata una volta al giorno per 14 giorni. I risultati hanno mostrato che l’esposizione sistemica è aumentata durante il periodo di trattamento. La media geometrica (CV%) AUC0-24 era 15,9 (212) ng∙hr/mL il giorno 1 e 60,0 (131) ng∙hr/mL il giorno 14. La media geometrica (CV%) Cmax dopo una singola dose era 1,40 (154) ng/mL il giorno 1 e 3,81 (154) ng/mL il giorno 14. La frazione di dose escreta nelle urine durante il periodo di trattamento è stata inferiore o uguale allo 0,003% della dose applicata.
Microbiologia
Meccanismo d’azione
Naftifina è un antifungino che appartiene alla classe delle allilamine. Anche se l’esatto meccanismo d’azione contro i funghi non è noto, la naftifina cloridrato sembra interferire con la biosintesi degli steroli inibendo l’enzima squalene 2, 3-epossidasi. L’inibizione dell’attività enzimatica da parte di questa allilamina si traduce in una diminuzione della quantità di steroli, specialmente ergosterolo, e un corrispondente accumulo di squalene nelle cellule.
Meccanismo di resistenza
Ad oggi, non è stato identificato un meccanismo di resistenza alla naftifina.
La naftifina ha dimostrato di essere attiva contro la maggior parte degli isolati dei seguenti funghi, sia in vitro che in infezioni cliniche, come descritto nella sezione INDICAZIONI E USO:
- Trichophyton rubrum
- Trichophyton mentagrophytes
- Epidermophyton floccosum
Tossicologia non clinica
Carcinogenesi, Mutagenesi, Danneggiamento della fertilità
In uno studio di carcinogenicità dermica di 2 anni, la naftifina cloridrato in crema è stata somministrata a ratti Sprague-Dawley a dosi topiche di 1%, 2% e 3% (10, 20 e 30 mg/kg/giorno di naftifina cloridrato). In questo studio non sono stati osservati tumori correlati al farmaco fino alla dose più alta valutata in questo studio di 30 mg/kg/giorno (36 volte l’MRHD basato sul confronto AUC).
Il cloridrato di naftifina non ha rivelato alcuna prova di potenziale mutageno o clastogenico in base ai risultati di due test di genotossicità in vitro (test di Ames e test di aberrazione cromosomica delle cellule dell’ovaio di criceto cinese) e un test di genotossicità in vivo (test del micronucleo del midollo osseo del topo).
La somministrazione orale di cloridrato di naftifina ai ratti, durante l’accoppiamento, la gestazione, il parto e l’allattamento, non ha dimostrato effetti su crescita, fertilità o riproduzione, a dosi fino a 100 mg/kg/giorno (12 volte l’MRHD basato sul confronto mg/m 2).
Studi clinici
NAFTIN ® Gel è stato valutato per l’efficacia in due studi randomizzati, in doppio cieco, controllati con veicolo, multicentrici che hanno incluso 1175 soggetti con tinea pedis interdigitale sintomatica e dermatofita coltura-positiva. I soggetti sono stati randomizzati a ricevere NAFTIN ® Gel o veicolo. I soggetti hanno applicato naftifina cloridrato gel 2% o veicolo sull’area interessata del piede una volta al giorno per 2 settimane. Segni e sintomi della tinea pedis interdigitale (presenza o assenza di eritema, prurito e desquamazione) sono stati valutati e l’esame dell’idrossido di potassio (KOH) e la coltura dei dermatofiti sono stati eseguiti 6 settimane dopo il primo trattamento.
L’età media della popolazione in studio era di 45 anni; il 77% era maschio; e il 60% era caucasico, il 35% era nero o afroamericano, e il 26% era ispanico o latino. Al basale, è stato confermato che i soggetti avevano segni e sintomi di tinea pedis interdigitale, un esame KOH positivo e una coltura di dermatofiti confermata. L’endpoint primario di efficacia era la proporzione di soggetti con una cura completa a 6 settimane dall’inizio del trattamento (4 settimane dopo l’ultimo trattamento). La cura completa è stata definita come una cura clinica (assenza di eritema, prurito e desquamazione) e micologica (KOH negativo e coltura di dermatofiti).
I risultati di efficacia alla settimana 6, quattro settimane dopo la fine del trattamento, sono presentati nella seguente tabella 1.
| Trial 1 | Trial 2 | |||
|---|---|---|---|---|
| Endpoint | NAFTIN ® Gel, 2% N=382 n (%) |
Veicolo N=179 n (%) |
NAFTIN ® Gel, 2% N=400 n (%) |
Veicolo N=213 n (%) |
| * La cura completa è un endpoint composito di cura micologica e clinica. La cura clinica è definita come l’assenza di eritema, prurito e desquamazione (grado 0). La cura efficace è una preparazione KOH negativa e una coltura di dermatofiti negativa, eritema, desquamazione e prurito di grado 0 o 1 (assente o quasi assente). La cura micologica è definita come KOH e coltura di dermatofiti negative. | ||||
| Cura completa * | 64 (17%) | 3 (2%) | 104 (26%) | 7 (3%) |
| Efficacia del trattamento † | 207 (54%) | 11 (6%) | 203 (51%) | 15 (7%) |
| Micologia Cure ‡ | 250 (65%) | 25 (14%) | 235 (59%) | 22 (10%) |
Come viene fornito/conservazione e manipolazione
Come viene fornito
NAFTIN ® Gel è un gel incolore o giallo fornito in tubi pieghevoli nelle seguenti dimensioni:
45g – NDC 54766-772-45
60g – NDC 54766-772-60
Conservazione
Conserva NAFTIN ® Gel a 25°C (77°F); escursioni consentite a 15-30°C (59-86°F).
Informazioni per il paziente
- Informare i pazienti che NAFTIN ® Gel è solo per uso topico. NAFTIN ® Gel non è destinato all’uso oftalmico, orale o intravaginale.
- I pazienti devono essere indirizzati a contattare il loro medico se l’irritazione si sviluppa con l’uso di NAFTIN ® Gel.
Distribuito da Sebela Pharmaceuticals Inc.
645 Hembree Parkway, Suite I, Roswell, GA 30076
www.sebelapharma.com
Toll Free 1-844-732-3521
©2020 Sebela Pharmaceuticals Inc. Tutti i diritti riservati.
Pannello espositivo principale – Tubo 45g Cartone

NDC 54766-772-45
NAFTIN ®
(Naftifine Hydrochloride) Gel, 2%
Sebela Pharmaceuticals Inc.
Solo per uso topico
Non per uso oftalmico, Oral or Intravaginal Use
45g
Rx Only
PRINCIPAL DISPLAY PANEL – 60 g Tube Carton

NDC 54766-772-60
NAFTIN®
(Naftifine Hydrochloride) Gel, 2%
Sebela Pharmaceuticals Inc.
Solo per uso topico
Non per uso oftalmico, Oral or Intravaginal Use
60g
Rx Only
| NAFTIN naftifine hydrochloride gel |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
Etichettatore – Sebela Pharmaceuticals Inc. (079104574)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| DPT Laboratories, Ltd. | 832224526 | produzione(54766-772), analisi(54766-772), etichetta(54766-772) | |
Più informazioni su Naftin (naftifine topical)
- Effetti collaterali
- In gravidanza o allattamento
- Dosaggio Informazioni
- Prezzi & Buoni sconto
- En Español
- 3 Recensioni
- Disponibilità generica
- Classe del farmaco: antimicotici topici
Risorse per i consumatori
- Informazioni per i pazienti
- Naftin Topical (lettura avanzata)
Risorse professionali
- Informazioni per la prescrizione
- Naftifina (monografia AHFS)
Altre formulazioni
- Naftin-MP Topical
Guide ai trattamenti correlati
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Discorso medico