Localizzato vs. delocalizzato
La distinzione tra “localizzato” e “delocalizzato” esiste solo quando descriviamo il movimento degli elettroni usando la teoria del legame di Lewis.
Secondo questa teoria, gli elettroni localizzati hanno un comportamento normale. Una coppia solitaria localizzata rimane vicino ad un atomo. Una coppia di legame localizzata viaggia tra due atomi.
Gli ibridi di risonanza contengono necessariamente alcuni elettroni “anormali”. Una coppia solitaria può sembrare avere alcune caratteristiche di legame; invece di stare vicino ad un atomo, visita due atomi. Una coppia di legame può sembrare muoversi tra due diverse coppie di atomi. Questi elettroni escono dai confini che la teoria di Lewis ha stabilito per loro, e noi li consideriamo delocalizzati.
Il modo più semplice per individuare gli elettroni delocalizzati è confrontare le posizioni degli elettroni in due forme di risonanza. Se una coppia appare in un posto in una forma e in un posto diverso in un’altra forma, la coppia è delocalizzata.
Puoi vedere il comportamento delocalizzato nelle forme di risonanza I e II qui sotto. Entrambe le forme contengono due coppie di elettroni delocalizzati. Puoi trovarle? Che tipo di coppie di elettroni sono delocalizzate in ogni struttura?
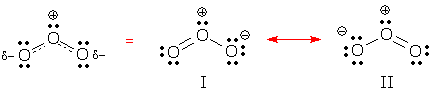
(Risposta: queste forme contengono una coppia di legami delocalizzata e una coppia solitaria delocalizzata.)
Legami delocalizzati e cariche delocalizzate
L’etichetta “delocalizzato” si applica anche a legami e cariche.
Un legame delocalizzato è un legame che appare in alcune forme di risonanza, ma non in altre. La forma di risonanza I contiene 2 legami localizzati e 1 legame delocalizzato.
Una carica delocalizzata è una carica formale che appare su un atomo in alcune forme di risonanza e su altri atomi in altre forme. La carica negativa dell’ozono è delocalizzata sulle due estremità O, mentre la carica positiva è localizzata sull’O centrale.