Estabilidade dos intermediários de carbocalização
Sabemos que o passo limitador de taxa de uma reação SN1 é o primeiro passo – a formação deste intermediário de carbocalização. A taxa deste passo – e portanto, a taxa da reação de substituição global – depende da energia de ativação para o processo no qual a ligação entre o carbono e o grupo de saída se rompe e se forma uma carbonização. De acordo com o postulado de Hammond (seção 6.2B), quanto mais estável for o intermediário de carbonização, mais rápido essa primeira etapa de quebra da ligação ocorrerá. Em outras palavras, a probabilidade de uma reação de substituição nucleófila proceder por um mecanismo dissociativo (SN1) depende em grande medida da estabilidade do intermediário de carbonização que se forma.
A questão crítica agora se torna, o que estabiliza uma carbocalização?
Então, se é necessário um grupo de retirada de electrões para estabilizar uma carga negativa, o que estabilizará uma carga positiva? Um grupo doador de elétrons!
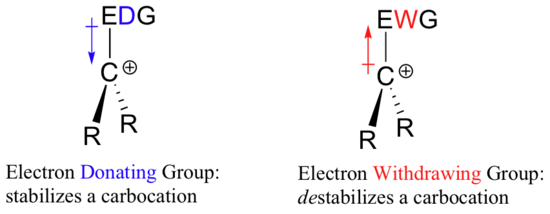
Uma espécie com carga positiva, como uma carbonização, é muito pobre em elétrons, e assim qualquer coisa que doe densidade de elétrons ao centro da pobreza de elétrons ajudará a estabilizá-la. Inversamente, uma carbonocação será desestabilizada por um grupo que retira elétrons.
Grupos alquílicos – metil, etílico e similares – são grupos fracos doadores de elétrons, e assim estabilizam as carbonocações próximas. Isto significa que, em geral, as carbonocações mais substituídas são mais estáveis: uma carbonocalização terc-butil, por exemplo, é mais estável do que uma carbonocalização isopropil. As carbonocações primárias são altamente instáveis e não são frequentemente observadas como intermediários de reacção; as carbonocações de metilo são ainda menos estáveis.
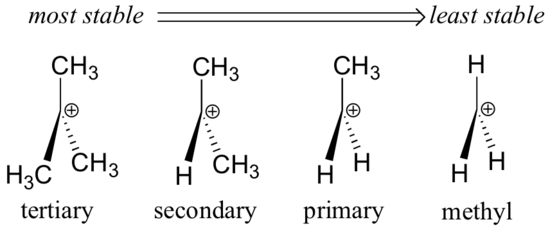
Os grupos alquil são doadores de electrões e estabilizadores de carbonocações porque os electrões em redor dos carbonos vizinhos são atraídos para a carga positiva próxima, reduzindo assim ligeiramente a pobreza de electrões do carbono com carga positiva.
Não é preciso dizer, no entanto, que as carbonocações com maior substituição são sempre mais estáveis do que aquelas com menor substituição. Tal como os grupos com dons de electrões podem estabilizar uma carbonização, os grupos com retracção de electrões actuam para desestabilizar as carbonocações. Os grupos carbonilo são grupos de retracção dos electrões por efeitos indutivos, devido à polaridade da dupla ligação C=O. É possível demonstrar em laboratório (ver secção 16.1D) que a carbonização A abaixo é mais estável que a carbonização B, apesar de A ser uma carbonização primária e B ser secundária.
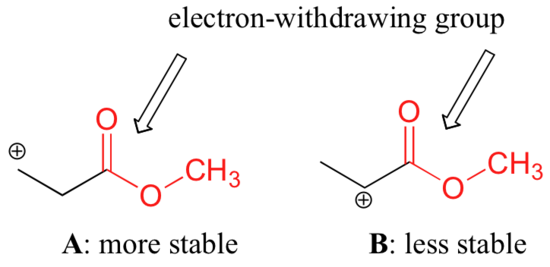
A diferença na estabilidade pode ser explicada considerando o efeito indutivo de retirada de elétrons do éster carbonilo. Recorde-se que os efeitos indutivos – quer se retirem ou doem elétrons – são retransmitidos através de ligações covalentes e que a força do efeito diminui rapidamente à medida que o número de ligações intermediárias aumenta. Em outras palavras, o efeito diminui com a distância. Na espécie B a carga positiva está mais próxima do grupo carbonilo, portanto o efeito desestabilizador de extracção de electrões é mais forte do que na espécie A.
No próximo capítulo veremos como o efeito desestabilizador de carbonilo dos substitutos de flúor de extracção de electrões pode ser utilizado em experiências concebidas para abordar a questão de saber se uma reacção de substituição bioquímica nucleófila é SN1 ou SN2.
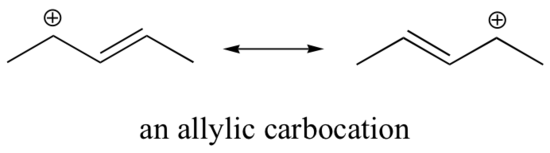
Estabilização de uma carbocalização também pode ocorrer através de efeitos de ressonância, e como já discutimos no capítulo ácido-base, os efeitos de ressonância como regra são mais poderosos do que os efeitos indutivos. Considere o caso simples de uma carbocação benzílica:
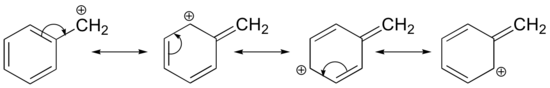
Esta carbocação é comparativamente estável. Neste caso, a doação de elétrons é um efeito de ressonância. Três estruturas de ressonância adicionais podem ser desenhadas para esta carbocação na qual a carga positiva está localizada em um dos três carbonos aromáticos. A carga positiva não é isolada sobre o carbono benzílico, mas sim deslocada em torno da estrutura aromática: esta deslocalização da carga resulta numa estabilização significativa. Como resultado, as carbonações benzílicas e alílicas (onde o carbono com carga positiva é conjugado a uma ou mais ligações duplas não aromáticas) são significativamente mais estáveis que as carbonações alquílicas terciárias.
Porque os heteroátomos como o oxigénio e o azoto são mais electronegativos que o carbono, é de esperar que por definição sejam grupos de retirada de electrões que desestabilizam as carbonações. Na verdade, o contrário é muitas vezes verdade: se o átomo de oxigénio ou nitrogénio estiver na posição correcta, o efeito global é a estabilização das carbonocações. Isto deve-se ao facto de que embora estes heteroátomos sejam grupos de retirada de electrões por indução, são grupos doadores de electrões por ressonância, e é este efeito de ressonância que é mais poderoso. (Encontramos anteriormente esta mesma ideia quando consideramos a acidez relativa e basicidade dos fenóis e aminas aromáticas na secção 7.4). Considere os dois pares de espécies de carbocações abaixo:
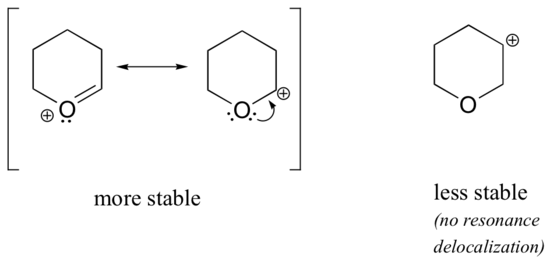
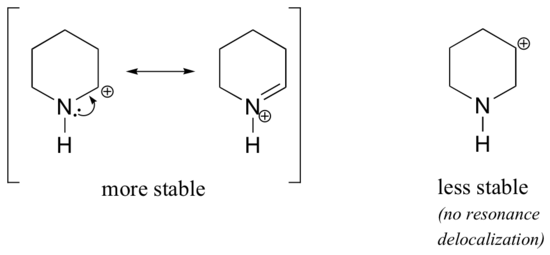
> Nas carbocações mais estáveis, a heteroatom actua como um grupo doador de electrões por ressonância: com efeito, o par único na heteroatom está disponível para delocalizar a carga positiva. Nas carbocações menos estáveis, o carbono com carga positiva está a mais de uma ligação da heteroatom e, portanto, não são possíveis efeitos de ressonância. De facto, nestas espécies de carbocações, os heteroátomos desestabilizam a carga positiva, porque são electrões que se retiram por indução.
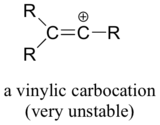
Finalmente, as carbonocações vinílicas, nas quais a carga positiva reside num carbono de dupla ligação, são muito instáveis e, portanto, improváveis de se formarem como intermediárias em qualquer reacção.
Exemplo 7.9.1
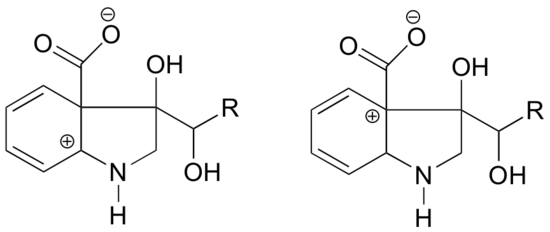
Em qual das estruturas abaixo se espera que a carbonocalização seja mais estável? Explique.
Resposta
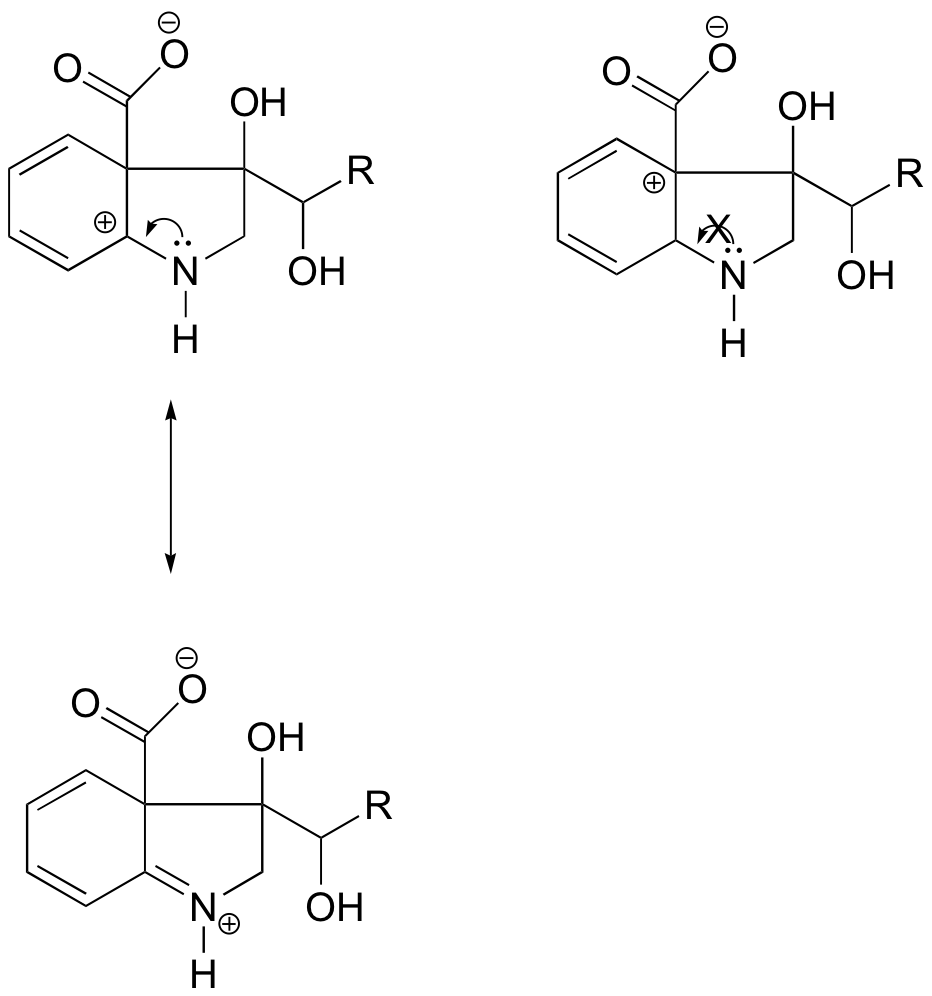
Na carbonocação à esquerda, a carga positiva está localizada em uma posição relativa ao nitrogênio de tal forma que o par único de elétrons sobre o nitrogênio pode ser doado para preencher o orbital vazio. Isto não é possível para as espécies de carbonocalização à direita.
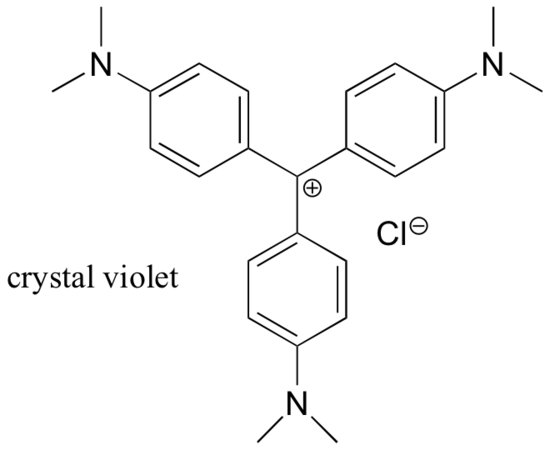
Na sua maioria, as carbonocações são espécies intermediárias de muito alta energia e transitórias nas reacções orgânicas. No entanto, existem alguns exemplos incomuns de carbonocações muito estáveis que tomam a forma de sais orgânicos. Violeta cristal é o nome comum para o sal cloreto da carbonização, cuja estrutura é mostrada abaixo. Observe as possibilidades estruturais de delocalização por ressonância extensa da carga positiva, e a presença de três grupos de aminas doadoras de elétrons.
Exemplo 7.9.2
Traçar uma estrutura de ressonância do cátion violeta cristal na qual a carga positiva é delocalizada para um dos átomos de nitrogênio.
Resposta 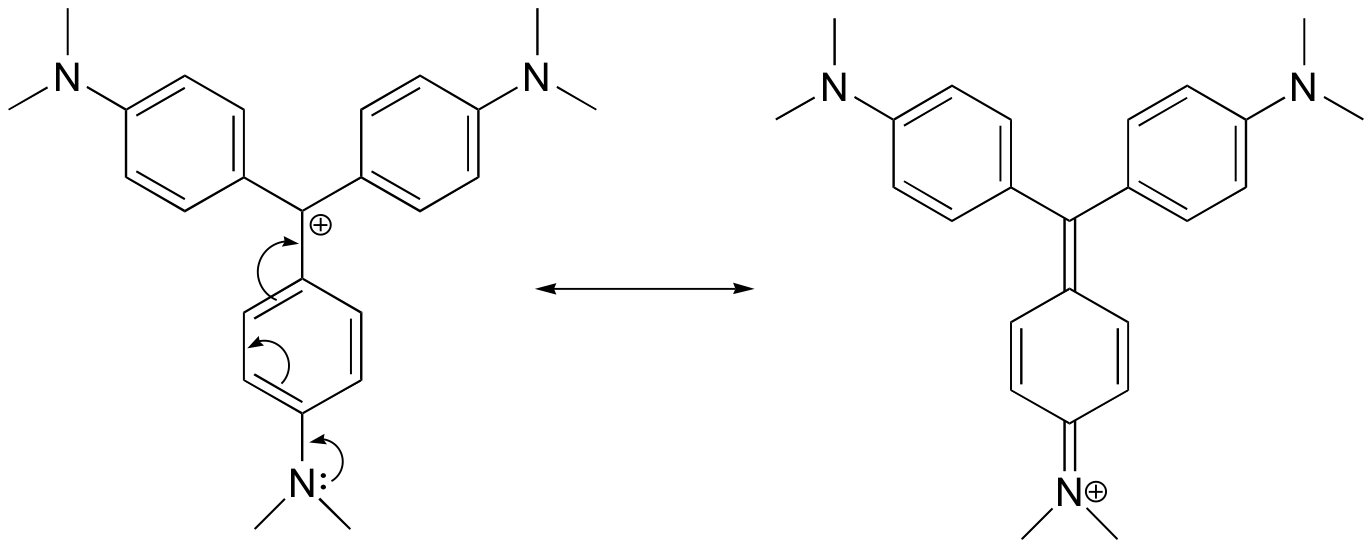
Ao considerar a possibilidade de que uma reação de substituição nucleófila prossiga por uma via SN1, é crítico avaliar a estabilidade do hipotético intermediário de carbocalização. Se este intermediário não for suficientemente estável, um mecanismo SN1 deve ser considerado improvável, e a reação provavelmente prossegue por um mecanismo SN2. No próximo capítulo veremos vários exemplos de reações de importância biológica SN1 nas quais o intermediário com carga positiva é estabilizado por efeitos indutivos e de ressonância inerentes à sua própria estrutura molecular.
Exemplo 7.9.3
Estado em que a carbonocação em cada par abaixo é mais estável, ou se se espera que sejam aproximadamente iguais. Explique o seu raciocínio.
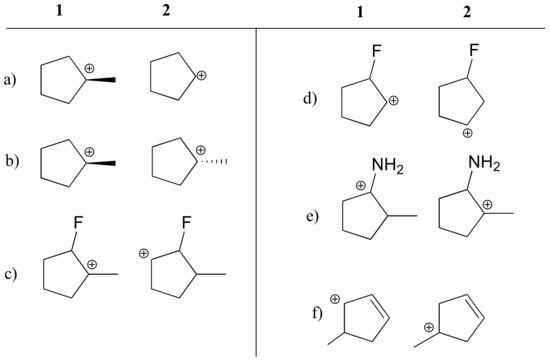
Resposta
a) 1 (terciário vs. carbonização secundária)
b) igual
c) 1 (terciário vs. carbonização secundária)1 (terciário vs. carbonização secundária)
b) igual
c) 1 (terciário vs. carbonização secundária)1 carbonocalização secundária)
d) 2 (carga positiva é mais longe do que o flúor de extração de elétrons)
e) 1 (par solitário sobre nitrogênio pode doar elétrons por ressonância)
f) 1 (carbonocalização alélica – carga positiva pode ser deslocada para um segundo carbono)