A hidrogenação de alcenos a alcanos é exotérmica. A quantidade de energia libertada durante uma reacção de hidrogenação, conhecida como calor da hidrogenação, está inversamente relacionada com a estabilidade do alceno inicial: quanto mais estável o alceno, menor é o seu calor de hidrogenação. O exame dos aquecedores da hidrogenação de vários alcenos revela que a estabilidade aumenta com a quantidade de substituição.
| Nome Completo | Estrutura | Calor solar de Hidrogenação | grau de Substituição | |
|---|---|---|---|---|
| em kJ/mol | em kcal/mol | |||
| Etileno | H 2 C = CH 2 {\\i1}ce {H2C=CH2}}}
 |
137 | 32,8 | Unsubstituted |
| 1-Buteno |
|
127 | 30.3 | Monosubstituted |
| trans-2-Butene |
|
116 | 27.6 | Disubstituído |
| 2-Metil-2-buteno |
 |
113 | 26.9 | Trisubstituted |
| 2,3-Dimetil-2-buteno |
 |
111 | 26.6 | Tetrasubstituted |
O aumento da estabilidade associado a substituições adicionais é o resultado de vários factores. Os grupos alquílicos são doadores de elétrons por efeito indutivo, e aumentam a densidade de elétrons sobre a ligação sigma do alqueno. Além disso, os grupos alquílicos são estericamente grandes, e são mais estáveis quando estão longe uns dos outros. Em um alcano, a separação máxima é a do ângulo de ligação tetraédrico, 109,5°. Em um alqueno, o ângulo de ligação aumenta para perto de 120°. Como resultado, a separação entre os grupos alquílicos é maior nos alcenos mais substituídos.
Hyperconjugation, que descreve a interação estabilizadora entre o HOMO do grupo alquílico e o LUMO da dupla ligação, também ajuda a explicar a influência das substituições alquílicas na estabilidade dos alcenos. Em relação à hibridação orbital, uma ligação entre um carbono sp2 e um carbono sp3 é mais forte do que uma ligação entre dois carbonos hibridizados sp3. Os cálculos revelam um efeito hiperconjugador estabilizador dominante de 6 kcal/mol por grupo alquilo.
Efeitos estéreisEditar
Em reações de eliminação de E2, uma base abstrai um próton que é beta para um grupo de saída, tal como um halogeneto. A remoção do próton e a perda do grupo de saída ocorrem em uma única etapa concertada para formar uma nova dupla ligação. Quando uma base pequena e sem obstáculos – como o hidróxido de sódio, metóxido de sódio ou etóxido de sódio – é usada para a eliminação do E2, o produto Zaitsev é normalmente favorecido em relação ao alqueno menos substituído, conhecido como o Produto Hofmann. Por exemplo, tratar 2-bromo-2-metilbutano com etóxido de sódio em etanol produz o produto Zaitsev com seletividade moderada.

Due to steric interactions, uma base volumosa – como o t-buóxido de potássio, trietilamina, ou 2,6-lutidina – não pode prontamente abstrair o próton que levaria ao produto Zaitsev. Nessas situações, um próton menos estéril é preferencialmente abstraído. Como resultado, o Produto Hofmann é tipicamente favorecido quando se utiliza bases volumosas. Quando o 2-bromo-2-metilbutano é tratado com buóxido de potássio em vez de etóxido de sódio, o produto Hofmann é favorecido.

Interações estéricas dentro do substrato também previnem a formação do produto Zaitsev. Estas interações intramoleculares são relevantes para a distribuição de produtos na reação de eliminação de Hofmann, que converte aminas em alcenos. Na eliminação de Hofmann, o tratamento de um sal de iodeto de amónio quaternário com óxido de prata produz ião hidróxido, que actua como base e elimina a amina terciária para dar um alqueno.
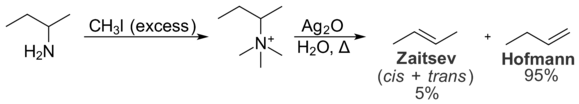
Na eliminação de Hofmann, o alqueno menos substituído é tipicamente favorecido devido às interacções intramoleculares estéreis. O grupo quaternário do amónio é grande, e as interacções com grupos alquilo no resto da molécula são indesejáveis. Como resultado, a conformação necessária para a formação do produto Zaitsev é menos favorável energeticamente do que a conformação necessária para a formação do produto Hofmann. Como resultado, o produto Hofmann é formado preferencialmente. A eliminação de Cope é muito semelhante à eliminação de Hofmann em princípio, mas ocorre em condições mais suaves. Também favorece a formação do produto Hofmann, e pelas mesmas razões.
StereochemistryEdit
Em alguns casos, a estereoquímica da matéria prima pode impedir a formação do produto Zaitsev. Por exemplo, quando o cloreto de mentol é tratado com etóxido de sódio, o produto Hofmann é formado exclusivamente: mas em muito baixo rendimento:

Este resultado é devido à estereoquímica da matéria de base. As eliminações E2 requerem uma geometria anti-periplanar, na qual o próton e o grupo de saída se encontram em lados opostos da ligação C-C, mas no mesmo plano. Quando o cloreto de mentol é desenhado na conformação da cadeira, é fácil explicar a distribuição incomum do produto.

Formação do produto Zaitsev requer eliminação na posição 2, mas o grupo isopropílico – não o próton – é anti-periplanar para o grupo de saída do cloreto; isto torna a eliminação na posição 2 impossível. Para que o produto Hofmann se forme, a eliminação deve ocorrer na posição 6. Como o próton nessa posição tem a orientação correta em relação ao grupo de saída, a eliminação pode ocorrer e ocorre. Como resultado, esta reação específica produz apenas o produto Hofmann.