Azide Ion: Estrutura, propriedades e reações de substituição
O íon azida (N3- ) é uma daquelas entidades químicas que simplesmente parecem estranhas.

- Três nitrogênios em fila? cheque
- Duas cargas negativas e uma carga positiva, para uma carga líquida de -1 ? cheque
- Verificação estável? cheque (desde que seja tratada suavemente).
Como se vê, o íon azida pode ser extremamente útil para formar ligações C-N em reacções de substituição nucleófila.
Tabela de conteúdos
- O íon azida é um grande nucleófilo
- As azidas orgânicas como aminas “mascaradas”
- Explosão na plataforma de lançamento
- Substituição de acilo nucléofilo por sais de azida: Acyl Azides
- Rearranjo de Acyl Azides: A Reordenação de Curtius
- Mais Exemplos de Nucleófilos Azídicos: Abertura Epoxídica e Adição Conjugada
- Notas
- (Avançado) Referências e Leitura Adicional
- 1. O Íon Azida é um Grande Nucleófilo em Reações SN2
- 2. As azidas orgânicas como “aminas mascaradas”
- Explosão no Launchpad
- 4. Substituição Nucleófila de Acyl por Sais de Azida Faz Acyl Azides
- 5. Rearranjo da azida acilo: O rearranjo de Curtius
- Mais Exemplos de Nucleófilos Azide: Adição de epóxidos e conjugados
- Notas
- Referências (Avançadas) e Leitura Adicional
1. O Íon Azida é um Grande Nucleófilo em Reações SN2
O íon azida é a base conjugada do ácido hidrazóico, HN3. Apesar de ser apenas fracamente básico (a pKa do HN3 é apenas 4,6) N3 é um nucleófilo extremamente bom – de acordo com uma medida, mais nucleofílico que qualquer amina (ver post: Nucleophilicity of amines). Não é difícil racionalizar por que isso pode ser quando você pára para pensar sobre isso. Com quatro pares solitários nucleofílicos confinados a um volume muito pequeno, a probabilidade de colisão com um eletrofilo que resulta em uma reação é muito maior do que seria para uma amina com grupos alquílicos volumosos, para tomar apenas um exemplo.
Você pode pensar em N3- como um míssil magro, médio, com ponta de nitrogênio que entrega sua carga útil sobre o carbono de forma rápida, eficiente e sem reações laterais significativas.
Nas reacções SN2, os halogenetos alquílicos primários e secundários e sulfonatos são prontamente deslocados por N3- , resultando em azidas alquílicas:
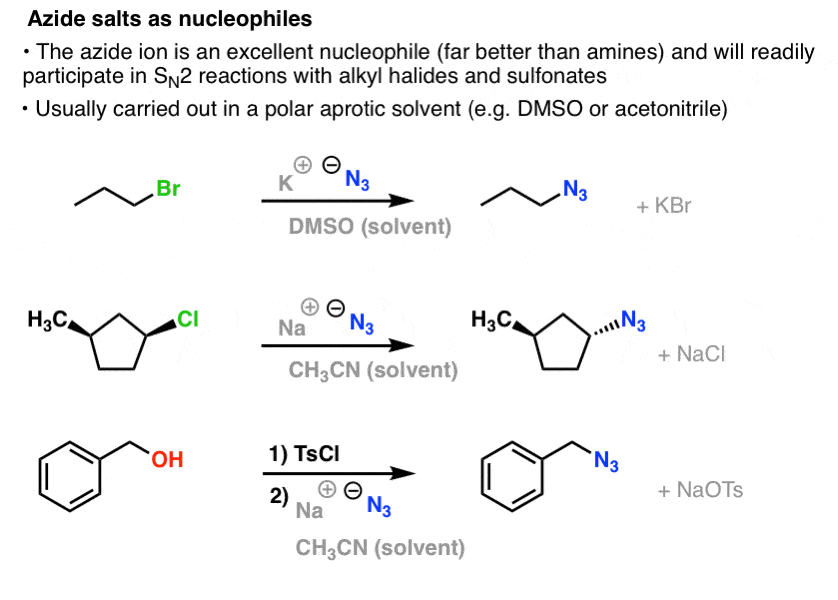
O procedimento habitual é usar um sal azida como NaN3 ou KN3 com o halogeneto de alquilo apropriado num solvente polar aprox. como acetonitrilo (CH3CN) ou dimetilsulfóxido (DMSO).
Os produtos de azida orgânica são razoavelmente estáveis, mesmo que pareçam um pouco estranhos. Alguns até já encontraram uso como produtos farmacêuticos (por exemplo, AZT, abaixo à direita) ou como sondas úteis para o estudo da biologia química. .
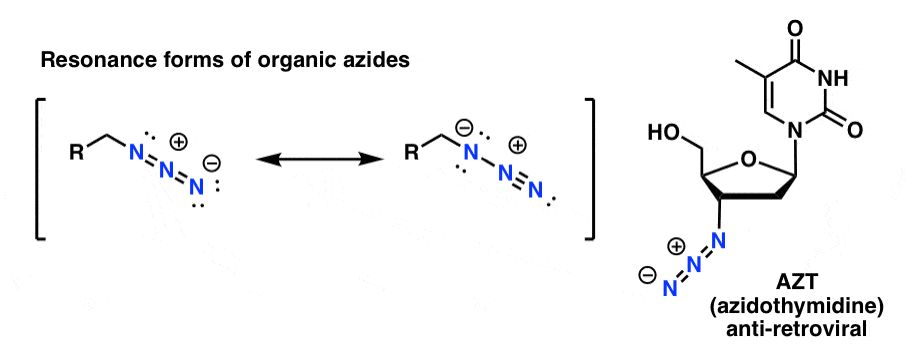
Para os nossos propósitos a propriedade mais útil das azidas orgânicas é que servem como aminas “mascaradas”.
2. As azidas orgânicas como “aminas mascaradas”
Note a forma de ressonância acima com uma ligação tripla nitrogênio-nitrogênio. Se tratadas com um agente redutor, como LiAlH4 ou mesmo hidrogenação catalítica (Pd/C , H2) as azidas orgânicas podem ser reduzidas a aminas primárias, libertando N2 no processo.
Isto faz uma rota muito útil para as aminas primárias de halogenetos alquílicos!
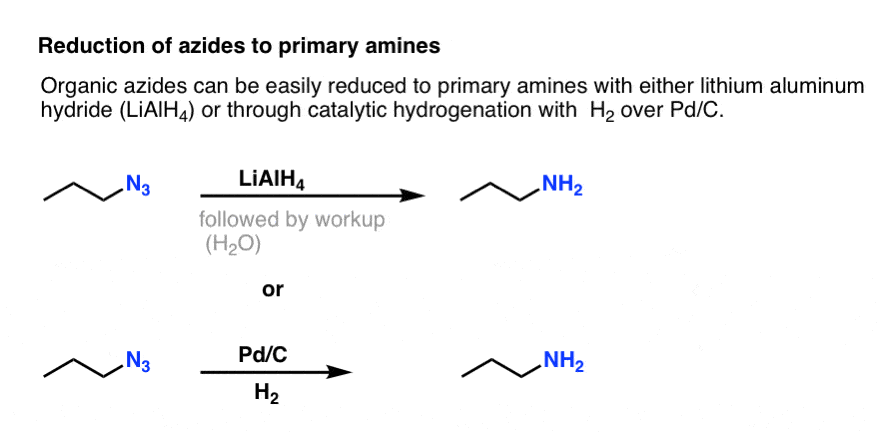
Já exploramos anteriormente a síntese de Gabriel como uma rota para aminas primárias , mas esta rota é superior porque a azida pode ser reduzida à amina em condições suaves (por exemplo, hidrogenação). Nada daquela clivagem de alta temperatura do ftalimida com hidrazina a preocupar.
Vimos também que fazer aminas primárias através de tratamento direto de halogenetos alquílicos com NH3 muitas vezes não resulta no produto desejado, porque as aminas têm uma tendência tipo Cookie-Monster de reagir várias vezes com os halogenetos alquílicos: como os produtos de amina tendem a ser mais nucleofílicos que os reagentes, é difícil conseguir que as aminas parem de mastigar apenas um halogenetos alquílicos.
Explosão no Launchpad
Se o N3 é um “míssil com pontas de nitrogênio”, como comentamos acima, vale a pena lembrar o que acontece quando um míssil não é manuseado com cuidado: é essencialmente uma bomba.
NaN3 e KN3 são pós brancos que podem ser armazenados indefinidamente à temperatura ambiente e retirados da bancada sem qualquer problema.
Mas quando aquecido ou sujeito a choque – todas as apostas estão canceladas. O mesmo se aplica à exposição destes sais de azida ao ácido, que forma HN3.
E NaN3 e KN3 são as boas azidas! Se misturadas com sais metálicos de chumbo, mercúrio, cádmio, zinco ou prata, podem resultar ainda mais compostos explosivos de azida. Estas azidas metálicas são explosivos de contacto, alguns dos quais são tão sensíveis que irão detonar se alguém se peidar a vinte metros de profundidade. Alguns químicos malucos até fazem essas coisas de propósito, mas não vamos viajar para nenhum lugar perto do raio de explosão desse tópico neste blog a qualquer momento, nunca.
NaN3 e KN3 devem ser usados em concentrações razoavelmente diluídas, atrás de um escudo antiexplosivo em escala preparatória, e incidentalmente nunca usados com solvente CH2Cl2, que pode resultar em diazidometano altamente explosivo.
Agora, há momentos em que uma explosão repentina de gás nitrogênio é útil – e potencialmente salva vidas. Você pode já ter passado uma parte do seu dia nas proximidades da azida sódica sem sequer se aperceber. Isso porque o NaN3 é um dos vários propulsores que encontra uso em airbags; uma vez acionado por um acelerômetro, a detonação do NaN3 expulsa o gás N2 a mais de 200 mph, inflando o saco em 1/25 de segundo.
Yay para sais de azida!
via GIPHY
(Mas não seja este tipo):
via GIPHY
Bottom line: As reacções SN2 entre halogenetos alquílicos ou sulfonatos com azidas são provavelmente a melhor forma de sintetizar aminas primárias de halogenetos alquílicos. É certamente melhor que a síntese de Gabriel.
4. Substituição Nucleófila de Acyl por Sais de Azida Faz Acyl Azides
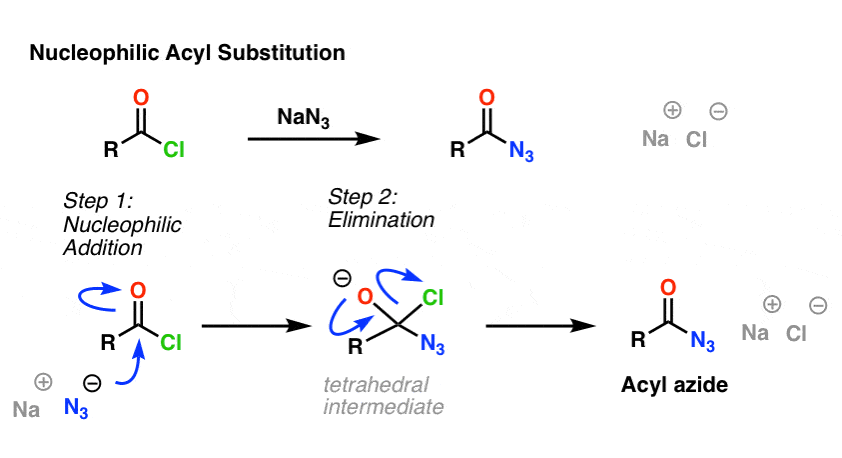
A reação SN2 não é o único tipo de reação de substituição que nós exploramos. Há também a substituição do acilo nucleófilo. Um carbonilo ligado a um bom grupo de saída (como um cloreto ácido ou anidrido) sofrerá substituição quando um nucleófilo apropriado for adicionado.
No primeiro passo do mecanismo, o nucleófilo (Nu) ataca o carbono carbonilo, formando C-Nu e quebrando C-O (pi). Isto dá origem a um intermediário tetraédrico. No segundo passo, a ligação C-O pi é re-formada, e a ligação de carbono (grupo de saída) é quebrada, resultando no produto de substituição de acilo nucleofílico.
Aqui está um exemplo de uma reação de substituição de acilo nucleofílico entre um cloreto ácido e o íon N3 para dar uma azida acilo:
5. Rearranjo da azida acilo: O rearranjo de Curtius
O uso mais comum das azidas acilídeas é que ao aquecerem, reordenam para dar isocianatos numa reacção conhecida como rearranjo de Curtius.
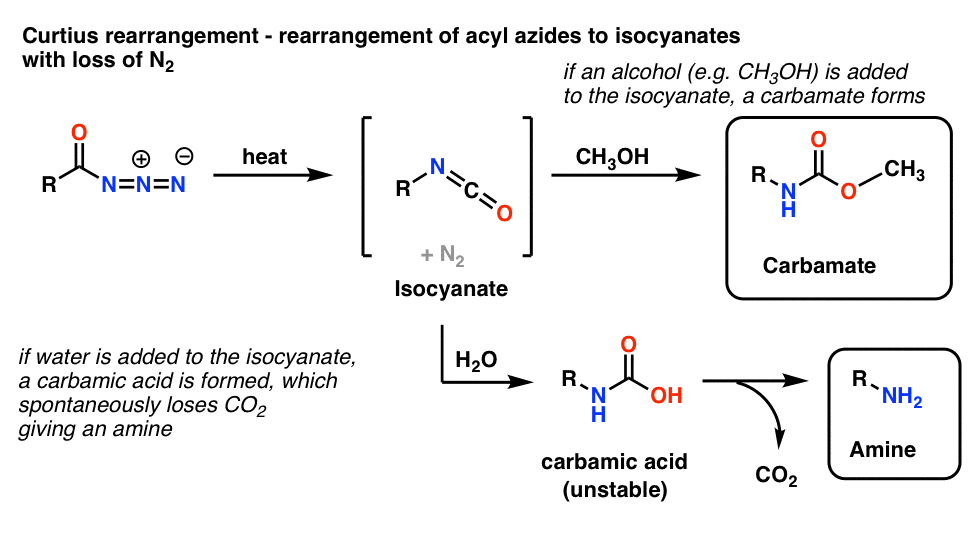
- Se o Curtius for realizado na presença de um álcool como o metanol, forma-se um carbamato.
- Se, em vez disso, for adicionada água, forma-se brevemente um ácido carbâmico instável, que depois perde dióxido de carbono para dar uma amina primária.
Por que é que isto pode ser útil? Aqui está uma maneira.
Existem muitos métodos para fazer ácidos carboxílicos aromáticos, mas não há muitas boas maneiras de formar ligações C-N em anéis aromáticos. Digamos que você tem um ácido benzóico (como o ácido p-metilbenzóico), mas precisa formar uma amina aromática (protegida). O protocolo Curtius representa uma boa maneira de formar uma nova ligação C-N no anel sem ter que recorrer à nitração + redução.
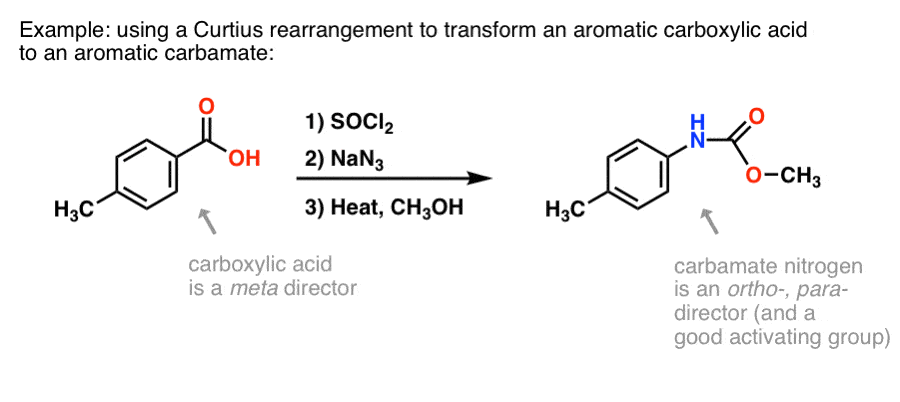
(Desta forma é algo análogo a uma oxidação Baeyer-Villiger com nitrogênio equivalente. )
Mais Exemplos de Nucleófilos Azide: Adição de epóxidos e conjugados
Duas outras duas aplicações do íon azida como nucleófilo incluem os epóxidos de abertura (no que é essencialmente um processo SN2 – note a inversão da configuração) e também adição conjugada em cetonas alfa,beta insaturadas:
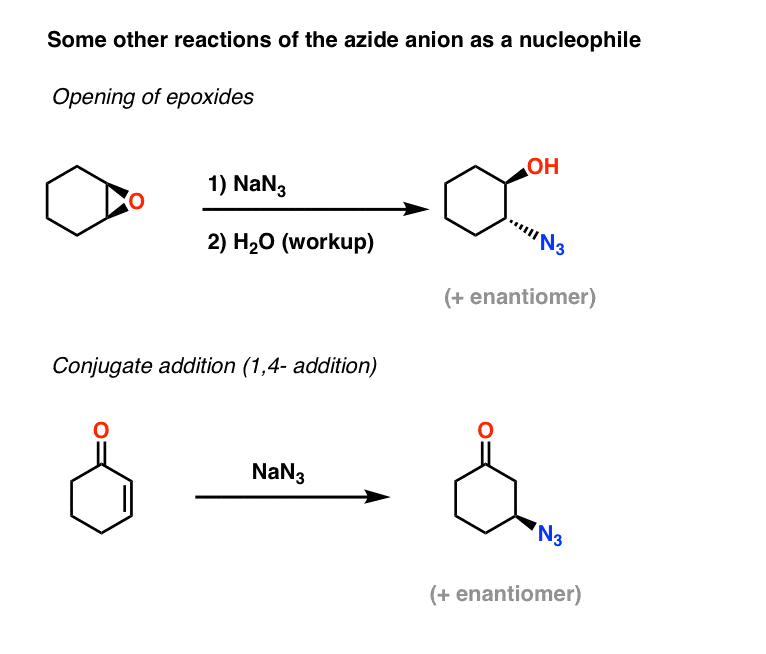
As azidas alquílicas resultantes podem então ser reduzidas a aminas primárias usando os métodos acima referidos.
Notas
Pés: Cicloadições azido-alquídicas, também conhecidas como Cicloadições Azide-Alquídicas. Química do “clique”
Uma interessante e útil aplicação de azidas orgânicas que ainda não se tornou em livros de química orgânica introdutória (mas provavelmente o será num futuro próximo) é um processo tecnicamente chamado de “Cicloadição de azida alquídica catalisada pelo cobre”, mas mais comumente chamado apenas de “reação de clique alquídico”.
Quando um alquino terminal é tratado com um catalisador de cobre na presença de uma azida orgânica, uma cicloadição resulta rapidamente, levando à formação de um 1,2,3-triazol.
Não nos aprofundaremos nos detalhes, mas esta reacção de formação de anéis envolve 6 piezinhos de electrões e é uma prima da reacção Diels-Alder (os nitpckers notarão com razão que a versão catalisada de cobre não é tecnicamente um processo concertado, mas a versão não catalisada é)
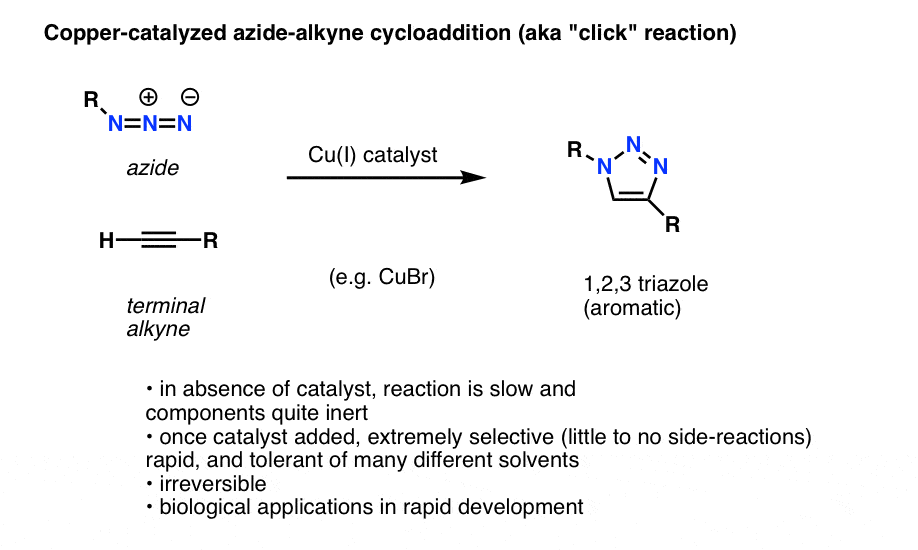
A reacção é notável por algumas razões:
- os parceiros reactivos (alquino terminal e azida orgânica) são relativamente inertes na ausência de um catalisador na maioria das condições.
- é adicionado cobre, a reacção ocorre extremamente rapidamente em condições suaves e numa variedade de solventes (incluindo água).
- é extremamente selectivo nestas condições,os parceiros alquídicos e azidas reagem apenas um com o outro, de forma irreversível.
- o produto, um anel de triazol, é aromático e estável
É chamado de reacção “click” por um dos seus originadores, Barry Sharpless, porque é uma das coisas mais próximas que os químicos têm de uma reacção que é como o suave “click together” de dois blocos de lego complementares.
O que tornou esta reacção particularmente útil nos últimos tempos é que os parceiros azida e alkyne podem ser instalados em moléculas de interesse biológico, e “clicados” juntos quando desejado.
Por exemplo:
- Pôr um acetileno na posição 5′ de um açúcar e uma azida na posição 3′ foi usado para fazer ADN “clicado”, onde o triazol substitui o organofosforado.
- Incrívelmente, um grupo fez ADN “clicado”, colocou-o em células humanas, e conseguiu que fosse transcrito pelo RNA do mensageiro.
- O AZT contendo AZT (acima) funciona através da transcrição da máquina de transcrição. Algumas pessoas inteligentes encontraram uma maneira de aplicar a reação de clique azide-alkyne em direção ao sequenciamento rápido do genoma, uma técnica conhecida como ClickSeq.
Takata usou azida sódica no início dos anos 90, e depois se mudou para tetrazole e depois nitrato de amônio.
From “Sixty Million Car Bombs”: Inside Takata’s Air Bag Crisis”.
Ammonium nitrate was about one-tenth the price of tetrazole, according to Upham, who also reviewed industry patents. Mas o nitrato de amônio tinha uma falha crítica que, segundo ele, levou outros fabricantes de air bags a desistirem dele: O nitrato de amónio tem cinco fases de densidade variável que tornam difícil manter a estabilidade ao longo do tempo. Um propulsor feito com nitrato de amônio incharia e encolheria com as mudanças de temperatura, e eventualmente o comprimido se decomporia em pó. A água e a humidade acelerariam o processo. O pó queima mais rapidamente do que um comprimido, de modo que um saco de ar cujo propulsor se tinha desmoronado, seria susceptível de se implantar de forma demasiado agressiva. A explosão controlada seria apenas uma explosão. “Todos seguiram um determinado caminho e apenas Takata seguiu outro”, diz Jochen Siebert, que acompanha a indústria de airbags desde os anos 90 e agora é diretor-gerente da JSC Automotive Consulting. “Se você ler os documentos da conferência de então, você pode ver que as pessoas disseram: ‘Não, você não deve'”. É perigoso”. “
Morreu 13 pessoas em todo o mundo e feriu mais de 100.
A 25 de Junho de 2017, enfrentando um passivo de mais de 11 biliões de dólares, a Takata declarou falência.
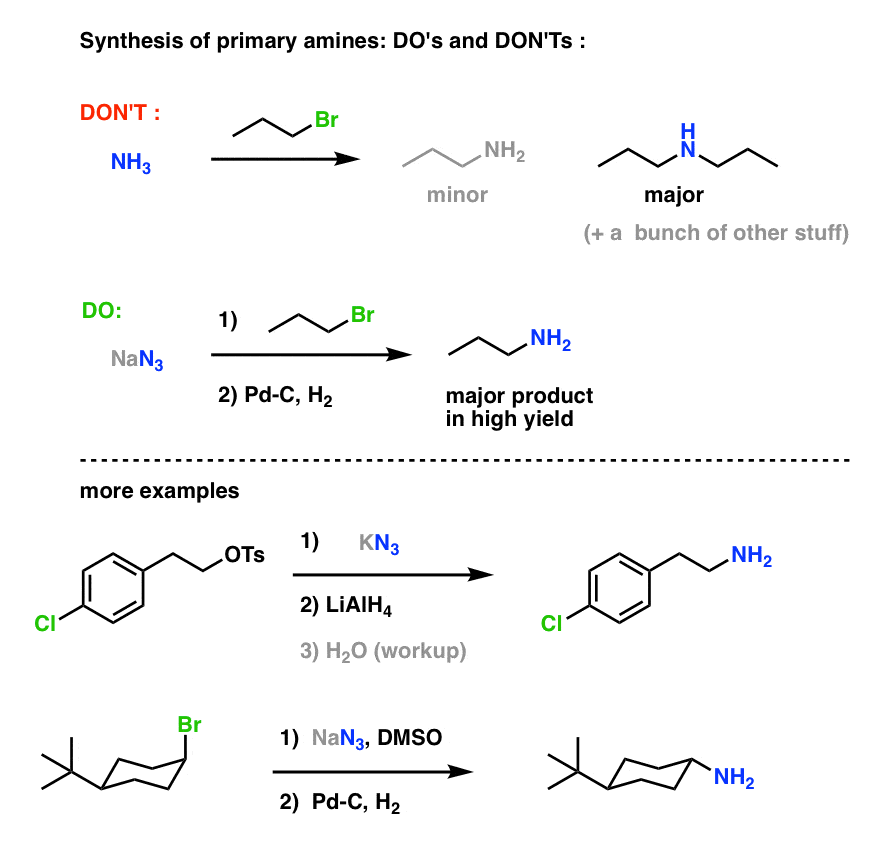
Síntese de aminas primárias “Do’s e Don’ts” :
Referências (Avançadas) e Leitura Adicional
Azidas são úteis na síntese orgânica, e um destaque da química azida é dado nas referências abaixo.
- Reactividade nucleófila do ião azida em vários solventes
Thanh Binh Phan, Herbert Mayr
Phys. Org. Chem. 2006, 19 (11), 706-713
DOI: 10.1002/poc.1063
Prof. Herbert Mayr (LMU, Munique, Alemanha) passou sua carreira contribuindo para a química física orgânica fundamental, quantificando a eletrofilicidade e a nucleofilicidade, e desenvolvendo escalas para comparar a reatividade de vários nucleófilos e eletrofilos. - Os deslocamentos SN2 em brosilatos 2-norbornyl
Klaus Banert e Wolfgang Kirmse
Journal of the American Chemical Society 1982, 104 (13), 3766-3767
DOI: 1021/ja00377a057 - Uma Síntese Melhorada de Azidothymidine
I. Balagopala, A. P. Ollapally, & H. J. Lee
Nucleosídeos, Nucleotídeos &Ácidos Nucleicos 1996, 4, 899-906
DOI: 10.1080/07328319608002136
Azidas podem ser usadas como nucleófilos nas reacções SN2. Ref. #3 mostra o uso do íon azida na síntese de AZT (azidothymidine). A conversão de 1 a 5 via 3 na ref. #3 utiliza a Reação Mitsunobu, que permite o deslocamento de um grupo -OH com um nucleófilo com inversão de configuração. - Redução de Azidas Orgânicas para Aminas Primárias com Hidreto de Lítio e Alumínio
H. Boyer
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
DOI: 10.1021/ja01156a507
A redução das azidas orgânicas a aminas primárias é um método conveniente para a síntese de aminas primárias, que de outra forma são difíceis de sintetizar seletivamente por métodos padrão. - A sensibilidade explosiva das azidas metálicas ao impacto
P. G. Raposa
J. Química de Estado Sólido. 1970, 2 (4), 491-502
DOI: 10.1016/0022-4596(70)90043-5
Uma investigação da sensibilidade ao choque de NaN3, TlN3, e Pb(N3)2. - A Reação Curtius
Smith, P. A. S. Reage. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
Uma revisão antiga mas abrangente da reação Curtius, que inclui a história da descoberta deste rearranjo, escopo do substrato, limitações, comparação com outras reações similares, e procedimentos experimentais. - Métodos sintéticos e reações. 121. Preparação catalisada por iodeto de zinco de azidas aroílicas de cloretos aroílicos e trimetilsilílicos
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi, e George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051b
Um procedimento conveniente para a preparação de azidas aromáticas de aryl do Prof. Estas podem então ser usadas para rearranjos de Curtius.
Epoxide opening and conjugate addition:
- CICLOHEXENE IMINE (7-AZA-BICICLOHEPTANE)
Iain D. G. Watson, Nicholas Afagh e Andrei K. Yudin
Org. Synth. 2010, 87, 161-169
DOI: 10.15227/orgsyn.087.0161
Este é um procedimento particularmente útil, pois é uma reação Staudinger para conversão de epóxidos em NH-aziridinas (o análogo de nitrogênio dos epóxidos). A síntese pode ser complicada, mas muitos detalhes foram fornecidos aqui para que isto possa ser reproduzido, como procedimento apropriado em Sínteses Orgânicas. - Adição Catalizada de Íon-azida a α,β-Unsaturated Carbonyl Compounds
David J. Guerin, Thomas E. Horstmann, e Scott J. Miller
Cartas Orgânicas 1999, 1 (7), 1107-1109
DOI: 10.1021/ol9909076
Este trabalho é interessante, pois representa uma forma inicial ou organocatálise e provavelmente prossegue através de um imine ou íon iminium intermediário. Infelizmente o termo não é usado em nenhuma parte do artigo – estes autores poderiam ter batido o Prof. MacMillan no punch! - Clique em Química: Diverse Chemical Function from a F few Good Reactions
Hartmuth C. Kolb Dr. M. G. Finn Prof. K. Barry Sharpless Prof.
Angew Chem. Int. Ed. 2001, 40 (11), 2004-2021
DOI: 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5
A Cicloadição Cu-catalítica de azidas com alcinos foi apelidada de uma reacção de ‘clique’ pelo Prof. K. Barry Sharpless (The Scripps Research Institute, La Jolla, CA) devido à sua simplicidade, altos rendimentos, cinética rápida e compatibilidade com uma vasta gama de condições e substratos. Reacções sem cu são também possíveis se forem utilizados alcinos deformados (por exemplo, ciclooctynes).