Chemguide: Suporte para CIE A level Chemistry
Resultado do aprendizado 11.2(f)
Esta declaração é sobre coeficientes de partição.
Antes de continuar, você deve encontrar e ler a declaração na sua cópia do programa de estudos.
Partição
Se você tem dois líquidos imiscíveis como éter e água, e os sacode em um funil separador, eles obviamente formam duas camadas. O éter é menos denso que a água, e assim forma a camada superior.
Agora suponha que você sacode uma mistura de éter e água contendo uma substância que é solúvel em ambas. Vamos supor que a substância, X, é mais solúvel em éter do que em água.
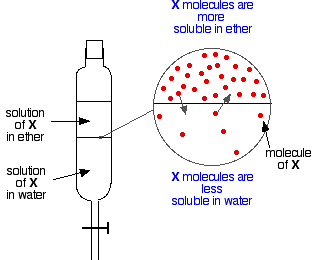
Particulas de X atravessarão a fronteira entre as duas camadas líquidas, e você logo terá um equilíbrio dinâmico estabelecido. Para cada partícula que se move para a camada superior, uma irá voltar para baixo na camada inferior.
Você poderia escrever uma equação para isto:
![]()
![]()
. . e como qualquer outro equilíbrio, você pode encontrar uma constante de equilíbrio:
![]()
![]()
> Esta constante de equilíbrio é chamada de coeficiente de partição, e frequentemente é dado o símbolo Kpc.
Como outras constantes de equilíbrio, os coeficientes de partição são constantes a uma temperatura constante, mas eles também têm algumas outras restrições. Eles só funcionam corretamente para soluções bastante diluídas, e o soluto deve estar na mesma forma química em ambos os solventes. Não deve reagir, nem ionizar ou associar (unir em dímeros, por exemplo).
Cálculo do coeficiente de partição
Nota sobre unidades
Nota que o coeficiente de partição é uma razão simples de duas concentrações. Não importa que unidades de concentração você usa – desde que você use as mesmas unidades superiores e inferiores.
Você poderia usar mol dm-3, mas mais frequentemente você usa g cm-3 – gramas por centímetro cúbico.
Tecnicamente, os colchetes só podem ser usados para concentração em mol dm-3, mas o Livreto de Suporte ao Aplicativo e os esquemas de marcas da CIE também o usam para outras unidades.
Não estou preparado para fazer isso, e assim deve usar o termo “concentração de X” ao invés de onde unidades de concentração não-padrão são usadas.
Calculando um coeficiente de partição
Quando uma solução de 1,00 g de X em 100 cm3 de água foi agitada com 10 cm3 de éter, 0,80 g de X foi transferido para a camada de éter. Calcular o coeficiente de partição de X entre o éter e a água.
Se lhe for pedido para calcular um coeficiente de partição entre dois solventes, a concentração do primeiro solvente mencionado vai para cima da expressão Kpc. Então neste caso:
![]()
![]()
Você tem informação suficiente para calcular ambas as concentrações em g cm-3,
![]() concentração de X no éter = 0,80/10 g cm-3
concentração de X no éter = 0,80/10 g cm-3
Se 0,80 g fossem transferidos para o éter, 1,00 – 0,80 g = 0.20 g foram deixados na água.
![]() concentração de X na água = 0,20/100 g cm-3
concentração de X na água = 0,20/100 g cm-3
>So:
![]()
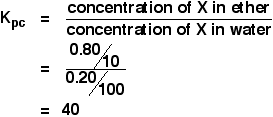
Obviamente, você poderia trabalhar as concentrações no éter e na água como números reais antes de colocá-los na expressão. Faça-o como se sentir mais confortável.
Coeficientes de partição como este não têm unidades – as unidades cancelam porque são as mesmas de cima e de baixo.
Cálculos envolvendo coeficientes de partição
O programa CIE diz especificamente que você deve ser capaz de calcular um coeficiente de partição (em outras palavras, o que acabamos de fazer). Ele não diz nada sobre como usá-los para calcular outras coisas. Estes cálculos extras são discutidos no Caderno de Apoio à Aplicação e foram solicitados duas vezes em exames até Junho de 2013 (ambos em 2009).
O Caderno de Curso não os inclui (muito apropriadamente!) porque o programa não os menciona, e este livro foi endossado pelos examinadores do CIE como uma “cobertura completa e precisa” do programa. Então isso significa que o CIE não fará mais perguntas no futuro? Não conte com isso!
Um exemplo básico
Usaremos o mesmo caso de antes – os mesmos solventes, o mesmo X e o mesmo coeficiente de partição que acabamos de calcular.
Desta vez vamos calcular quanto teria sido extraído para a camada de éter se tivéssemos agitado a solução original de 1,00 g de X em 100 cm3 de água com apenas 5 cm3 de éter.
Estamos tentando calcular a massa de X extraída. Vamos chamar isso de m.
Agora trabalhar uma expressão para a concentração da solução de X no éter.
![]() concentração de X no éter = m/5 g cm-3
concentração de X no éter = m/5 g cm-3
>E quanto à água? Haverá (1,00 – m) g de X na água. Então:
![]() concentração de X na água = (1,00 – m)/100 g cm-3
concentração de X na água = (1,00 – m)/100 g cm-3
Agora você pode colocar tudo isso na expressão do coeficiente de partição. Lembre-se que já calculamos o coeficiente de partição de X entre éter e água como 40,
![]()
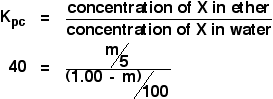 >
>
>
Você está então apenas diante de um simples, mas ligeiramente entediante, pedaço de álgebra:
>![]()
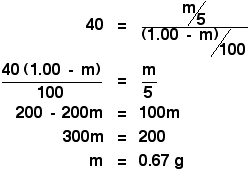
Tornando-o mais entediante!
No cálculo original para encontrar o coeficiente de partição, foi-lhe dito que se abanasse a solução original de 1,00 g de X em 100 cm3 de água com 10 cm3 de éter, extraía 0,80 g de X,
Agitando-a com 5 cm3 de éter, acabamos de descobrir que extrairia 0,67 g de X,
Que deixaria 0,33 g de X para trás nos 100 cm3 de água. Suponha que você tivesse mantido cuidadosamente esta solução, e depois a sacudisse com um segundo 5 cm3 de éter fresco.
Quanto de X você extrairia no total usando o éter como dois lotes separados de 5 cm3 em vez dos 10 cm3 de uma só vez?
Chame a massa de X extraída pelo segundo lote de éter n – para não nos confundirmos.
Trabalhemos uma expressão para a concentração da solução de X no éter.
>![]() concentração de X no éter = n/5 g cm-3
concentração de X no éter = n/5 g cm-3
E quanto à água? Haverá (0,33 – n) g de X na água após a segunda extração. Então:
![]() concentração de X na água = (0,33 – n)/100 g cm-3
concentração de X na água = (0,33 – n)/100 g cm-3
Agora você pode colocar tudo isso na expressão do coeficiente de partição de X entre o éter e a água como antes.
![]()

Isso significa que se você tivesse que combinar os dois lotes de 5 cm3 de éter, você teria extraído um total de 0,67 + 0,22 g de X. Isso é 0.89 g.
Vocês foram informados que se tivessem feito isso apenas uma vez, usando o éter como um lote único de 10 cm3, vocês teriam extraído apenas 0,80 g.
Vocês conseguem uma extração mais eficiente dividindo o solvente em volumes menores como acima.
Vocês usam esse tipo de técnica durante a preparação de alguns compostos orgânicos. Você extrai o que você está tentando fazer de alguma solução confusa em água para que ela acabe em um solvente orgânico. Você então remove o solvente por destilação cuidadosa.
CIE fez uma pergunta semelhante a esta em junho de 2009 paper 4 Q8. Você teve que calcular um valor para o coeficiente de partição, e depois usá-lo em uma extração em duas etapas exatamente como acima. O cálculo valeu 4 marcos. Isto pode ser aborrecido e (além de calcular o coeficiente de partição) não no programa, mas não se pode dar ao luxo de não o poder fazer.