Objectivos de Aprendizagem
- Utilizar notação celular para descrever células galvânicas
- Descrever os componentes básicos das células galvânicas
Células galvânicas, também conhecidas como células voltaicas, são células eletroquímicas nas quais as reações de oxidação-redução espontânea produzem energia elétrica. Ao escrever as equações, é frequentemente conveniente separar as reacções de oxidação-redução em semi-reacções para facilitar o equilíbrio da equação global e enfatizar as transformações químicas reais.
Considerar o que acontece quando uma peça limpa de cobre metálico é colocada numa solução de nitrato de prata (Figura 1). Assim que o metal de cobre é adicionado, o metal de prata começa a se formar e íons de cobre passam para a solução. A cor azul da solução na extrema direita indica a presença de íons de cobre. A reação pode ser dividida em suas duas meias reações. As meias-reacções separam a oxidação da redução, pelo que cada uma pode ser considerada individualmente.
A equação para a semi-reacção de redução teve de ser duplicada para que o número de electrões “ganhos” na semi-reacção de redução fosse igual ao número de electrões “perdidos” na semi-reacção de oxidação.

Células Galvânicas ou voltaicas envolvem reacções electroquímicas espontâneas em que as meias-reacções são separadas (Figura 2) para que a corrente possa fluir através de um fio externo. O copo do lado esquerdo da figura é chamado de meia célula, e contém uma solução de 1 M de nitrato de cobre(II) com um pedaço de metal de cobre parcialmente submerso na solução. O metal de cobre é um eléctrodo. O cobre está em oxidação; portanto, o eletrodo de cobre é o ânodo. O ânodo é ligado a um voltímetro com um fio e o outro terminal do voltímetro é ligado a um eléctrodo de prata por um fio. A prata está sendo reduzida; portanto, o eletrodo de prata é o cátodo. A meia célula do lado direito da figura consiste no eléctrodo de prata numa solução de 1 M de nitrato de prata (AgNO3). Neste ponto, não há fluxo de corrente, ou seja, não ocorre nenhum movimento significativo de elétrons através do fio porque o circuito está aberto. O circuito é fechado usando uma ponte de sal, que transmite a corrente com iões em movimento. A ponte de sal consiste de uma solução de electrólito concentrado, não reactivo, como a solução de nitrato de sódio (NaNO3) utilizada neste exemplo. Como os electrões fluem da esquerda para a direita através do eléctrodo e do fio, os iões de nitrato (aniões) passam através do tampão poroso à esquerda para a solução de nitrato de cobre(II). Isto mantém o copo do lado esquerdo eletricamente neutro, neutralizando a carga sobre os íons de cobre(II) que são produzidos na solução à medida que o metal de cobre é oxidado. Ao mesmo tempo, os iões de nitrato movem-se para a esquerda, os iões de sódio (catiões) movem-se para a direita, através do tampão poroso, e para a solução de nitrato de prata à direita. Estes catiões adicionados “substituem” os iões de prata que são removidos da solução à medida que são reduzidos a metal prateado, mantendo o copo do lado direito electricamente neutro. Sem a ponte de sal, os compartimentos não permaneceriam eletricamente neutros e nenhuma corrente significativa fluiria. No entanto, se os dois compartimentos estiverem em contacto directo, não é necessária uma ponte de sal. No momento em que o circuito é completado, o voltímetro lê +0,46 V, isto é chamado de potencial da célula. O potencial da célula é criado quando os dois metais dissimilares estão conectados, e é uma medida da energia por unidade de carga disponível a partir da reação de oxidação-redução. O volt é a unidade SI derivada para o potencial elétrico
Nesta equação, A é a corrente em amperes e C a carga em coulombs. Note que os volts devem ser multiplicados pela carga em coulombs (C) para obter a energia em joules (J).
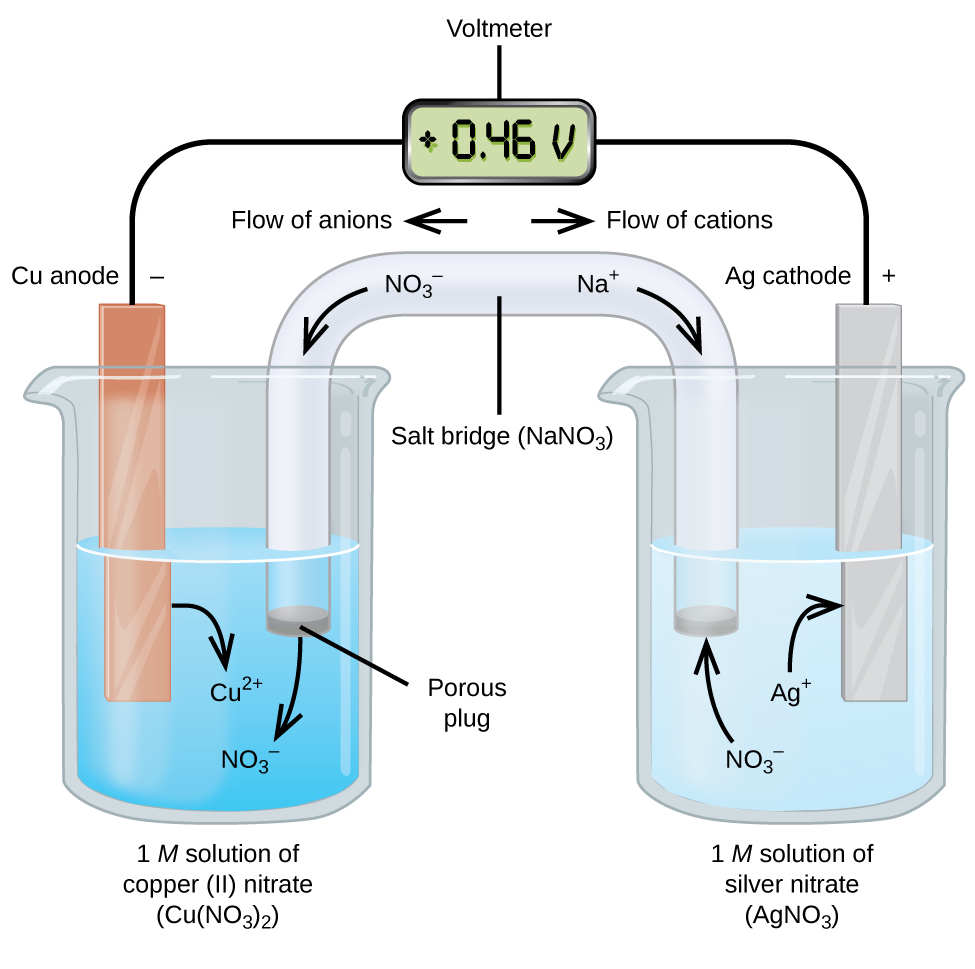
Quando a célula eletroquímica é construída desta forma, um potencial positivo da célula indica uma reação espontânea e que os elétrons estão fluindo da esquerda para a direita. Há muito acontecendo na Figura 2, portanto é útil resumir as coisas para este sistema:
- O fluxo de elétrons do ânodo para o cátodo: da esquerda para a direita na célula galvânica padrão na figura.
- O eletrodo na meia-célula esquerda é o ânodo porque a oxidação ocorre aqui. O nome refere-se ao fluxo de ânions na ponte de sal em direção a ela.
- O eletrodo na meia-célula direita é o ânodo porque a redução ocorre aqui. O nome se refere ao fluxo de cátions na ponte de sal em direção a ela.
- Oxidação ocorre no anodo (a meia-célula esquerda na figura).
- Redução ocorre no cátodo (a meia-célula direita na figura).
- O potencial da célula, +0.46 V, neste caso, resulta das diferenças inerentes à natureza dos materiais utilizados para fazer as duas meias-células.
- A ponte de sal deve estar presente para fechar (completar) o circuito e tanto uma oxidação como uma redução devem ocorrer para que a corrente flua.
Existem muitas células galvânicas possíveis, por isso uma notação de curto-circuito é normalmente utilizada para descrevê-las. A notação de célula (às vezes chamada de diagrama de células) fornece informações sobre as várias espécies envolvidas na reação. Esta notação também funciona para outros tipos de células. Uma linha vertical, │, denota um limite de fase e uma linha dupla, ‖, a ponte salina. A informação sobre o ânodo é escrita à esquerda, seguida pela solução anódica, depois a ponte salina (quando presente), depois a solução catódica e, finalmente, a informação sobre o cátodo à direita. A notação de célula para a célula galvânica na Figura 2 é então
Nota que os iões espectadores não estão incluídos e que a forma mais simples de cada semi-reacção foi usada. Quando conhecidas, as concentrações iniciais dos vários íons são geralmente incluídas.
Uma das células mais simples é a célula Daniell. É possível construir esta bateria colocando um eléctrodo de cobre no fundo de um frasco e cobrindo o metal com uma solução de sulfato de cobre. Uma solução de sulfato de zinco é colocada em cima da solução de sulfato de cobre; depois um eléctrodo de zinco é colocado na solução de sulfato de zinco. A ligação do eléctrodo de cobre ao eléctrodo de zinco permite o fluxo de uma corrente eléctrica. Este é um exemplo de uma célula sem ponte de sal, e os iões podem fluir através da interface entre as duas soluções.
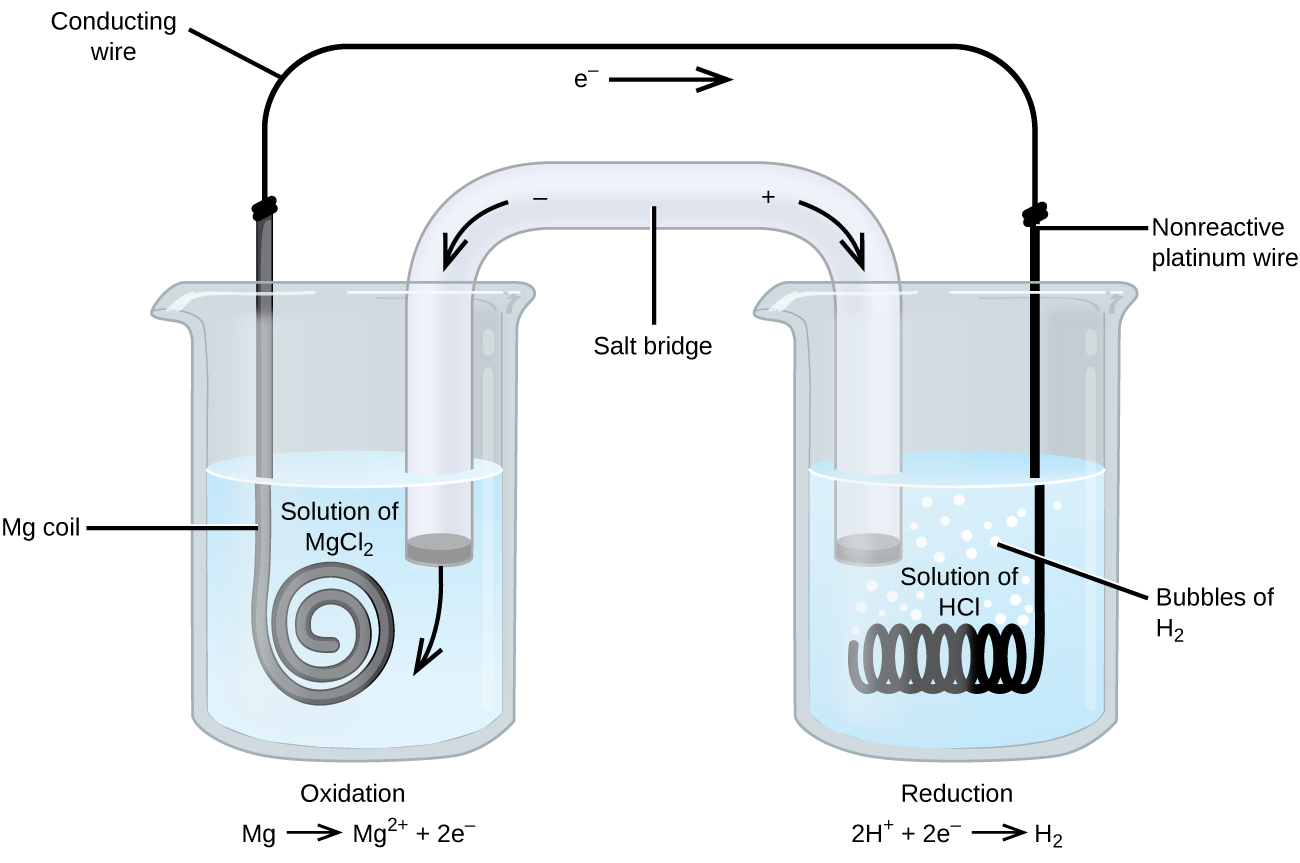
Algumas reacções de oxidação-redução envolvem espécies que são maus condutores de electricidade, pelo que é utilizado um eléctrodo que não participa nas reacções. Frequentemente, o eletrodo é de platina, ouro ou grafite, todos eles inertes a muitas reações químicas. Um desses sistemas é mostrado na Figura 3. O magnésio sofre oxidação no ânodo à esquerda na figura e os íons de hidrogênio sofrem redução no cátodo à direita. A reação pode ser resumida como
A célula usou um fio de platina inerte para o cátodo, portanto, a notação da célula é
O eléctrodo de magnésio é um eléctrodo activo porque participa na reacção de oxidação-redução. Os eletrodos inertes, como o de platina na Figura 3, não participam da reação de oxidação-redução e estão presentes para que a corrente possa fluir através da célula. A platina ou o ouro geralmente fazem bons eletrodos inertes porque são quimicamente não reativos.
Exemplo 1
Using Cell Notation
Considerar uma célula galvânica constituída por
Escrever as semi-reacções de oxidação e redução e escrever a reacção usando a notação da célula. Que reacção ocorre no ânodo? O cátodo?
Solução
Por inspecção, Cr é oxidado quando se perdem três electrões para formar Cr3+, e Cu2+ é reduzido à medida que ganha dois electrões para formar Cu. Equilibrar a carga dá
Notação de célula usa a forma mais simples de cada uma das equações, e começa com a reacção no ânodo. Nenhuma concentração foi especificada assim: \text{Cr}(s){\mid}\text{Cr}^{3+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s). A oxidação ocorre no ânodo e a redução no cátodo.
Using Cell Notation
Considerar uma célula galvânica constituída por
Escreva as semi-reacções de oxidação e redução e escreva a reacção usando a notação celular. Que reação ocorre no ânodo? O cátodo?
Solução
Por inspeção, Fe2+ sofre oxidação quando um elétron é perdido para formar Fe3+, e MnO4- é reduzido ao ganhar cinco elétrons para formar Mn2+. O balanceamento da carga dá
Notação de célula usa a forma mais simples de cada uma das equações, e começa com a reacção no ânodo. É necessário usar um eletrodo inerte, como a platina, pois não há metal presente para conduzir os elétrons do ânodo ao cátodo. Não foram especificadas concentrações assim: \text{Pt}(s){\mid}\text{Fe}^{2+}(aq)\text{,}\;\text{Fe}^{3+}(aq){\parallel}\text{MnO}_4^{\;\;-}(aq)\text{,}\;\text{H}^{+}(aq)\text{,}\;\text{Mn}^{2+}(aq){\mid}\text{Pt}(s). A oxidação ocorre no ânodo e a redução no cátodo.
Check Your Learning
Utilizar notação celular para descrever a célula galvânica onde os íons de cobre(II) são reduzidos a cobre metálico e o zinco metálico é oxidado a íons de zinco.
Resposta:
Das informações dadas no problema:
\begin{array}{lr @{{}longrightarrow{}} l} \texto (anode);(oxidação):{\i1} &texto{Zn}(s) &texto{Zn}^{2+}(aq);+;2}text{e}^{-} \\ texto (catódigo-catódico);(redução):{\i1} & \text{Cu}^{2+}(aq)\;+\;2\text{e}^{-} &texto{Cu}(s) &texto{Zn};+3631>texto{Zn};+3631>texto{Cu}^{2+}(aq) &texto{Zn}^{2+}(aq)^;+3631>texto{Cu}(s) {Cu}(s) ^8547>
Utilizar notação de célula:
\text{Zn}(s){\mid}\text{Zn}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s).
Células eletroquímicas normalmente consistem de duas meias-células. As meias-células separam a semi-reacção de oxidação da semi-reacção de redução e tornam possível que a corrente flua através de um fio externo. Uma meia-célula, normalmente representada no lado esquerdo de uma figura, contém o ânodo. A oxidação ocorre no ânodo. O ânodo está ligado ao cátodo na outra meia-célula, muitas vezes representado no lado direito de uma figura. A redução ocorre no cátodo. A adição de uma ponte de sal completa o circuito permitindo que a corrente flua. Os ânions na ponte de sal fluem em direção ao ânodo e os cátions na ponte de sal fluem em direção ao cátodo. O movimento desses íons completa o circuito e mantém cada meia-célula eletricamente neutra. As células eletroquímicas podem ser descritas usando a notação de célula. Nesta notação, a informação sobre a reação no ânodo aparece à esquerda e a informação sobre a reação no cátodo à direita. A ponte salina é representada por uma linha dupla, ‖. As fases sólida, líquida ou aquosa dentro de uma meia-célula são separadas por uma única linha, │. A fase e concentração das várias espécies é incluída após o nome da espécie. Os eléctrodos que participam na reacção de oxidação-redução são chamados de eléctrodos activos. Os eletrodos que não participam da reação de oxidação-redução mas que estão lá para permitir o fluxo da corrente são eletrodos inertes. Eléctrodos inertes são muitas vezes feitos de platina ou ouro, que são inalterados por muitas reacções químicas.
Exercícios de Fim de Capítulo de Química
- Escrever as seguintes reacções equilibradas usando notação celular. Use platina como um eletrodo inerte, se necessário.
(a) \text{Mg}(s)\;+\;\text{Ni}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Ni}(s)
(b) 2\text{Ag}^{+}(aq)\;+\;\text{Cu}(s)\;{\longrightarrow}\;\text{Cu}^{2+}(aq)\;+\;2\text{Ag}(s)
(c) \text{Mn}(s)\;+\;\text{Sn(NO}_3)_2(aq)\;{\longrightarrow}\;\text{Mn(NO}_3)_2(aq)\;+\;\text{Au}(s)
(d) 3\text{CuNO}_3(aq)\;+\;\text{Au(NO}_3)_3(aq)\;{\longrightarrow}\;3\text{Cu(NO}_3)_2(aq)\;+\;\{Au}(s)
- Dadas as seguintes notações celulares, determinar as espécies oxidadas, espécies reduzidas, e o agente oxidante e redutor, sem escrever as reacções equilibradas.
(a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s)
(b) \texto{Ni}{Ni}{2+}(aq)parallel}text{Ag}^{+}(aq)mid}text{Ag}(s)
- Para as notações das células do problema anterior, escrever as reacções equilibradas correspondentes.
- Balancear as seguintes reacções e escrever as reacções usando notação de células. Ignore quaisquer eletrodos inertes, pois eles nunca fazem parte das semi-reações.
(a) \text{Al}(s)\;+\;\text{Zr}^{4+}(aq)\;{\longrightarrow}\;\text{Al}^{3+}(aq)\;+\;\text{Zr}(s)
(b) \text{Ag}^{+}(aq)\;+\;\text{NO}(g)\;{\longrightarrow}\;\text{Ag}(s)\;+\;\text{NO}_3^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(acidic\;solution)}
(c) \text{SiO}_3^{\;\;2-}(aq)\;+\;\text{Mg}(s)\;{\longrightarrow}\;\text{Si}(s)\;+\;\text{Mg(OH)}_2(s)\;\;\;\;\;\;\;\text{(basic\;solution)}
(d) \text{ClO}_3^{\;\;-}(aq)\;+\;\text{MnO}_2(s)\;{\longrightarrow}\;\text{Cl}^{\;\;-}(aq)\;+\;\text{MnO}_4^{\;\;-}(aq)\;\;\;\;\;\;\texto (básico, solução)
- Identificar as espécies oxidadas, as espécies reduzidas, e o agente oxidante e redutor de todas as reacções do problema anterior.
- Das informações fornecidas, utilize notação celular para descrever os seguintes sistemas:
(a) Em uma meia célula, uma solução de Pt(NO3)2 forma Pt metal, enquanto na outra meia célula, Cu metal vai para uma solução de Cu(NO3)2 com todas as concentrações de solução 1 M.
(b) O cátodo consiste de um eletrodo de ouro em uma solução de Au(NO3)3 0,55 M e o ânodo é um eletrodo de magnésio em 0.75 Mg(NO3)2 solução.
(c) Uma meia-célula consiste de um eletrodo de prata em uma solução de 1 M de AgNO3, e na outra meia-célula, um eletrodo de cobre em 1 M Cu(NO3)2 é oxidado.
- Por que é necessária uma ponte de sal em células galvânicas como a da Figura 2?
- Eléctrodo (metálico) ativo foi encontrado para perder massa, uma vez que a reação de oxidação-redução foi permitida para prosseguir. O eletrodo era parte do ânodo ou cátodo? Explique.
- Eléctrodos activos participam na reacção de oxidação-redução. Como os metais formam cátions, o eletrodo perderia massa se os átomos metálicos do eletrodo fossem oxidar e entrar em solução. A oxidação ocorre no ânodo.
- A massa de três eletrodos metálicos diferentes, cada um de uma célula galvânica diferente, foram determinados antes e depois da corrente gerada pela reação de oxidação-redução em cada célula foi permitida a fluir por alguns minutos. O primeiro eletrodo metálico, dado o rótulo A, foi considerado como tendo aumentado de massa; o segundo eletrodo metálico, dado o rótulo B, não mudou de massa; e o terceiro eletrodo metálico, dado o rótulo C, foi considerado como tendo perdido massa. Adivinhe quais eletrodos estavam ativos e quais eram eletrodos inertes, e quais eram ânodos e quais eram catodos.
Glossary
eletrodo ativo que participa da reação de oxidação-redução de uma célula eletroquímica; a massa de um eletrodo ativo muda durante a reação de oxidação-redução de um eletrodo anódico em uma célula eletroquímica na qual ocorre a oxidação; informação sobre o ânodo é registrada no lado esquerdo da ponte de sal em notação de célula eletrodo catódico em uma célula eletroquímica na qual ocorre a redução; informação sobre o cátodo é registrada no lado direito da ponte de sal em notação de célula de forma a representar as reações em uma célula eletroquímica diferença de potencial de potencial elétrico que surge quando metais diferentes são conectados; a força motriz do fluxo de carga (corrente) em reações de oxidação-redução célula galvânica eletroquímica que envolve uma reação espontânea de oxidação-redução; células eletroquímicas com potenciais celulares positivos; também chamado eletrodo de eletrodo inerte de célula voltaica que permite o fluxo de corrente, mas que não participa da reação de oxidação-redução em uma célula eletroquímica; a massa de um eletrodo inerte não muda durante a reação de oxidação-redução; eletrodos inertes são freqüentemente feitos de platina ou ouro porque esses metais são quimicamente não reativos. célula voltaica outro nome para uma célula galvânica
Soluções
Respostas à Química Exercícios de Fim de Capítulo
1. (a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Ni}^{2+}(aq){\mid}\text{Ni}(s); (b) \text{Cu}(s){\mid}\text{Cu}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s); (c) \text{Mn}(s){\mid}\text{Mn}^{2+}(aq){\parallel}\text{Sn}^{2+}(aq){\mid}\text{Sn}(s); (d) \text{Pt}(s){\mid}\text{Cu}^{+}(aq)\text{,\;Cu}^{2+}(aq){\parallel}\text{Au}^{3+}(aq){\mid}\text{Au}(s)
3. (a) \text{Mg}(s)\;+\;\text{Cu}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Cu}(s); (b) 2\text{Ag}^{+}(aq)\;+\;\text{Ni}(s)\;{\longrightarrow}\;\text{Ni}^{2+}(aq)\;+\;2\text{Ag}(s)
5. Espécie oxidada = agente redutor: (a) Al(s); (b) NO(g); (c) Mg(s); e (d) MnO2(s); Espécie reduzida = agente oxidante: (a) Zr4+(aq); (b) Ag+(aq); (c) \text{SiO}_3^{\;\;\;2-}(aq); e (d) \text{ClO}_3^{\;\;-}(aq)
7. Sem a ponte de sal, o circuito estaria aberto (ou quebrado) e nenhuma corrente poderia fluir. Com uma ponte de sal, cada meia-célula permanece eletricamente neutra e a corrente pode fluir através do circuito.
9. Um eletrodo ativo (metálico) foi encontrado para ganhar massa, uma vez que a reação de oxidação-redução foi permitida para prosseguir. O eletrodo fazia parte do ânodo ou do cátodo? Explique.