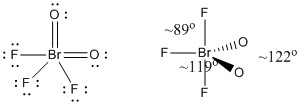Intermediate Inorganic Chemistry
University of Rhode Island
Fall 2013
Exam 1
1. Escreva a configuração eletrônica (usando notação de gás raro para conchas fechadas) e o Termo Símbolo para o seguinte: a) Sc; b) Sc+; c) Sc2+; d) Sc3+; e) Sc-.
a) Sc
4s23d1
Apenas o electrão 3d contribui para o termo símbolo: L = 2 e S = ½ dando 2D
b) Sc+
3d2
L = 3 e S = 1 dando 3F
c) Sc2+
3d1
L = 2 e S = ½ dando 2D
d) Sc3+
L = 0 e S = 0 dando 1S
d) Sc-
4s23d2
L = 3 e S = 1 dando 3F
>
2. Escrever a estrutura de pontos de Lewis, dar as cargas formais em todos os átomos, prever a geometria molecular, estimar todos os ângulos de ligação e dar o provável orbital híbrido para o seguinte: a) BrO2-; b) BrO3-; c) BrO2F3.
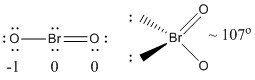
a) BrO2-
Lewis Estrutura:
Cargas formais são dadas na Estrutura Lewis
Estrutura: plano dobrado com um ângulo de ligação de ~107°
Orbital híbrido sobre Br: sp3
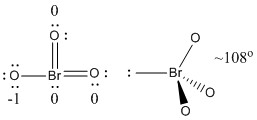
b) BrO3-
Estrutura Lewis:
Cargas formais são dadas na Estrutura Lewis
Estrutura: piramidal com ângulos de ligação O-Br-O ~108°
Orbital híbrido sobre Br: sp3
c) BrO2F3
Estrutura Lewis:
Cargas formais são dadas na Estrutura Lewis
Estrutura: bipiramidal trigonal com ângulos de ligação mostrados na figura
Orbital híbrido sobre Br: dsp3
>
3. A Dureza Absoluta de um átomo é definida como η = ½(IP – EA), IP é o potencial de ionização e EA é a afinidade dos elétrons. Preveja as tendências periódicas do η e forneça o raciocínio para sua previsão.
Para quase todos os átomos IP >> EA, assim η seguirá as tendências periódicas de IP: aumentando à medida que se move na Tabela Periódica (seguindo Z*) e diminuindo ligeiramente à medida que se move para baixo na Tabela Periódica à medida que o raio atómico aumenta.
4. Cr2 tem uma configuração electrónica de σ2π4δ4δ*2. Qual é a ordem de ligação e quantas giros não pareados são previstos? Você esperaria que Cr2 absorvesse a luz na região visível do espectro? Porque ou porque não?
A ordem de ligação = ½(2 + 4 + 4 – 2) = 4 com 2 giros não pareados (uma vez que existem 2 orbitais δ também devem existir 2 orbitais δ*, cada um com um electrão baseado nas regras de Hund). A sobreposição de orbitais d lado a lado para formar os orbitais δ é pobre para que a divisão entre os orbitais δ e δ* seja pequena. Isto sugere que a energia necessária para mover um elétron do HOMO para o LUMO também é pequena, o que prevê uma absorção na parte visível do espectro.