Na sua forma mais simples, uma célula electroquímica consiste em dois condutores de electrões separados por um condutor iónico e ligados por um condutor de electrões.
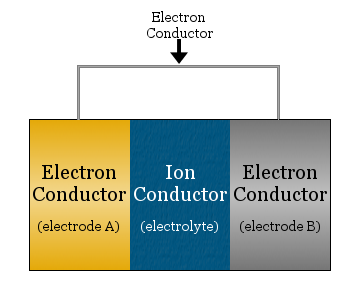
- o condutor iónico é chamado electrólito
- os condutores de electrões separados pelo electrólito são chamados eléctrodos
- o condutor de electrões utilizado para ligar os eléctrodos é muitas vezes um fio metálico, como a cablagem de cobre
Dois tipos de célula
Existem dois tipos fundamentais de célula electroquímica: galvânica e electrolítica.
A conversão de energia é conseguida por reacções redox espontâneas (ΔG < 0) produzindo um fluxo de electrões.
Um fluxo de elétrons aciona redox não espontâneo (ΔG ≥ 0) reações redox.
Exemplos
- Uma bateria alimentando algo é um exemplo de uma célula galvânica.
- As baterias recarregáveis são exemplos de ambos os tipos de células: elas funcionam como células galvânicas quando estão alimentando um dispositivo e como células eletrolíticas quando estão sendo recarregadas.
- Exemplos de células eletrolíticas também incluem aquelas usadas para dividir água em hidrogênio e oxigênio, e aquelas que convertem minério de alumínio em metal de alumínio.
Uma Fonte de Dados Termodinâmicos
Além de usos práticos, como os descritos acima, as células eletroquímicas fornecem uma excelente maneira de coletar dados termodinâmicos. Por exemplo, elas permitem a determinação de potenciais redox padrão, a partir dos quais dados de entalpia padrão, entropia padrão e energia livre de Gibbs padrão para reações podem ser obtidos convenientemente.
Reações Separadas
Células eletroquímicas podem:
- fornecer electricidade, ou
- converter minérios metálicos para o metal, ou
- fornecer dados termodinâmicos,
porque as reacções redox ocorrem separadamente.
Exemplo: A célula Daniell
Em células electroquímicas, as reacções ocorrem em eléctrodos separados – e de facto os próprios eléctrodos podem ser colocados em diferentes vasos. Considere uma das primeiras células galvânicas, a célula Daniell.
A fonte de energia da célula Daniell é a reação espontânea do zinco metálico com sulfato de cobre para produzir sulfato de zinco e cobre metálico.
ΔG° = -212.6 kJ mol-1
Quando os materiais são reunidos:
- em contacto directo num recipiente, a energia potencial química é convertida em energia térmica e o recipiente de reacção aquece
- numa célula electroquímica, a energia potencial química é convertida em energia eléctrica
A célula Daniell
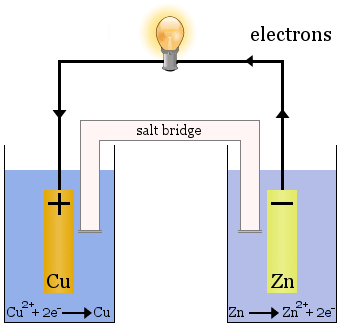
A célula Daniell é composta por duas meias-células: os íons de cobre são reduzidos em uma e o zinco é oxidado na outra.
Quando a célula opera, Cu2+ é removido de uma célula e Zn2+ é produzido na outra célula. O eletrodo de cobre começa a crescer à medida que é revestido com metal de cobre recém depositado, e o eletrodo de zinco começa a diminuir devido à perda de zinco como íons em solução.
A ponte de sal na caixa acima é um tubo de vidro preenchido com solução saturada de KNO3.Tem fritas nas extremidades que impedem a mistura das soluções em cada uma das meias-células, mas permite a passagem de iões para completar o circuito eléctrico e manter cada meia-célula electricamente neutra.
A força motriz é a mesma ΔG° = -212.6 kJ mol-1 que se obtém ao misturar simplesmente os reagentes num recipiente; separando as duas meias-reacções, os electrões devem passar pelo fio e podemos utilizar a energia eléctrica.
>

>