- Revista artigo
- Fístula Interocutânea: Gerenciamento baseado em evidências
- Abstract
- Introdução
- Quadro 1
- Quadro 1: Classificação.
- Tabela 2
- Tabela 2: Variáveis Prognósticas ECF.
- Classificação
- Factores prognósticos para ECF
- Diagnóstico
- Figure 1
- Gestão
- Resuscitação
- Controle da fonte
- Administração de efluentes
- Cuidado da ferida
- Tabela 3
- Tabela 3: Tempo para a Gestão Definitiva.
- Nutrição
- Conclusão
Revista artigo
Fístula Interocutânea: Gerenciamento baseado em evidências
Ryan P Dumas1*, Sarah A Moore1 e Carrie A Sims2
1Departamento de Traumatologia, Cuidados críticos cirúrgicos & Cirurgia de emergência, Escola de Medicina Perelman da Universidade da Pensilvânia, Filadélfia, PA, EUA
2 Departamento de Cirurgia, Divisão de Traumatologia, Cuidados Críticos Cirúrgicos & Cirurgia de Emergência, Perelman School of Medicine da Universidade da Pensilvânia, Filadélfia, PA, EUA
*Autor correspondente: Ryan P Dumas, Departamento de Traumatologia, Cuidados Críticos Cirúrgicos& Cirurgia de Emergência, Perelman Escola de Medicina da Universidade da Pensilvânia, 51 N. 39th Street, MOBSuite 120, Philadelphia, PA 19104,USA
>
Abstract
O manejo da fístula enterocutânea (ECF) é uma habilidade clínica que deve estar no armamentário de todo cirurgião geral. Embora o tratamento definitivo dependa frequentemente do fechamento cirúrgico, os cuidados e diligências pré-operatórias são primordiais para garantir um resultado bem sucedido. Os cuidados com estes pacientes devem concentrar-se em quatro fases chave. A primeira fase é caracterizada pelo reconhecimento e reanimação adequados. Durante a segunda fase, é feita uma avaliação nutricional completa e um planejamento. A avaliação radiográfica durante a terceira fase ajuda a definir a anatomia do ECF. Finalmente, a quarta fase é caracterizada pelo fechamento definitivo caso a fístula não cicatrize espontaneamente. Esta revisão focará os aspectos chave que definem cada fase e ajudará o cirurgião geral a maximizar as chances de um resultado positivo.
Introdução
O desenvolvimento de uma fístula enterocutânea (ECF), definida como uma conexão anômala entre a luz intestinal e a pele externa, é uma fonte significativa de morbidade e mortalidade, apesar dos avanços nos cuidados cirúrgicos e médicos. A incidência global de ECF, no entanto, não é conhecida com a maioria dos dados sobre ECF que vêm na forma de grandes séries retrospectivas institucionais específicas de orsurgiões. Notavelmente, apenas 25% de todos os ECFs são secundários à inflamação intestinal, patologia diverticular, trauma, radiação e malignidade. Em contraste, quase 75% de todos os ECFs são o resultado direto de uma cirurgia laparoscópica ou aberta com um vazamento asmótico após uma enterectomia sendo responsável por mais de 50% dessas fístulas. Lesões iatrogênicas inadvertidas, como asenterotomias ou lesões térmicas não reconhecidas sofridas durante uma operação, são responsáveis pelas fístulas restantes. Como o ECF é mais comumente um problema criado pelo cirurgião, o ônus da prevenção, bem como do manejo, planejamento e tratamento definitivo, cai corretamente sobre o cirurgião.
Morbidade e mortalidade após o ECF é excessivamente alta. Estima-se que 90% dos pacientes experimentam uma morbidade relacionada ao ECF que vai desde a escoriação da pele, desidratação e sepse. Além disso, a mortalidade atribuível a um ECF varia entre 5-20% e é dependente do número de fatores, incluindo infecção subjacente e localização da fístula. Como a principal causa de morte em pacientes com ECF é a sepse, o controle da fonte continua sendo uma das pedras angulares da terapia. Em séries retrospectivas, observou-se que a mortalidade aumentou 16 vezes no cenário da sepse e 22 vezes no cenário da infecção descontrolada. Como tal, o tratamento precoce e definitivo de coleções não drenadas em conjunto com antimicrobianos de curto prazo tem o potencial de melhorar significativamente os resultados. Na maioria das séries, a mortalidade também parece estar correlacionada com o débito e a localização da fístula. A mortalidade aumenta de 26% em fístulas de baixo débito para 50% em fístulas de alto débito, o que dá líquido, eletrólito e desafios nutricionais associados ao manejo de ECF. A mortalidade também se correlaciona com a localização e diminui com as fístulas mais distais. Enquanto as fístulas jejunais têm a mortalidade mais alta em 29%, e são significativamente mais desafiadoras de manejar, a mortalidade da fístula colônica é a mais baixa em 6% .
Além do impacto do paciente, que varia de fisiológico a psicológico, o manejo de ECF coloca uma tremenda tensão nos recursos de saúde. Estima-se que o custo da gestão do ECF é bem superior a 500.000 dólares e requer uma equipa multidisciplinar de nutricionistas, enfermeiros e cirurgiões para garantir um bom resultado. A importância dos centros de tratamento de alta especialização não deve ser subestimada e tem demonstrado diminuir significativamente a mortalidade de 42% para 20%.
Quadro 1

| Anatómico | Proximal ou distal | Gástrico, duodenal, jejunal, ileal, colónico |
| Fisiológico | Elevado, moderado, baixo débito | Elevado débito >500 cc/dia Moderado 200-500cc/dia Baixo débito < 200cc/dia |
| Etiologia | Iatrogénico vs. espontâneo Traumático |
Maligno Radiação Deformação inflamatória intestinal Diverticular |
Quadro 1: Classificação.
Tabela 1
Classificação.
Tabela 2

| FAVORÁVEL | UNFAVORÁVEL |
|---|---|
| Nutricionalmente repleto | Nutricionalmente esgotado |
| – Albumina >3.0 | Baixa albumina, baixa transferrina |
| Tracto de fístula longa (>2cm) | Fístula curta, fístula múltipla, complexa |
| Fístula diversa | Defeito enteral grande (>1cm), mucosa visível |
| Baixa saída | Alta saída (>500cc/dia) |
| Fístula única | Radiação principal |
| Continuidade intestinal | Múltiplas operações prévias |
| Operação indirecta realizada no mesmo centro | Referências externas a uma altacentro de volume |
Tabela 2: Variáveis Prognósticas ECF.
Tabela 2
Variáveis Prognósticas ECF.
Classificação
Não existe um esquema de classificação universal ou bem estabelecido para os ECFs. As fístulas são geralmente classificadas anatomicamente, fisiologicamente ou por processo de doença . As fístulas podem ser classificadas adicionalmente pela quantidade de produção diária. É imperativo que a produção das fístulas seja documentada com precisão, pois a quantidade pode ditar mudanças na gestão. A Tabela 1 detalha três diferentes paradigmas de classificação.
Factores prognósticos para ECF
Os factores prognósticos para ECF têm sido muito bem descritos e são consistentes com o dogma cirúrgico padrão. Pacientes com fístula proximal de alto débito acompanhada de baixa albumina (. Ao contrário, pacientes sem comorbidades que têm fístulas que são o resultado de um procedimento cirúrgico e de baixo débito fazem mais favoravelmente com fechamentos espontâneos mais altos. A importância do apoio institucional e da experiência multidisciplinar como fator prognóstico positivo não pode ser superestimada. Estudos múltiplos têm confirmado a experiência institucional e o volume como fatores críticos na diminuição da morbidade e na melhora da mortalidade. Recentemente, a Canadian Association for EnterostomalTherapy codificou a importância dos cuidados multidisciplinares, identificando nove membros essenciais da equipe em suas recomendações de “Melhores Práticas ECF”. Desde cirurgiões a farmacêuticos, esta abordagem integrada da equipe reconhece a expertise que cada especialidade traz para o cuidado destes pacientes complexos .
Diagnóstico
Um curso pós-operatório de smolding complicado pelo íleo e o desenvolvimento de uma infecção de ferida pós-operatória é um prenúncio para o ECF. Uma vez que uma fístula é suspeita ou foi identificada no exame físico, os estudos radiológicos são adjuntos necessários e 97% de todos os pacientes passam por alguma forma de avaliação radiológica. O exame de TCFC contrastado é essencial, pois avalia a presença de um abcesso associado ou uma recolha não drenada. Uma vez otimizado o controle da fonte, a fistulografia fluoroscópica desempenha um papel importante na definição da anatomia da fístula. Um fistulograma ajudará a localizar a origem, determinar o comprimento, avaliar a presença de distalobstrução e determinar se a fístula está em continuidade com o resto do intestino. Uma vez que o diagnóstico de um ECF tenha sido confirmado, o foco deve mudar para o manejo.
Figure 1
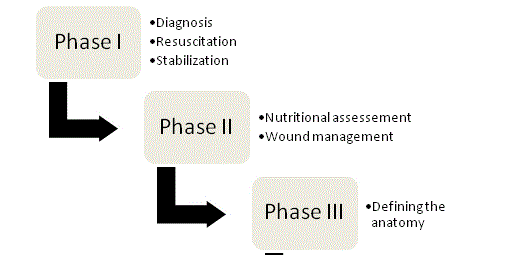
Figura 1
Quatro Fases de Gestão ECF.
Gestão
Os princípios da gestão de ECF foram defendidos pela primeira vez por Chapman e colegas em 1964 e até hoje continuam a ser as pedras angulares da terapia. Em seu artigo original, Chapman et al.identificaram quatro fatores-chave: ressuscitação de fluidos, controle de fonte, gerenciamento de efluentes e proteção da pele. A importância da nutrição surgiu recentemente como um quinto elemento-chave. Uma abordagem organizada e sistemática deve ser feita com cada paciente com fístula, a fim de otimizar as chances de um resultado bem sucedido; e o manejo pode ser dividido nas quatro fases (Figura 1).
Resuscitação
Resuscitação de um paciente com um ECF recém-diagnosticado, seguindo muitos dos mesmos princípios da ressuscitação de pacientes sépticos e princípios da Campanha Sobrevivendo à Sepse deve servir como uma estrutura . Os cuidados iniciais devem focar na reanimação agressiva com fluidos, avaliação rápida e correção de desequilíbrios eletrolíticos, e normalização da acidose láctica. Pacientes com ECF são comumente hipofonatêmicos, hipocalêmicos e acidóticos devido a perdas de GI em andamento. Pacientes com fístulas de alto débito devem ter perdas de fluido, eletrólitos e bicarbonato substituídos por via intravenosa, a fim de evitar a hidratação e instabilidade metabólica profunda durante o período de estabilização inicial. A monitoração cuidadosa do débito urinário e a substituição do efluente da fístula a cada 4 a 8 horas evitará a desidratação contínua.
Controle da fonte
Após a ressuscitação do paciente, a atenção deve mudar para o estabelecimento do controle da fonte. Como mencionado anteriormente, uma tomografia computadorizada com contraste é fundamental para identificar coleções não drenadas e abscessos. Em pacientes pós-operatórios, o controle da fonte é muito provavelmente realizado pela radiologia intervencionista. No entanto, em face de coleções inacessíveis ou de uma assepsia intra-abdominal descontrolada, uma operação pode ser inevitável. Os antibióticos empiricintra venosos de amplo espectro não devem ser usados rotineiramente para tratar ECF, a menos que haja evidência de coleções intra-abdominais ou infecção da ferida com uma celulite associada. Sempre que possível, os antibióticos devem ser direcionados para dados específicos de cultura e limitados a mais de 2 semanas.
Administração de efluentes
Administração de efluentes de sucesso pode ter um impacto significativo no status de volume, equilíbrio eletrolítico, nutrição e integridade da pele.O uso de inibidores de bomba de prótons pode atingir ambos os objetivos e a dose deve ser titulada até que o pH do efluente seja superior a 6 e o volume de saída seja inferior a 1L/dia. Embora o psílio possa ser extremamente útil no volume do efluente e no aumento do tempo de trânsito, a antimotilidade e os agentes anti-secretores, incluindo loperamida, atropinafenoxilato, codeína, tintura de ópio e até metadona, são os principais fatores de redução de volume. Dado o seu papel como inibidor do hormônio universal gastrintestinal, uma grande quantidade de pesquisas tem sido gasta estudando os efeitos da somatostatina exógena em pacientes com ECF. Apesar de um número significativo de ensaios controlados aleatorizados, conclusões significativas são difíceis de elucidar sobre o tamanho secundário da amostra pequena e sobre o desenho inconsistente do estudo. Octreotide, um somatostato análogo de longa duração, também tem sido investigado como um ECFadjunct com resultados promissores. Octreotídeo 100 mcg três vezes ao dia pode reduzir o volume de efluentes e tem demonstrado diminuir o tempo de fechamento espontâneo em alguns estudos . Como tal, um estudo de terapia com octreotídeos por 72 h com monitoramento da saída da fístula fechada pode ser justificado, particularmente nos casos em que outras terapias falharam em diminuir o volume de saída. Os efeitos colaterais comuns incluem hiperglicemia, dores de cabeça e colelitíase.
Embora os dados sejam claros que fístulas de baixo débito têm uma taxa aumentada de fechamento espontâneo, é menos claro que a diminuição do volume do débito melhorará o fechamento da fístula. No entanto, a diminuição do volume de saída pode aliviar significativamente a carga do tratamento da fístula e impactar positivamente o bem-estar do paciente.
>
Cuidado da ferida
Talvez um dos aspectos mais desafiadores e exigentes do tratamento de ECF seja o controle local dos efluentes. Sucessentenário podemos rapidamente quebrar a pele e causar irritação, o que é difícil de tratar. Como tal, o gerenciamento apropriado da pele com cremes mais resistentes, barreiras de hidratação, aparelhos de aplicação e dispositivos de sucção são de suma importância. Fístulas de alto rendimento, em particular, muitas vezes requerem uma rede intrincada de drenos, bolsas e sucção para controlar adequadamente os efluentes. Equipas de tratamento de feridas altamente especializadas e terapeutasenterostomais são inestimáveis tanto para o tratamento de feridas como para o conforto do doente. Com o uso ubíquo da terapia de pressão negativa (TNP) para o tratamento de feridas e abdómen aberto, não é surpreendente que a TNP se tenha tornado parte do armamentário cirúrgico para lidar com oECF. Na maior série até o momento, Wainstein et al. relataram a experiência com 91 pacientes com fístulas de alto débito tratados com pressão negativa variando de -350 a -600 mmHg. Além disso, a redução significativa do débito de efluentes de uma média de 1400 cc/dia para 138 cc/dia foi alcançada em 46% dos pacientes. Em 2016, Misky et al. publicaram uma meta-análise investigando o uso do TNP no ECF. Utilizando dez estudos retrospectivos com um total de 151 pacientes, esses autores constataram que a mediana da taxa de fechamento espontâneo foi de 65% (variando de 7%-100%) com mediana de tempo até o fechamento de 58 dias. Estes investigadores também relataram uma nova taxa de fístula de 4,4% – uma complicação conhecida que tem dado a alguns profissionais uma pausa.Embora seja claramente necessária mais investigação para determinar se o NPT pode melhorar definitivamente as taxas de fechamento ECF ou diminuir o tempo de fechamento espontâneo, os benefícios positivos desses curativos não devem ser negligenciados. No mínimo, esta tecnologia pode facilitar a gestão do ECF, controlando os efluentes, protegendo a pele e diminuindo a frequência das trocas de curativos.
Tabela 3

| Investigadores | Prática Institucional |
|---|---|
| Hollington | 8 Meses |
| Evenson | 4 Meses |
| Rahbour | 12 Meses |
| Datta | >6 Meses |
| Lynch | 6 Meses |
| Li | 6 Meses |
| Cintyre | 6 Meses |
Tabela 3: Tempo para a Gestão Definitiva.
Tabela 3
Tempo para o Maneio Definitivo.
Nutrição
Avaliação O estado nutricional de um paciente ECF é de paramountimportância. Antes do advento das fórmulas enterais baseadas em peptídeos e nutrição parenteral total (TPN), séries históricas retrospectivas realçam a carga da desnutrição em pacientes ECF. Em uma série de157 pacientes nas décadas de 1950 e 1960, quase 75% dos pacientes com fístulas proximais estavam desnutridos. Resultados similares foram relatados porChapman et al. que constataram que apenas uma pequena minoria de pacientes tinha nutrição ótima; e que uma vez que a nutrição foi melhorada, a mortalidade relacionada ao ECF caiu de 55% para 12-16%.
Uma avaliação nutricional completa deve ser feita em todos os pacientes com ECF. Embora a equação de Harris-Benedict forneça um bom ponto de partida para o cálculo das necessidades nutricionais, é amplamente aceito que pacientes com ECF são catabólicos e hiper metabólicos. Em geral, estes pacientes requerem maior suporte calórico com pelo menos 25-30 kcal/kg/dia em carboidratos e gordura e 1,5 a 2 gramas de proteína/kg/dia .
O estado nutricional e o progresso devem ser reavaliados com base regular. Além dos pesos diários, laboratórios de nutrição regulares como,albumina, préalbum in, transferência e PCR devem ser seguidos. A albumina pré-operatória, em particular, demonstrou ser o preditor mais forte de mortalidade e morbidade após cirurgia geral e hipoalbuminemia continua sendo um preditor significativo de maus resultados em pacientes com ECF. Talvez a proteína mais estudada no ECF, no entanto, seja a transferrina e níveis superiores a 140 têm sido associados ao aumento das taxas de fechamento espontâneo e à redução da mortalidade. Embora o equilíbrio de nitrogênio possa ser uma ferramenta útil, esta medida padrão pode ser difícil em pacientes com fístulas de alto rendimento. Testes adicionais como a calorimetria indireta podem ser considerados em casos mais complexos que não respondem aos cuidados padrão.
Nutrição parenteral vs. nutrição enteral
A nutrição parenteral tem desempenhado um papel crítico na gestão do ECF, com seu uso sendo firmemente estabelecido por Dudrick em 1969.Em seu artigo sentinela descrevendo o manejo ideal do TPN,Dudrick concluiu que: “com o uso exclusivo da hiperalimentação parenteral, ganho de peso, equilíbrio positivo de nitrogênio, crescimento e desenvolvimento alcançados regularmente” . Desde então, a TPN tem sido universalmente adotada como um meio de proporcionar nutrição enquanto promove o “descanso intestinal” e simplifica o manejo dos efluentes. Enquanto a TPN reduz as secreções gastrointestinais em 30%-50%, reduzindo assim a incidência de desidratação e desequilíbrios eletrolíticos, existem estudos areno randomizados que abordam o impacto da TPN na conversão anabólica, taxas de fechamento espontâneo ou mortalidade. No entanto, a NTP continua sendo uma modalidade de tratamento popular a longo prazo, apesar das complicações graves, incluindo infecção e disfunção hepática.
Mais recentemente, entretanto, o uso da nutrição enteral no ECF vem ganhando força. O uso da nutrição enteral tem uma série de benefícios, incluindo redução do custo, menos infecções e melhora da função imunológica quando comparado com a TPN. Além disso, mesmo fornecendo tão pouco quanto 20% de calorias através de uma via enteral pode ajudar a manter a flora intestinal e diminuir a translocação bacteriana .
As séries Severais relataram um sucesso surpreendente com a alimentação enteral em pacientes com ECF. Em uma série retrospectiva de Li et al. 86,4% de 1168 pacientes foram tratados efetivamente com suporte enteral. A nutrição enteral pode até mesmo ser usada com sucesso no estabelecimento de fístulas de alto débito quando combinada com fórmulas elementares, agentes antimotilidade e agentes de volume de fibras. Na série de 335 pacientes com fístulas de alto débito, Levy et al. foram capazes de alcançar com sucesso a independência de TPN em 85% de sua coorte utilizando alimentação enteral. Curiosamente, apesar da nutrição enteral e da falta de “repouso intestinal”, a mortalidade e taxas de fechamento espontâneo foram semelhantes às séries anteriores.
No cenário de um ECF de alto débito com uma mucocutaneouslimb distal, a fistuloclise pode ser um importante coadjuvante à alimentação enteral padrão. A prática da fistuloclise se originou da prática de alimentação por quimio em recém-nascidos e pode se referir tanto à alimentação por via de um cateter colocado no membro distal de um ECF, como à alimentação por via de um tubo enteral adicional. Teubner et al. descreveram pela primeira vez a fistuloclicose como uma terapia para ECF em 2004 em uma série de casos de doze pacientes com fístulas proximais. Desde então, vários relatos de casos e pequenas séries têm demonstrado a eficácia nutricional do tistechnique. Quando comparados a uma coorte compatível de pacientes que receberam TEN sem fistuloclise, pacientes com fistulastos de alto rendimento tratados com fistuloclise melhoraram significativamente a função hepática e os parâmetros nutricionais. A fistuloclise pode ser particularmente útil em doentes que desenvolvem complicações relacionadas com a TPN, incluindo infecções, problemas de acesso venoso ou insuficiência hepática. A complicação pode ocorrer e pode incluir obstrução se a peristálticatividade do intestino delgado avançar o cateter de fístula distalmente para o intestino delgado.
Vitaminas e minerais são frequentemente esgotados em pacientes com ECF.Deficiências em vitaminas lipossolúveis são comuns, enquanto deficiências em vitaminas hidrossolúveis são raras a menos que a fístula esteja dentro do jejuno proximal. Além disso, como a vitamina B12 só é absorvida no terminal 50 a 60 cm do íleo, a vitamina B12 injetável pode ser necessária em muitos pacientes com ECF. O magnésio é frequentemente desperdiçado em fístulas de alto débito e deve estar repleto de sulfato de magnésio intravenoso ou cloreto de magnésio oral para melhor absorção enteral. Finalmente, uma dose elevada de zinco e vitamina C tem sido recomendada. Embora Omega-3 e óleo de peixe tenham sido estudados em terapia intensiva com algum benefício, estes suplementos nunca foram avaliados em pacientes com ECF e são usados de forma não rotineira .
Operative considerations
A taxa de fechamento espontâneo de ECF varia entre 15 e 75% na literatura. Esta ampla gama de taxas de fechamento provavelmente reflete diferenças nas populações de pacientes e nos padrões de prática institucional. As fístulas são significativamente menos propensas a fechar espontaneamente após 4 semanas, com apenas 10% das fístulas fechando após dois meses . Como as taxas de fechamento espontâneo de ECF são baixas, a intervenção cirúrgica é freqüentemente a única estratégia de gestão definitiva.
A decisão de operar um ECF, no entanto, não deve ser tomada de forma leve, pois as taxas de recorrência após o fechamento do ECF variam de 13 a 34% . Embora os princípios de intervenção cirúrgica para ECF envolvam muitos dos princípios centrais da cirurgia geral, o tempo para a operação é talvez o fator mais importante a ser considerado. Fazioet al demonstrou a importância do manejo expectante no tratamento de pacientes com ECF. Quando a cirurgia ocorreu menos de 6 semanas após o tempo de formação do ECF, a mortalidade ultrapassou 20%. No entanto, ao atrasar a cirurgia mais de 6 semanas, a mortalidade diminuiu para 11%. Além disso, a operação precoce possivelmente resulta em aumento do risco de recidiva. Em uma série de Lynch et al., pacientes operados entre 2 e 12 semanas de formação de ECF tiveram uma taxa de recorrência de 28%, enquanto que um atraso superior a 12 semanas diminuiu esta taxa para 15%. A Tabela 3 mostra o tempo de espera antes de se considerar a intervenção cirúrgica para um ECF não cicatrizado, sugerindo que o tratamento cirúrgico deve ser realizado apenas com o investimento total e compreensão do paciente e do cirurgião. ECF são casos longos, tecnicamente desafiadores, com risco de complicações significativas. As operações muitas vezes requerem a completa mobilização do intestino desde o ligamento de Treitz até o reto. Dado que 36% das fístulas recorrentes são o resultado de lesões que criam a operação de fechamento do ECF, grande cuidado deve ser tomado através da lise das aderências para evitar qualquer lesão inadvertida no intestino saudável. O manejo do intestino fistuloso deve sempre fazer uma ressecção intestinal e uma asteromose primária. A sobre costura ou ressecção da fístula resulta invariavelmente em maior recorrência (36% vs. 16%) .
Conclusão
Entero fístula cutânea é uma das complicações mais desafiadoras para o cirurgião geral. A utilização de uma abordagem cuidadosa, sistemática e centrada no paciente irá ajudar a maximizar os resultados clínicos de sucesso. Apesar da consistência dos princípios do manejo do ECF entre os pacientes, cada fístula é única e seu manejo é definido em grande parte pelo seu resultado, bem como pela sua localização e co-morbidades do paciente. Embora os cirurgiões e os pacientes possam ter um forte desejo de sucesso com o fechamento cirúrgico, os pacientes são melhor atendidos por pelo menos 6 meses de tratamento não cirúrgico. Em última análise, o atendimento a longo prazo dos pacientes com ECF requer, muitas vezes multidisciplinarmente coordenado pelo cirurgião.
- Hollington P, Mawdsley J, Lim W, Gabe SM, Forbes A, Windsor AJ. Uma experiência de 11 anos de fístula enterocutânea. Br J Surg. 2004; 91:1646-51.
- Li J, Ren J, Zhu W, Yin L, Han J. Gestão de fístulas enterocutâneas: 30 anos de experiência clínica. Chin Med J (Engl). 2003;116:171-5.
- McIntyre PB, Ritchie JK, Hawley PR, Bartram CI, Lennard-Jones JE. Gestão de fístulas enterocutâneas: Uma revisão de 132 casos. Br J Surg. 1984;71:293-6.
- Soeters PB, Ebeid AM, Fischer JE. Revisão de 404 pacientes com fístulas gastrointestinais. Impacto da nutrição parenteral. Ann Surg. 1979;190:189-202.
- Rahbour G, Gabe SM, Ullah MR, Thomas GP, Al-Hassi HO, Yassin NA, et al. Sete anos de experiência em fístulas enterocutâneas com análise univariada e multivariada de fatores associados à cicatrização: desenvolvimento de um sistema de pontuação validado. Dis. colorretal. 2013;15:1162-70.
- Gonzalez-Pinto I, Gonzalez EM. Otimização do tratamento das fístulas gastrointestinais superiores. Estômago. 2001;49 Suppl 4:iv22-31.
- Lloyd DA, Gabe SM, Windsor AC. Nutrição e tratamento de fístulas enterocutâneas. Br J Surg. 2006;93:1045-55.
- Berry SM, Fischer JE. Classificação e fisiopatologia das fístulas enterocutâneas. Surg Clin North Am. 1996;76:1009-18.
- Fischer JE. A fisiopatologia das fístulas enterocutâneas. World J Surg. 1983;7:446-50.
- Draus JM, Jr., Huss SA, Harty NJ, Cheadle WG, Larson GM. Fístula enterocutânea: os tratamentos estão a melhorar? Cirurgia. 2006;140:570-6.
- Martinez JL, Luque-de-Leon E, Mier J, Blanco-Benavides R, Robledo F. Manejo sistemático das fístulas enterocutâneas pós-operatórias: fatores relacionados aos resultados. World J Surg. 2008;3:436-43.
- Misky A, Hotouras A, Ribas Y, Ramar S, Bhan C. Uma revisão sistemática da literatura sobre o uso do fechamento assistido a vácuo para fístulas enterocutâneas. Dis. colorretal. 2016;18:846-51.
- Campos AC, Andrade DF, Campos GM, Matias JE, Coelho JC. Um modelo multivariado para determinar fatores prognósticos em fístulas gastrointestinais. J Am Coll Surg. 1999;188:483-90.
- Levy E, Frileux P, Cugnenc PH, Honiger J, Ollivier JM, Parc R. Fístulas externas de alto rendimento do intestino delgado: manejo com nutrição enteral contínua. Br J Surg. 1989;76:676-9.
- Lundy JB, Fischer JE. Perspectivas históricas no atendimento de pacientes com fístula enterocutânea. Clin Colon Rectal Surg. 2010;23:133-41.
- Bleier JI, Hedrick T. Suporte metabólico do paciente com fístula enterocutânea. Clin Colon Rectal Surg. 2010;23:142-8.
- Teixeira PGR, Inaba K, Dubose J, Salim A, Brown C, Rhee P, et al. Fístula enterocutânea complicando a laparotomia traumática: Uma grande carga de recursos. Am Surg. 2009;75:30-2.
- Irving M, White R, Tresadern J. Três anos de experiência com uma unidade de insuficiência intestinal. Ann R Coll Surg Engl. 1985;67:2-5.
- Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. Fístulas entéricas: princípios de gestão. J Am Coll Surg. 2009;209:484-91.
- Gribovskaja-Rupp I, Melton GB. Fístula Enterocutânea: Estratégias Comprovadas e Atualizações. Clin Colon Rectal Surg. 2016;29:130-7.
- McNaughton V, Canadian Association for Enterostomal Therapy ECFBPRP, Brown J, Hoeflok J, Martins L, McNaughton V, et al. Resumo das recomendações de melhores práticas para o manejo de fístulas enterocutâneas da Associação Canadense de Terapia Enterostomal ECF Painel de Recomendações de Melhores Práticas. J Wound Ostomy Continence Nurs. 2010;37:173-84.
- Evenson AR, Fischer JE. Gerenciamento atual da fístula enterocutânea. Journal of gastrointestinal surgery: revista oficial da Society for Surgery of the Alimentary Tract. 2006;10:455-64.
- Chapman R, Foran R, Dunphy JE. Gestão de Fístulas Intestinais. Am J Surg. 1964;108:157-64.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Critérios de Cuidados Médicos. 2013;41:580-637.
- Hesse U, Ysebaert D, de Hemptinne B. Role of somatostatin-14 and its analogues in the management of gastrointestinal fistulae: clinical data. Estômago. 2001;49:iv11-21.
- Wainstein DE, Fernandez E, Gonzalez D, Chara O, Berkowski D. Tratamento de fístulas enterocutâneas de alto rendimento com um dispositivo de compressão a vácuo. Uma experiência de dez anos. Mundo J Surg. 2008;32:430-5.
- Edmunds LH, Jr., Williams GM, Welch CE. Fístulas externas provenientes do trato gastrointestinal. Ann Surg. 1960;152:445-71.
- Polk TM, Schwab CW. Suporte metabólico e nutricional do paciente com fístula enterocutânea: uma abordagem trifásica. World J Surg. 2012;36:524-33.
- Gibbs J, Cull W, Henderson W, Daley J, Hur K, Khuri SF. Nível de albumina sérica pré-operatória como preditor de mortalidade e morbidade operatória: resultados do National VA Surgical Risk Study. Arco Cirúrgico. 1999;134:36-42.
- Martinez JL, Luque-de-Leon E, Ballinas-Oseguera G, Mendez JD, Juarez-Oropeza MA, Roman-Ramos R. Fatores preditivos de recidiva e mortalidade após correção cirúrgica da fístula enterocutânea. Journal of gastrointestinal surgery : revista oficial da Society for Surgery of the Alimentary Tract. 2012;16:156-63; 63-4.
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE. A alimentação intravenosa como único meio de nutrição pode apoiar o crescimento da criança e restaurar a perda de peso em um adulto? Uma resposta afirmativa. Ann Surg. 1969;169:974-84.
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. Enteral versus parenteral nutrition in critically ill patients: an updated systematic review and meta-analysis of randomized controlled trials. Critérios de Cuidados. 2016;20:117.
- Teubner A, Morrison K, Ravishankar HR, Anderson ID, Scott NA, Carlson GL. A fistuloclise pode substituir com sucesso a alimentação parenteral no suporte nutricional de pacientes com fístula enterocutânea. British Journal of Surgery. 2004;91:625-31.
- Ham M, Horton K, Kaunitz J. Fistuloclysis: relato de caso e revisão de literatura. Clínica Nutr Pract. 2007;22:553-7.
- Wu Y, Ren J, Wang G, Zhou B, Ding C, Gu G, et al. Fistuloclysis melhora a função hepática e o estado nutricional em pacientes com fístula entérica superior de alto rendimento. Prática de Res. Gastroenterol. 2014;2014.
- Schecter WP. Gestão de fístulas enterocutâneas. Surg Clin North Am. 2011;91:481-91.
- Haffejee AA. Manejo cirúrgico de fístulas enterocutâneas de alto rendimento: uma experiência de 24 anos. Currículo Opinião Clin Nutr Metab Care. 2004;7:309-16.
- Ross H. Cirurgia operatória da fístula enterocutânea. Clin Colon Rectal Surg. 2010;23:190-4.
- Lynch AC, Delaney CP, Senagore AJ, Connor JT, Remzi FH, Fazio VW. Resultado clínico e fatores preditivos de recidiva após cirurgia de fístula enterocutânea. Ann Surg. 2004;240:825-31.
- Runstrom B, Hallbook O, Nystrom PO, Sjodahl R, Olaison G. Resultado de 132 operações reconstrutivas consecutivas para fístula intestinal – operação estagiada sem anastomose primária – melhor resultado em análise retrospectiva. Scand J Surg. 2013;102:152-7.
- Reber HA, Roberts C, Way LW, Dunphy JE. Gestão de fístulas gastrointestinais externas. Ann Surg. 1978;188:460-7.