No braço celular mediado da resposta imune adaptativa, os peptídeos curtos são ligados pelo complexo de histocompatibilidade major (MHC) moléculas classe I e classe II e apresentados na superfície celular onde são reconhecidos pelos receptores de antígenos dos linfócitos T. A ligação de um receptor de células T (TCR) que reconhece um determinado complexo de peptídeo MHC induz os linfócitos ingénuos a diferenciarem-se em células effector (células T citotóxicas e helper) que destroem células hospedeiras infectadas ou estimulam a produção de anticorpos, e células de memória que fornecem imunidade protectora contra a reinfecção.
Estrutura e função das moléculas de MHC
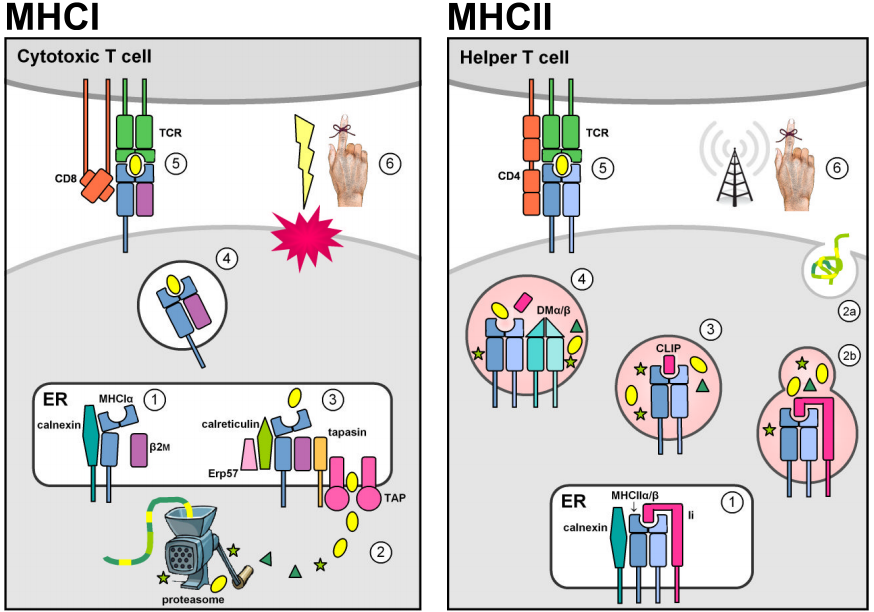
Duas famílias multigenes localizadas dentro da região genómica de MHC codificam moléculas ligadoras de antigénios que apresentam peptídeos estranhos na superfície celular. Na realidade, as moléculas de MHC também apresentam peptídeos auto-derivados. No entanto, a seleção tímica negativa contra as células T autoreativas impede que os complexos de MHC de autopeptídeos eliciem uma resposta imunológica. As moléculas de MHC classe I são expressas na maioria das células nucleadas e tipicamente apresentam peptídeos endógenos derivados de patógenos intracelulares que se replicam dentro do citosol (por exemplo, vírus). As proteínas citosólicas são degradadas em fragmentos curtos de peptídeo pelo proteasoma, e são primeiro transportadas para o retículo endoplasmático (ER) pelos transportadores dependentes de ATP TAP1 & 2 para carga de MHCI, e depois para a superfície celular para apresentação às células CD8+ T citotóxicas circulantes, cuja função é induzir apoptose e lise da célula alvo infectada. (As figuras são adaptadas de Murphy et al. (2008) Figs. 3.12, 3.25, 5.5, & 5.11.)
Expressão constitucional de loci MHC classe II é restrita às células apresentadoras de antígenos do sistema imunológico (APCs, por exemplo, macrófagos, células dendríticas e linfócitos B). As moléculas de MHCII são estabilizadas e impedidas de ligar o antígeno enquanto residentes no ER através da associação com a cadeia invariante classe II (Ii, ou CD74), e são então redirecionadas da via secreta padrão para a via endocítica. Lá, eles encontram peptídeos derivados de patógenos que se replicam dentro das vesículas intracelulares ou de patógenos e proteínas extracelulares que são transportados para a célula. A ligação estável dos peptídeos é catalisada pelo MHCII não clássico DMα/β dimer, e permite que os complexos de peptídeos do MHCII escapem da via endocítica para apresentação na superfície celular. O reconhecimento pelas células CD4+ T ativa a célula hospedeira alvo para estimular mecanismos antibacterianos (em macrófagos) ou para desencadear a produção de anticorpos e a resposta imune humoral.
Similitudes estruturais das moléculas MHCI e MHCII provavelmente refletem sua descendência de um ancestral comum. As moléculas maduras de MHC são glicoproteínas de membrana integral tipo I compostas por um sulco de ligação de peptídeos e domínios semelhantes à imunoglobulina, transmembrana e citoplasmática. As porções extracelulares das moléculas de MHC consistem em dois domínios membrano-distalinos que juntos formam uma cavidade de ligação do peptídeo que é delimitada por duas hélices interrompidas α descansando sobre uma folha antiparalela β, e dois domínios imunoglobulínicos tipo Ig- que participam da ligação do coreceptor CD4 e CD8.
Embora estas semelhanças estruturais, as subunidades proteicas são codificadas de forma diferente para as moléculas das classes I e II. As moléculas MHCI são heterodímeros formados por associação não-vigalente entre uma cadeia pesada MHCIα e β2-microglobulina (β2m), que é codificada por um locus amplamente invariante situado fora da região genômica MHC. A cadeia pesada contribui tanto para a fenda de ligação do peptídeo como para um dos domínios semelhantes a Ig-, enquanto β2m fornece apenas uma segunda região semelhante a Ig- que carece de uma âncora transmembrana. Moléculas MHC classe II são heterodímeros que são formados pela associação nãocovalente de uma cadeia α e β, ambos contribuem com um único domínio tipo Ig- ligado ao peptídeo e ancorado à membrana, e cada um deles é transcrito de um locus distinto tipicamente encontrado dentro da região MHC.
MHC membros da família de genes podem ser subdivididos em loci clássico ou não-clássico, além de pseudogenes não-funcionais. Os Ia loci MHC clássicos são amplamente expressos e estão tipicamente associados com alta variabilidade de seqüência e seleção positiva atuando em substituições nos resíduos da região de ligação do peptídeo (PBR). Os MHC Ib loci não clássicos têm expressão reduzida ou distribuição limitada do tecido, menor polimorfismo, e podem ter funções restritas ou modificadas. Para genes da classe II, “clássico” tipicamente se refere a todos os loci que apresentam antígenos, enquanto o termo “não-clássico” é reservado para genes como DMα/β que servem papéis acessórios na via de apresentação de antígenos. Embora esta categorização funcional dos membros da família genética forneça um vocabulário de trabalho útil, a fronteira entre os loci clássicos e não-clássicos nem sempre é clara na prática e alguns loci MHCI não-clássicos são polimórficos, amplamente expressos, ou ligantes peptídeos de ligação na forma tradicional dos genes clássicos.
Polimorfismo extremo em nível populacional e evidências de seleção balanceada indicam que uma variação alélica substancial dos genes MHC é provavelmente necessária para reconhecer e responder a uma assemblagem diversa de patógenos. Entretanto, apesar da extensa duplicação de genes em algumas espécies, os indivíduos tipicamente expressam apenas um número moderado de loci MHC clássicos e a reversão para herança disômica também é observada em algumas espécies de Xenopus poliplóides. Acredita-se que as restrições à variação intra-individual dos MHC (pelo menos para loci clássicos altamente expressos) reflitam um tradeoff funcional entre aumentar o repertório alélico para apresentar uma maior variedade de peptídeos patogênicos contra a redução do repertório de células T que seria necessária para manter a auto-tolerância. As moléculas individuais de MHC devem, portanto, ser capazes de ligação permissiva do peptídeo para reconhecer adequadamente uma ampla gama de antígenos estranhos. Entretanto, há também a necessidade de gerar complexos estáveis de peptídeos MHC que persistirão por tempo suficiente para permitir o reconhecimento das células T e que não trocarão peptídeos na superfície celular, o que poderia resultar na destruição de células não infectadas. Tal estabilidade está geralmente associada a alta afinidade e, portanto, a interações intermoleculares restritivas.
As moléculas de MHC conciliam esses requisitos de ligação concorrentes através de uma solução estrutural elegante: contatos entre resíduos altamente conservados da região de ligação do peptídeo (PBR) da molécula MHC e átomos da cadeia principal do peptídeo estabilizam a ligação promíscua da maioria dos ligandos peptídeos, enquanto resíduos polimórficos que revestem a ranhura de ligação do peptídeo criam bolsas irregulares com estereoquímica diferente que acomodam os resíduos do peptídeo de uma maneira dependente da seqüência. As restrições impostas pelas bolsas de ligação lateral variam tanto entre alelos como entre bolsas dentro de uma única molécula de MHC. Diz-se que os bolsos que impõem requisitos de ligação mais rigorosos acomodam resíduos de peptídeo “âncora primária”, enquanto que as “âncoras secundárias” são mais flexíveis nas suas preferências de ligação. Juntas, essas especificidades determinam o motivo de ligação do peptídeo de um determinado alelo MHC para conferir seletividade na apresentação do antígeno.