Nome genérico: naftifine hydrochloride
Forma de dosagem: gel
Revisado medicamente por Drugs.com. Última actualização em 1 de Abril de 2020.
- Visão geral
- Efeitos secundários
- Dosagem
- Profissional
- Gravidez
- Outros
- Indicações e Uso para Naftin Gel
- Naftin Gel Dosagem e Administração
- Dosagem Formas e Forças
- Contraindicações
- Avencimentos e Precauções
- Reacções adversas locais
- Reações Adversas
- Experiência de Ensaios Clínicos
- Postmarketing Experience
- USO EM POPULAÇÕES ESPECÍFICAS
- Gravidez
- Lactação
- O uso pediátrico
- Uso Geriátrico
- Naftin Gel Descrição
- Naftin Gel – Farmacologia Clínica
- Mecanismo de Acção
- Farmacodinâmica
- Farmacocinética
- Microbiologia
- Toxicologia não-clínica
- Carcinogénese, Mutagénese, Imparidade da Fertilidade
- Estudos Clínicos
- Como Fornecido/Armazenamento e Manuseio
- Informação de Aconselhamento Paciente
- PRINCIPAL DISPLAY PANEL – 45g Caixa de 45g de tubo
- PANEL DE DISPLAY PRINCIPAL – 60 g Caixa Tubo
- Mais sobre Naftin (naftifine tópico)
- Recursos de consumo
- Recursos profissionais
- Outras formulações
- Guias de tratamento relacionadas
Indicações e Uso para Naftin Gel
NAFTIN ® Gel é um antifúngico de alilamina indicado para o tratamento de tinea pedis interdigital causado pelos organismos Trichophyton rubrum, Trichophyton mentagrophytes, e Epidermophyton floccosum.
Naftin Gel Dosagem e Administração
Aplique uma camada fina de NAFTIN ® Gel uma vez por dia nas áreas afectadas mais uma margem aproximada de ½ polegadas de pele saudável circundante durante 2 semanas.
Apenas para uso tópico. NAFTIN ® Gel não é para uso oftalmológico, oral ou intravaginal.
Dosagem Formas e Forças
Gel, 2%. Cada grama contém 20 mg de cloridrato de naftifina num gel incolor a amarelo.
Contraindicações
Nenhum.
Avencimentos e Precauções
Reacções adversas locais
Se a irritação ou sensibilidade se desenvolver com o uso de NAFTIN® Gel, o tratamento deve ser interrompido.
Reações Adversas
Experiência de Ensaios Clínicos
Porque os ensaios clínicos são realizados sob condições muito variáveis, as taxas de reação adversa observadas nos ensaios clínicos de um medicamento não podem ser diretamente comparadas às taxas observadas nos ensaios clínicos de outro medicamento e podem não refletir as taxas observadas na prática clínica.
Em dois ensaios aleatórios, controlados por veículo, 1143 sujeitos foram tratados com NAFTIN ® Gel versus 571 sujeitos tratados com o veículo. Os sujeitos do estudo tinham de 12 a 92 anos de idade, eram principalmente do sexo masculino (76%), e eram 59% caucasianos, 38% negros ou afro-americanos, e 23% hispânicos ou latinos. Os sujeitos receberam doses diárias, topicamente, durante 2 semanas, para cobrir as áreas afetadas da pele, mais uma margem de ½ – polegada de pele saudável ao redor. As reacções adversas mais comuns foram as reacções no local de aplicação que ocorreram à taxa de 2% no braço do Naftin Gel contra 1% no braço do veículo. A maioria das reações adversas foi de gravidade leve.
Em um ensaio de farmacocinética e segurança pediátrica de marca aberta 22 sujeitos pediátricos de 12-17 anos de idade com tinea pedis interdigital receberam NAFTIN® Gel. A incidência de reações adversas na população pediátrica foi semelhante à observada na população adulta.
Testes de irritação cumulativos revelaram o potencial do NAFTIN® Gel causar irritação. Não houve evidências de que NAFTIN® Gel cause sensibilização de contato, fototoxicidade ou fotoalergenicidade em pele saudável.
Postmarketing Experience
Porque essas reações são relatadas voluntariamente a partir de uma população de tamanho incerto, nem sempre é possível estimar com confiabilidade sua freqüência ou estabelecer uma relação causal com a exposição a drogas. As seguintes reacções adversas foram identificadas durante o uso do cloridrato de naftifina após a aprovação: bolhas, sensação de ardor, crosta, secura, eritema/rede, inflamação, irritação, maceração, dor, prurido/cozimento, erupção cutânea e inchaço.
USO EM POPULAÇÕES ESPECÍFICAS
Gravidez
Resumo do risco
Não há dados disponíveis sobre o uso de NAFTIN® Gel em mulheres grávidas para avaliar o risco associado a drogas de defeitos congênitos maiores, aborto espontâneo ou desfechos maternos ou fetais adversos.
Em estudos de reprodução animal, não foram observados efeitos adversos no desenvolvimento embrionário em doses orais administradas durante o período de organogênese até 37 vezes a dose humana máxima recomendada (MRHD) em ratos grávidos ou doses subcutâneas administradas durante o período de organogênese até 4 vezes o MRHD em ratos grávidos ou 7 vezes o MRHD em coelhos grávidos ( ver Dados).
Todas as gestações têm um risco de defeito de nascença, perda ou outros desfechos adversos. O risco estimado de defeitos de nascença e aborto espontâneo para a população indicada é desconhecido. Na população geral dos EUA, o risco estimado de anomalias congênitas graves e aborto espontâneo em gestações clinicamente reconhecidas é de 2 a 4% e 15 a 20%, respectivamente.
Dados
Dados anormais
Estudos sistêmicos de desenvolvimento embrionário foram conduzidos em ratos e coelhos. Para a comparação de doses animais para humanos, o MRHD é fixado em 4 g de gel a 2% por dia (1,33 mg/kg/dia para um indivíduo de 60 kg).
Dose oral de 30, 100 e 300 mg/kg/dia de cloridrato de naftifina foram administrados durante o período de organogênese em ratos fêmeas grávidas. Não foram observados efeitos relacionados ao tratamento na toxicidade embrionária em doses de até 300 mg/kg/dia (37 vezes o MRHD baseado na comparação mg/m 2). Doses subcutâneas de 10 e 30 mg/kg/dia de cloridrato de naftifina foram administradas durante o período de organogênese a ratas fêmeas grávidas. Não foram observados efeitos relacionados ao tratamento sobre a toxicidade embrionária a 30 mg/kg/dia (4 vezes o MRHD com base na comparação mg/m 2). Doses subcutâneas de 3, 10 e 30 mg/kg/dia de cloridrato de naftifina foram administradas durante o período de organogênese a coelhas fêmeas grávidas. Não foram observados efeitos relacionados ao tratamento na toxicidade embrionária a 30 mg/kg/dia (7 vezes o MRHD baseado na comparação mg/m 2).
Um estudo de desenvolvimento peri- e pós-natal foi realizado em ratos. Doses orais de 30, 100 e 300 mg/kg/dia de cloridrato de naftifina foram administradas em ratos fêmeas desde o 14º dia gestacional até o 21º dia de lactação. O ganho de peso corporal reduzido das fêmeas durante a gestação e da prole durante a lactação foi observado em 300 mg/kg/dia (37 vezes o MRHD baseado na comparação mg/m 2). Não foi observada toxicidade de desenvolvimento a 100 mg/kg/dia (12 vezes o MRHD baseado na comparação mg/m 2).
Lactação
Resumo do risco
Não há informações disponíveis sobre a presença de cloridrato de naftifina no leite humano, os efeitos do medicamento no lactente amamentado, ou os efeitos do medicamento na produção de leite após aplicação tópica do Naftin Gel nas mulheres que estão amamentando. Não se sabe se o cloridrato de naftifina é excretado no leite humano. Como muitos medicamentos são excretados no leite humano, deve-se ter cuidado quando o cloridrato de naftifina é administrado a uma lactante.
A falta de dados clínicos durante a lactação impede uma determinação clara do risco do Naftin Gel para um bebé durante a lactação. Portanto, os benefícios de desenvolvimento e saúde do aleitamento materno devem ser considerados juntamente com a necessidade clínica da mãe de Naftin Gel e quaisquer potenciais efeitos adversos no bebé amamentado com Naftin Gel ou da condição materna subjacente.
O uso pediátrico
A segurança e eficácia do NAFTIN® Gel foi estabelecida na faixa etária dos 12 aos 18 anos de idade com tinea pedis interdigital.
O uso do Gel NAFTIN® nesta faixa etária é apoiado por evidências de ensaios adequados e bem controlados em adultos com segurança adicional e dados PK de um ensaio com rótulo aberto, realizado em 22 adolescentes ≥12 anos de idade que foram expostos ao Gel NAFTIN® numa dose de aproximadamente 4 g/dia .
Segurança e eficácia em pacientes pediátricos <12 anos de idade não foram estabelecidos.
Uso Geriátrico
Durante ensaios clínicos, 99 sujeitos (9%) com idade igual ou superior a 65 anos foram expostos ao Gel NAFTIN®. Segurança e eficácia foram semelhantes aos relatados por sujeitos mais jovens.
Naftin Gel Descrição
NAFTIN ® Gel é um gel transparente a amarelo apenas para uso tópico. Cada grama de NAFTIN ® Gel contém 20 mg de cloridrato de naftifina, um composto sintético de alilamina antifúngica.
Quimicamente, o HCl de naftifina é (E)-N-Cinamil-N-metil-1-naftalenemetilamina cloridrato.
A fórmula molecular é C 21H 21N∙HCl com um peso molecular de 323,86.
A fórmula estrutural do cloridrato de naftifina é :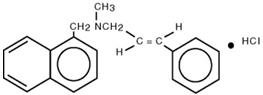
NAFTIN® Gel contém os seguintes ingredientes inativos: álcool, álcool benzílico, edetate dissódico, hidroxietilcelulose, água purificada, propilenoglicol, polissorbato 20 e trolamina.
Naftin Gel – Farmacologia Clínica
Mecanismo de Acção
NAFTIN ® Gel é um medicamento antifúngico tópico.
Farmacodinâmica
A farmacodinâmica do NAFTIN® Gel não foi estabelecida.
Farmacocinética
Estudos de biodisponibilidade in vitro e in vivo demonstraram que a naftifina penetra no estrato córneo em concentração suficiente para inibir o crescimento de dermatófitos.
Análise farmacocinética de amostras de plasma de 32 indivíduos com tinea pedis tratados com uma dose média de 3,9 gramas de NAFTIN ® Gel aplicado uma vez ao dia em ambos os pés durante 14 dias mostrou aumento da exposição ao longo do período de tratamento, com uma média geométrica (CV%) AUC 0-24 (área sob concentração plasmática versus curva tempo do tempo 0 a 24 horas) de 10,5 (118) ng∙hr/mL no dia 1 e uma AUC 0-24 de 70 (59) ng∙hr/mL no dia 14. A taxa de acumulação baseada na AUC foi de aproximadamente 6,
Concentração máxima (C max) também aumentou durante o período de tratamento; a média geométrica (CV%) C max após uma dose única foi de 0,9 (92) ng/mL no dia 1; C max no dia 14 foi de 3,7 (64) ng/mL. A média T máxima foi de 20,0 horas (variação: 8, 20 horas) após uma única aplicação no Dia 1 e 8,0 horas (variação: 0, 24 horas) no Dia 14. As concentrações de plasma aumentaram durante o período de ensaio e atingiram um estado estável após 11 dias. No mesmo ensaio farmacocinético a fração da dose excretada na urina durante o período de tratamento foi menor ou igual a 0,01% da dose aplicada.
Num segundo ensaio, a farmacocinética de NAFTIN® Gel foi avaliada em 22 sujeitos pediátricos de 12-17 anos de idade com tinea pedis. Os sujeitos foram tratados com uma dose média de 4,1 gramas de NAFTIN ® Gel aplicado na área afetada uma vez ao dia durante 14 dias. Os resultados mostraram que a exposição sistêmica aumentou ao longo do período de tratamento. A média geométrica (CV%) AUC0-24 foi de 15,9 (212) ng∙hr/mL no dia 1 e 60,0 (131) ng∙hr/mL no dia 14. A média geométrica (CV%) Cmax após dose única foi 1,40 (154) ng/mL no dia 1 e 3,81 (154) ng/mL no dia 14. A fração da dose excretada na urina durante o período de tratamento foi menor ou igual a 0,003% da dose aplicada.
Microbiologia
Mecanismo de Ação
Naftifina é um antifúngico que pertence à classe da alilamina. Embora o mecanismo exato de ação contra fungos não seja conhecido, o cloridrato de naftifina parece interferir na biossíntese do esterol, inibindo a enzima squalene 2, 3-epoxidase. A inibição da actividade enzimática por esta alilamina resulta numa diminuição da quantidade de esteróis, especialmente ergosterol, e numa acumulação correspondente de squalene nas células.
Mecanismo de resistência
Até à data, não foi identificado um mecanismo de resistência à naftifina.
Naftifina mostrou-se activa contra a maioria dos isolados dos seguintes fungos, tanto in vitro como nas infecções clínicas, conforme descrito na secção INDICAÇÕES E UTILIZAÇÃO:
- Tricofitão rubrum
- Tricofitão mentagrophytes
- Epidermophyton floccosum
Toxicologia não-clínica
Carcinogénese, Mutagénese, Imparidade da Fertilidade
Num estudo de 2 anos de carcinogenicidade dérmica, o creme de cloridrato de naftifina foi administrado a ratos Sprague-Dawley em doses tópicas de 1%, 2% e 3% (10, 20 e 30 mg/kg/dia de cloridrato de naftifina). Nenhum tumor relacionado a drogas foi observado neste estudo até a dose mais alta avaliada neste estudo de 30 mg/kg/dia (36 vezes o MRHD baseado na comparação AUC).
Cloridrato de naftifina não revelou evidência de potencial mutagênico ou clastogênico baseado nos resultados de dois testes de genotoxicidade in vitro (ensaio de Ames e ensaio de aberração cromossômica de células do ovário de hamster chinês) e um teste de genotoxicidade in vivo (ensaio de micronúcleo da medula óssea de camundongo).
Oral administração de cloridrato de naftifina a ratos, durante o acasalamento, gestação, parto e lactação, não demonstrou efeitos no crescimento, fertilidade ou reprodução, em doses até 100 mg/kg/dia (12 vezes o MRHD baseado na comparação mg/m 2).
Estudos Clínicos
NAFTIN ® Gel foi avaliado quanto à eficácia em dois ensaios randomizados, duplo-cegos, controlados por veículo, multicêntricos, que incluíram 1175 sujeitos com cultura interdigital sintomática e dermatófita – tinea pedis interdigital positiva. Os sujeitos foram aleatorizados para receber o Gel ou veículo NAFTIN®. Os sujeitos aplicaram 2% de gel de cloridrato de naftifina ou veículo na área afetada do pé uma vez por dia durante 2 semanas. Os sinais e sintomas da tinea pedis interdigital (presença ou ausência de eritema, prurido e escamação) foram avaliados e exame de hidróxido de potássio (KOH) e cultura de dermatófitos foram realizados 6 semanas após o primeiro tratamento.
A idade média da população do estudo foi de 45 anos; 77% eram homens; e 60% eram caucasianos, 35% eram negros ou afro-americanos, e 26% eram hispânicos ou latinos. Na linha de base, foram confirmados sinais e sintomas de tinea pedis interdigital, exame KOH positivo e cultura dermatófita confirmada. O desfecho primário de eficácia foi a proporção de indivíduos com cura completa às 6 semanas após o início do tratamento (4 semanas após o último tratamento). A cura completa foi definida como uma cura clínica (ausência de eritema, prurido e escamação) e micológica (KOH negativo e cultura dermatófita).
Os resultados da eficácia na semana 6, quatro semanas após o término do tratamento, são apresentados na Tabela 1 abaixo.
| Trial 1 | Trial 2 | |||
|---|---|---|---|---|
| Endpoint | NAFTIN ® Gel, 2% N=382 n (%) |
Veículo N=179 n (%) |
NAFTIN ® Gel, 2% N=400 n (%) |
Veículo N=213 n (%) |
| * A cura completa é um ponto final composto tanto da cura micológica como da cura clínica. A cura clínica é definida como a ausência de eritema, prurido e escamação (grau 0). † Tratamento eficaz é uma preparação negativa de KOH e cultura dermatófita negativa, eritema, escamação e prurido de grau 0 ou 1 (ausente ou quase ausente). ‡ A cura micológica é definida como KOH negativo e cultura dermatófita. | ||||
| Cura Completa * | 64 (17%) | 3 (2%) | 104 (26%) | 7 (3%) |
| Eficácia do tratamento † | 207 (54%) | 11 (6%) | 203 (51%) | 15 (7%) |
| Micológico Cura ‡ | 250 (65%) | 25 (14%) | 235 (59%) | 22 (10%) |
Como Fornecido/Armazenamento e Manuseio
Como Fornecido
NAFTIN ® Gel é um gel incolor a amarelo fornecido em tubos dobráveis do seguinte tamanho:
45g – NDC 54766-772-45
60g – NDC 54766-772-60
Armazenamento
Store NAFTIN ® Gel a 25°C (77°F); excursões permitidas até 15-30°C (59-86°F) .
Informação de Aconselhamento Paciente
- Informe os pacientes que o NAFTIN ® Gel é apenas para uso tópico. NAFTIN ® Gel não se destina a uso oftalmológico, oral ou intravaginal.
- Patientes devem ser orientados a entrar em contato com seu médico caso ocorra irritação com o uso de NAFTIN ® Gel.
Distribuído pela Sebela Pharmaceuticals Inc.
645 Hembree Parkway, Suite I, Roswell, GA 30076
www.sebelapharma.com
Toll Free 1-844-732-3521
©2020 Sebela Pharmaceuticals Inc. Todos os direitos reservados.
PRINCIPAL DISPLAY PANEL – 45g Caixa de 45g de tubo

NDC 54766-772-45
NAFTIN ®
(Naftifine Hydrochloride) Gel, 2%
Sebela Pharmaceuticals Inc.
Apenas para uso tópico
Não para Oftalmologia, Uso Oral ou Intravaginal
45g
Rx Apenas
PANEL DE DISPLAY PRINCIPAL – 60 g Caixa Tubo

NDC 54766-772-60
NAFTIN®
(Naftifine Hydrochloride) Gel, 2%
Sebela Pharmaceuticals Inc.
Apenas para uso tópico
Não para Oftalmologia, Uso Oral ou Intravaginal
60g
Rx Apenas
| NAFTIN gel de cloridrato de naftafina |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
Rotuladora – Sebela Pharmaceuticals Inc. (079104574)
| Estabelecimento | |||
| Nome | Endereço | ID/FEI | Operações |
| DPT Laboratórios, Ltd. | 832224526 | manufacture(54766-772), analysis(54766-772), label(54766-772) | |
Mais sobre Naftin (naftifine tópico)
- Efeitos secundários
- Durante a gravidez ou amamentação
- Dosagem Informações
- Preço & Cupões
- En Español
- 3 Revisões
- Disponibilidade genérica
- Classe de drogas: Antifúngicos tópicos
Recursos de consumo
- Informação de paciente
- Naftin Tópico (Leitura avançada)
Recursos profissionais
- Informação sobre a impressão
- Naftifina (Monografia AHFS)
Outras formulações
- Naftin-MP Tópico
Guias de tratamento relacionadas
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Relatação de Responsabilidade Médica