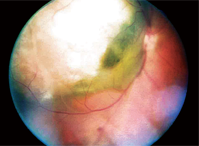
1. Uma fotografia de fundo do olho direito do nosso paciente.
Um recluso branco de 65 anos de idade apresentado numa clínica oftalmológica de uma instituição correcional estadual com uma queixa de “insetos” na visão do seu olho esquerdo. Isto estava a acontecer há cerca de três semanas; ele negou a fotopsia. A história sistêmica do paciente era significativa para hipertensão, problemas cardíacos (tendo tido duas substituições valvares) e diabetes tipo 2 que era controlado com medicamentos orais.
A sua história ocular foi significativa para cegueira “de longa data” de seu olho direito.
Perguntando mais sobre esta cegueira de longa data, soubemos que, 15 anos antes, o paciente tinha visto um especialista em retina, que lhe disse que ele tinha uma “sarda” no olho. Ele relatou que tinha perdido a visão no olho direito há cerca de 10 anos, mas não tinha visto um especialista desde essa visita há 15 anos.
Diagnóstico
Exame do componente, a acuidade visual do paciente era apenas a percepção de luz O.D., e 20/25 S.O. As pupilas mediam 4mm S.O. e 3mm S.O. e eram ambas redondas e reativas, com uma S.O. de defeito aferente 3+. A avaliação do segmento anterior foi notável para cataratas escleróticas nucleares. Realizamos um exame de fundo dilatado, e constatamos que a queixa principal do paciente era devido a um S.O. de descolamento vítreo posterior, que causava uma sinergia vítrea central e densa. Não encontramos rupturas de retina ou qualquer outra coisa de significado clínico naquele olho.
O exame do fundo do olho direito revelou uma grande lesão elevada, de aproximadamente 12 diâmetros de disco, estendendo-se de – e incluindo o disco óptico temporal, além da mácula temporal e além da arcada superior. Era de cor cinza-branca com o que parecia ser algum conteúdo fluido no aspecto inferior-nasal (figura 1).
Diagnóstico
Fizemos um diagnóstico provisório de melanoma coróide com descolamento seroso da retina, e o documentamos com fotos de fundo.
Tratamento e acompanhamento
Reencaminhamos o paciente para o oftalmologista da equipe da instituição para avaliação e tratamento posterior. Cerca de duas semanas depois, o oftalmologista viu-o e fez um angiograma com fluoresceína, bem como uma ecografia com A e B. Os relatórios de interpretação para estes procedimentos foram bastante rudimentares; eles afirmaram que as varreduras A e B revelaram uma “massa sólida”, e a fluoresceína mostrou que a massa foi preenchida com tintura cedo e depois desapareceu lentamente. Após estes estudos, o oftalmologista apresentou diferenciais de melanoma maligno ou degeneração macular discipulada. Ele encaminhou o paciente a um especialista em retina, que o viu poucos dias após sua consulta de oftalmologia.
O especialista em retina diagnosticou imediatamente um melanoma coróide e enviou o paciente a um especialista em oftalmologia naquele dia para discutir o tratamento. Os resultados dos testes diagnósticos do especialista em retina e do especialista em ocuplásticos não estavam disponíveis para nós no prontuário do paciente. Foi também encomendada uma tomografia abdominal com contraste e uma radiografia ao tórax.
O paciente e o especialista em ocuplásticos decidiu pelo tratamento com enucleação, e o paciente foi agendado para cirurgia na semana seguinte. A enucleação foi bem sucedida, porém, a paciente infelizmente teve dificuldades com a anestesia e morreu dois dias após a enucleação. A TC abdominal e as radiografias do tórax ainda não tinham sido concluídas.
Discussão
Melanomas coroidais são relativamente raros, com uma incidência de aproximadamente cinco a seis casos por milhão de pessoas, o que equivale a cerca de 1.400 casos por ano nos Estados Unidos.1,2 São encontrados principalmente em adultos (com o pico por volta dos 55 anos de idade), geralmente não são familiares e mostram uma leve predileção masculina para a maioria das faixas etárias.1,3,4 Ocorrem principalmente em pessoas de pele clara com irides azuis ou verdes, e raramente são encontrados em negros ou asiáticos.1,4
Os doentes com melanomas coróides são frequentemente assintomáticos, mas podem apresentar diminuição da visão, defeitos do campo visual, flutuadores, fototópsias ou, em raras ocasiões, dor.4,5 Se a dor ocorrer, geralmente é resultado de glaucoma secundário ou necrose tumoral; melanomas coroidais também podem causar dor por impacto nos nervos ciliares posteriores subjacentes, mas isso raramente ocorre.3,5
Estas lesões geralmente são elevadas e podem aparecer com manchas, marrom escuro, cinza escuro, cinza-verde ou amarelo (amelanótico).4-6 Elas podem assumir uma forma de cogumelo ou cúpula com vasos sanguíneos congestionados dentro do tumor – esta configuração representa os 20% de melanomas coróides que irrompem através da membrana de Bruch e do epitélio do pigmento retiniano (RPE).1,4,5
Melanomas coroidais freqüentemente apresentam uma elevação abrupta do coróide, fluido subretinal, pigmentação alaranjada sobre a superfície da lesão e crescimento ao longo do tempo.4 O fluido subretinal com resultado do descolamento da retina sérica subjacente resulta da quebra do RPE. Estes descolamentos serosos frequentemente mudam e podem parecer conter sangue se o tumor tiver atravessado a membrana de Bruch.5
A pigmentação alaranjada dominante é lipofuscina; este pigmento é composto por proteínas, lipídios e pequenos cromóforos e se acumula na RPE como resultado da degeneração celular e digestão incompleta dos segmentos externos fotorreceptores.6,7 A lipofuscina não é específica dos melanomas; também pode estar associada a nevos coroidais ou outros tumores coroidais benignos. Entretanto, a lipofuscina é muito mais comumente vista com melanomas do que com homólogos benignos.5
Outros possíveis sinais associados aos melanomas coróides incluem hemorragias vítreas ou células vítreas pigmentadas, drusen na superfície do tumor, membranas neovasculares coróides, ou mesmo proptose se o tumor invadir a órbita.4
Diagnósticos diferenciais
Há uma infinidade de diagnósticos diferenciais para melanomas coróides e melanóides coróides amelanóticos, que variam no prognóstico contínuo de gravidade.
– Os nevos coroidais são um diferencial importante. Eles são tumores melanocíticos benignos comuns e são encontrados em aproximadamente 2% a 6,5% da população branca.8-10 Os nevos geralmente são cinza ardósia e relativamente planos (menos de 2mm de espessura), embora haja sobreposição significativa de tamanho entre melanomas pequenos e nevos maiores.8,9 Como os melanomas coroidais, eles também podem apresentar drusen ou lipofuscina sobrepostos (figura 2). Estatisticamente, de cada 500 nevos coroidais, um sofrerá transformação maligna se seguido por 10 anos; a taxa anual estimada de transformação maligna é de um em 8.845,6,9
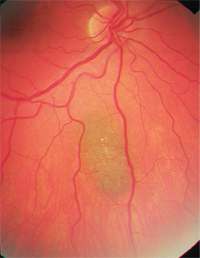
2. Nevus coroidais com drusen sobrepostos.
Existem múltiplos fatores de risco conhecidos para tal transformação (ver “Transformação Maligna”).4,8 O mais importante parece ser a espessura inicial do nevus superior a 2mm, mas um grande diâmetro de base (superior a 7mm) também sugere pré-malinhamento do nevus.8,9 A ausência de drusen é um bom indicador prognóstico.7
Onde os melanomas coroidais tendem a crescer relativamente rápido, os nevos coroidais podem aumentar lentamente ao longo de um período de vários anos, não indicando necessariamente transformação maligna. Tal crescimento não maligno é mais comum em pacientes mais jovens e tende a se estabilizar com a idade.11 Assim, o crescimento lento dos nevos coroidais não é invariavelmente um sinal de malignidade, especialmente em pacientes mais jovens sem outros fatores de risco.11
Interessantemente, lesões coroidais pigmentadas com nenhum dos fatores de risco acima têm 3% de chance de crescimento em cinco anos; tais lesões são geralmente nevos coroidais.9 A presença de um dos fatores acima carrega 38% de chance de crescimento e mais de 50% de chance de crescimento se dois ou mais fatores de risco estiverem presentes.9 O risco relativo de crescimento sobe de 1,9 vezes para 27,1 vezes para a presença de um contra todos os cinco fatores de risco.9
– Metástase coroidal refere-se a um tumor que se espalhou para o coróide por vias hematogênicas a partir de uma malignidade primária em outro lugar do corpo. Assim, não são tumores primários como a melanoma coróide – na maioria das vezes, são metástases de câncer de mama ou de pulmão. Estas lesões geralmente aparecem em forma de cúpula e de cor amarelo-creme, e frequentemente induzem descolamentos da retina. As metástases coroidais são frequentemente bilaterais ou multifocais e não aparecem em forma de cogumelo, ao contrário dos melanomas amelonaticos.1
– A hipertrofia congênita da RPE apresenta-se como lesões planas, unifocais ou multifocais, de pigmentação escura, muitas vezes com lacunas hipopigmentadas. São benignas, geralmente não se alteram com o tempo e não requerem tratamento.1
O descolamento sérico da retina resultante e a elevação da retina secundária à degeneração macular relacionada à idade exsudativa (DMRI) apresenta outro diferencial para o melanoma coróide. A DMRI pode apresentar hemorragia subretiniana, exsudação lipídica ou turva, edema macular sujo ou amarelo, dobras coróides, descolamentos epiteliais pigmentares ou cicatrizes distiformes.1 A angiografia fluorescente ajuda a diferenciar estas condições.
3. Os melanocitomas são pigmentados de forma escura e encontrados no disco óptico ou em torno dele.
– Os melanocitomas são pigmentados de forma escura e encontrados no disco óptico ou em torno dele (figura 3). Ao contrário dos melanomas, eles são congênitos e freqüentemente ocorrem em indivíduos com pigmentos escuros. Eles geralmente são inativos, mas podem crescer e raramente se desenvolver em melanomas.1
– Os hemangiomas coroidais são dilatações benignas dos vasos sanguíneos coroidais e estão freqüentemente associados com a síndrome de Sturge-Weber. Eles parecem elevados e são de cor vermelha alaranjada. Como os melanomas coroidais, podem induzir descolamentos serosos da retina.1
– Os osteomas coroidais são massas placóides amarelo-alaranjadas. Curiosamente, eles são compostos de tecido ósseo maduro. Eles podem permitir a neovascularização coróide e sangramento subretinal. Características muito características os tornam fáceis de serem diferenciados dos melanomas coroidais por meio de ultra-sonografia ou tomografia computadorizada.1
– Diferenciais adicionais para melanomas coróides amelonóticos ou melanóticos incluem descolamento coróide, linfoma, carcinoma metastático, hematoma subretinal ou sub-RPE, hematoma supra-coroidal localizado, esclerites nodulares posteriores, hiperplasia reativa da RPE ou gliose maciça da retina.4,5
Testes adicionais
Vários instrumentos podem auxiliar no diagnóstico de melanomas coroidais.
A- e B-scan ultra-sonografia não só auxilia no diagnóstico, mas também pode proporcionar medidas mais precisas do tumor. A varredura A geralmente revela baixa refletividade interna do tumor; oscilação na altura dos ecos dentro da lesão pode corresponder ao pulso do paciente, o que indica a presença de vascularização intralesional.1,5
B-scan mostra uma massa sólida com aspecto anterior acusticamente brilhante com escuridão interna e basal; a forma transversal tipicamente é bi-convexa, mas pode aparecer como cogumelo. A escavação coroidal e sombra orbital também podem ser vistas.1,5
Angiografia de fluoresceína tipicamente mostra hiperfluorescência dos vasos do tumor e coloração tardia difusa.1 Entretanto, o padrão de fluoresceína depende do tamanho do tumor, forma, pigmentação, integridade da RPE e se há um descolamento seroso da retina correspondente, entre outras variáveis.5 A angiografia com fluoresceína não produz sinais patognomônicos de melanoma coróide.3
Neste paciente em particular, o melanoma coróide foi diagnosticado com base no exame de fundoscopia, ultra-sonografia com A e B e angiografia com fluoresceína (sem biópsia).
A apresentação clínica desta paciente, isoladamente, foi altamente sugestiva – basicamente inequivocamente – de melanoma coróide. Possuía quatro dos cinco fatores de risco para malignidade acima mencionados: espessura > 2mm, líquido subretinal, sintomas/perda visual e uma localização < 3mm do disco óptico. Embora as dimensões da lesão melanótica baseada na ultra-sonografia não estejam disponíveis, ela foi claramente espessada mais de 2mm e tinha um diâmetro basal maior que 7mm (os limites superiores amplamente aceitos de nevos benignos).8,12
Adicionalmente, a massa apresentava características claramente invasivas, como invasão do disco óptico.8,12
Gestão e Prognóstico
Quando se encontra uma massa ocular suspeita, é importante perguntar ao paciente se ele teve alguma cirurgia ou trauma ocular; um histórico de câncer; ou quaisquer sintomas sistêmicos de câncer, como anorexia, perda de peso, fadiga geral, mal-estar ou doença. Enquanto 98% dos pacientes com melanomas coroidais não têm doença metastática detectável no momento do diagnóstico, a metástase deve ser descartada.5 Isto seria mais apropriadamente tratado por um oncologista ocular, portanto tal encaminhamento deve ser feito.
Testes incluem um hemograma completo, enzimas hepáticas, TC abdominal, RM ou ultra-som e uma radiografia de tórax.4,5 Várias opções de tratamento estão disponíveis para melanomas coroidais, mas muitas têm altos riscos envolvidos; portanto, o profissional de tratamento deve pesar cuidadosamente muitas variáveis ao selecionar a modalidade de tratamento apropriada para cada paciente em particular. Alguns fatores a serem considerados são tamanho e localização do tumor, estado de metástase, estado visual dos olhos afetados e não afetados, e idade e saúde geral do paciente.5 Dependendo desses fatores, a observação pode ser um plano de tratamento viável se o paciente tiver sérios problemas médicos simultâneos, mas geralmente não é aconselhado.
Transformação Maligna
Fator de risco para transformação maligna de nevos coróides incluem:4
– Espessura > 2mm.
– Líquido subretinal.
– Presença de sintomas.
– Pigmento laranja proeminente sobre a lesão.
– Localização < 3mm do disco óptico.
*- Se dois ou mais fatores estiverem presentes, a lesão é provavelmente um melanoma coróide.
Um tratamento muito agressivo é a enucleação, mas vem com riscos significativos. Metade dos pacientes que são tratados com enucleação acabam por morrer de melanoma metastático. Esta opção de tratamento invasivo é mais freqüentemente discutida se o olho afetado é cego, doloroso, mostra envolvimento do disco óptico ou se o tumor é muito grande.5
Muitos pequenos melanomas coróides são tratados com terapias destrutivas locais, como termoterapia, radioterapia ou irradiação.12 Vários tipos de radiação podem ser usados como tratamento.4,5 O mais comum é a braquiterapia com placa radioativa, que utiliza uma placa radioativa que é suturada na superfície do globo exterior ao tumor.
É mais comumente tentada com tumores menores que estejam a 3 diâmetros de disco ou mais longe do disco e da fóvea. Aproximadamente 10% a 15% dos pacientes tratados desta forma apresentam uma recidiva tumoral local após o tratamento. Após o tratamento, a visão do paciente geralmente permanece a mesma que era antes do tratamento, mas há uma chance de que possa melhorar. Entretanto, a visão pode ser posteriormente reduzida devido a efeitos secundários, como retinopatia por radiação, papilopatia óptica, cataratas ou glaucoma neovascular.
Photocoagulação pode ser tentada para tumores pequenos (< 3mm de espessura, < 7mm de diâmetro basal).4,5 Como a fotocoagulação por qualquer outro motivo, um escotoma permanente resultará em áreas fotocoaguladas. Outros tratamentos a laser também podem ser utilizados, incluindo a termoterapia transpupilar, que utiliza um laser infravermelho de baixa potência e longa duração.5,12 Esta técnica pode ser utilizada em conjunto com radioterapia de placa, mas não mostrou uma melhora significativa no controle local do tumor.13
Outros tratamentos menos comuns incluem ressecção local, terapia fotodinâmica ou crioterapia.4,5 Muitas vezes, tratamentos múltiplos são usados como parte de uma abordagem combinada.
Sadly, o prognóstico para pacientes com melanoma coróide muitas vezes é pobre. Apesar do tratamento, 30% a 50% dos pacientes eventualmente desenvolvem doença metastática; isto ocorre preferencialmente ao fígado, mas também ao pulmão, osso, pele, linfonodos ou sistema nervoso central.3,11,14 A mesma proporção de pacientes morrerá dentro de 10 anos após o diagnóstico, geralmente devido à disseminação metastática.3,11
Após metástase, a fatalidade é quase certa.11 A maior incidência de detecção metastática é dentro de um ano a partir do diagnóstico de melanoma coróide, embora possa não ocorrer até anos mais tarde. Vários fatores se correlacionam com o aumento da mortalidade, incluindo maior tamanho do melanoma, localização anterior, extensão extraescleral, crescimento através da membrana de Bruch, extensão do nervo óptico, falta de pigmentação e tipo celular agressivo e/ou atividade mitótica.3
>
É evidente que este paciente não recebeu os cuidados adequados em sua primeira consulta com a clínica de optometria; entretanto, apesar dos encaminhamentos apropriados após sua segunda consulta, as chances de um resultado bem sucedido foram reduzidas acentuadamente.
Embora um atraso no encaminhamento de alguns meses possa não ter alterado significativamente os resultados neste caso, esta situação enfatiza a importância de um histórico completo do caso e de uma comunicação médico-paciente eficaz. Destaca também a importância de encaminhamentos apropriados e trabalhos adicionais, independentemente da natureza “de longa data” de uma condição.
Embora o prognóstico para pacientes com melanoma coróide possa parecer sombrio, os oftalmologistas devem instituir tratamento apropriado assim que descobrirem tal lesão para melhorar as chances do paciente de ter resultados secundários positivos, incluindo a preservação da visão.
Dr. Weidmayer pratica com um grupo de optometristas no Eye Center of Lenawee, P.C., em Adrian e Brooklyn, Michigan.
1. RF Spaide. Doenças da Retina e Vítreo. 1ª ed. Philadelphia: W.B. Saunders; 1999:262-65.
2. Margo CE. O estudo colaborativo do melanoma ocular: uma visão geral. O controlo do cancro. 2004 Set-Oct;11(5):304-9.
5. Augsburger JJ, Damato BE, Bornfeld N. Uveal Melanoma. In: Yanoff M, Duker JS, eds. Oftalmologia. 1ª ed. Londres: Mosby;1999:1052-63.
6. Jones WL. Oftalmoscopia. In: Terry JE (ed.). Doença Ocular: Detecção, Diagnóstico e Tratamento. 1ª ed. Boston: Butterworth Publishers; 1984:155-57.
7. Materin MA, Raducu R, Bianciotto C, Shields CL. Fundus autofluorescence and optical coherence tomography findings in choroidal melanocytic lesions. Médio Oriente Afr J Ophthalmol. 2010 Jul;17(3): 201-6.
8. Augsburger JJ, Correa ZM, Trichopoulos N, Shaikh A. Sobreposição de tamanho entre nevos melanocíticos choroidais benignos e melanomas malignos choroidais. Invest Ophthalmol Vis Sci. 2008 Jul;49(7):2823-8.
9. Kaiserman I, Kaiserman N, Pe’er J. Acompanhamento ultra-sônico de longo prazo dos nevos coroidais e sua transformação em melanomas. Br J Ophthalmol. 2006 Ago;90(8):994-8.
10. Mashayekhi A, Siu S, Shields CL, Shields JA. Ampliação lenta dos nevos coroidais: um estudo de seguimento a longo prazo. Ophthalmology. 2011 Fev;118(2):382-8.
11. Onken MD, Worley LA, Tuscan MD, Harbour JW. Um ensaio de expressão multi-gene preciso e clinicamente viável para previsão de metástases no melanoma uveal. J Mol Diagn. 2010 julho;12(4):461-8.
12. Augsburger JJ, Correa ZM, Schneider S, et al. Biópsia diagnóstica de aspiração de agulha fina transvitreal de pequenos tumores coróides melanocíticos na categoria nevus versus melanoma. Trans Am Ophthalmol Soc. (2002);100:225-34.
13. Sagoo MS, Shields CL, Mashayekhi A, et al. Radioterapia com placa para melanoma coróide justapapilar: controle tumoral em 650 casos consecutivos. Oftalmologia 2011 Fev;118(2):402-7.
14. Finger PT, Kurli M, Reddy S, et al. PET/CT de corpo inteiro para estadiamento inicial do melanoma coróide. Br J Ophthalmol. 2005 Oct;89(10):1270-74.