Stabilitatea intermediarilor carbocationici
Știm că etapa limitatoare de viteză a unei reacții SN1 este prima etapă – formarea acestui intermediar carbocationic. Viteza acestei etape – și, prin urmare, viteza reacției globale de substituție – depinde de energia de activare pentru procesul în care se rupe legătura dintre carbon și gruparea de plecare și se formează un carbocation. În conformitate cu postulatul lui Hammond (secțiunea 6.2B), cu cât este mai stabil intermediarul carbocationic, cu atât mai repede va avea loc această primă etapă de rupere a legăturii. Cu alte cuvinte, probabilitatea ca o reacție de substituție nucleofilă să decurgă printr-un mecanism disociativ (SN1) depinde în mare măsură de stabilitatea carbocationului intermediar care se formează.
Întrebarea critică devine acum: ce stabilizează un carbocation?
Dacă este nevoie de o grupare retragătoare de electroni pentru a stabiliza o sarcină negativă, ce va stabiliza o sarcină pozitivă? Un grup donator de electroni!
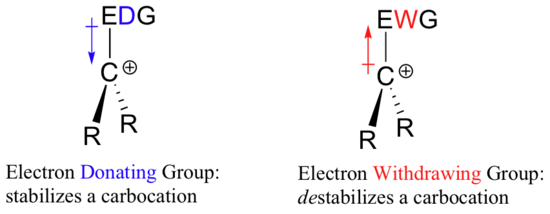
O specie încărcată pozitiv, cum ar fi un carbocation, este foarte săracă în electroni și, prin urmare, orice lucru care donează densitate de electroni către centrul de sărăcie electronică va contribui la stabilizarea acesteia. Invers, un carbocation va fi destabilizat de un grup care retrage electroni.
Grupările alchil – metil, etil și altele asemenea – sunt grupuri donatoare slabe de electroni și, astfel, stabilizează carbocationii din apropiere. Ceea ce înseamnă că, în general, carbocationii mai substituiți sunt mai stabili: un carbocation terț-butil, de exemplu, este mai stabil decât un carbocation izopropil. Carbocationii primari sunt foarte instabili și nu sunt adesea observați ca intermediari de reacție; carbocationii metilici sunt și mai puțin stabili.
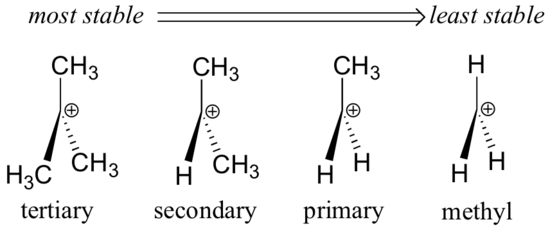
Grupările alchil sunt donatoare de electroni și stabilizatoare de carbocationi deoarece electronii din jurul carbonaților vecini sunt atrași spre sarcina pozitivă din apropiere, reducând astfel ușor sărăcia de electroni a carbonului cu sarcină pozitivă.
Nu este corect să spunem, totuși, că carbocationii cu substituție mai mare sunt întotdeauna mai stabili decât cei cu substituție mai mică. La fel cum grupurile donatoare de electroni pot stabiliza un carbocation, grupurile retragătoare de electroni acționează pentru a destabiliza carbocationii. Grupările carbonil sunt retragătoare de electroni prin efecte inductive, datorită polarității dublei legături C=O. Este posibil să se demonstreze în laborator (a se vedea secțiunea 16.1D) că carbocationul A de mai jos este mai stabil decât carbocationul B, chiar dacă A este un carbocation primar, iar B este secundar.
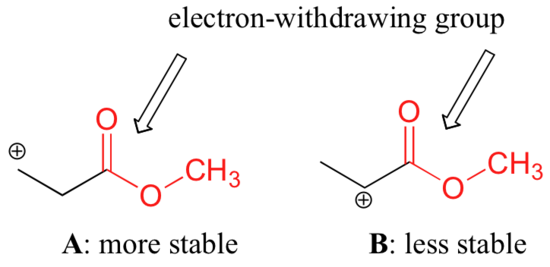
Diferența de stabilitate poate fi explicată prin luarea în considerare a efectului inductiv de retragere de electroni al carbonilului de ester. Reamintim că efectele inductive – fie că sunt de retragere sau de donare de electroni – sunt retransmise prin legături covalente și că intensitatea efectului scade rapid pe măsură ce crește numărul de legături intermediare. Cu alte cuvinte, efectul scade odată cu distanța. În specia B sarcina pozitivă este mai aproape de gruparea carbonil, astfel că efectul destabilizator de retragere a electronilor este mai puternic decât în specia A.
În capitolul următor vom vedea cum poate fi folosit efectul de destabilizare a carbocationilor de către substituenții fluorici retractori de electroni în experimentele concepute pentru a răspunde la întrebarea dacă o reacție biochimică de substituție nucleofilă este SN1 sau SN2.
Stabilizarea unui carbocation poate avea loc, de asemenea, prin efecte de rezonanță și, așa cum am discutat deja în capitolul despre acizi-baze, efectele de rezonanță sunt, de regulă, mai puternice decât efectele inductive. Să considerăm cazul simplu al unui carbocation benzilic:
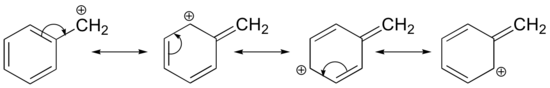
Acest carbocation este relativ stabil. În acest caz, donarea de electroni este un efect de rezonanță. Pentru acest carbocation pot fi desenate trei structuri de rezonanță suplimentare în care sarcina pozitivă este localizată pe unul dintre cei trei carboni aromatici. Sarcina pozitivă nu este izolată pe carbonul benzilic, ci mai degrabă este delocalizată în jurul structurii aromatice: această delocalizare a sarcinii duce la o stabilizare semnificativă. Ca urmare, carbocațiile benzilice și alilice (în care carbonul încărcat pozitiv este conjugat cu una sau mai multe duble legături nearomatice) sunt semnificativ mai stabile chiar și decât carbocațiile alchilice terțiare.
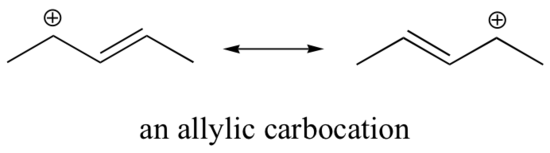
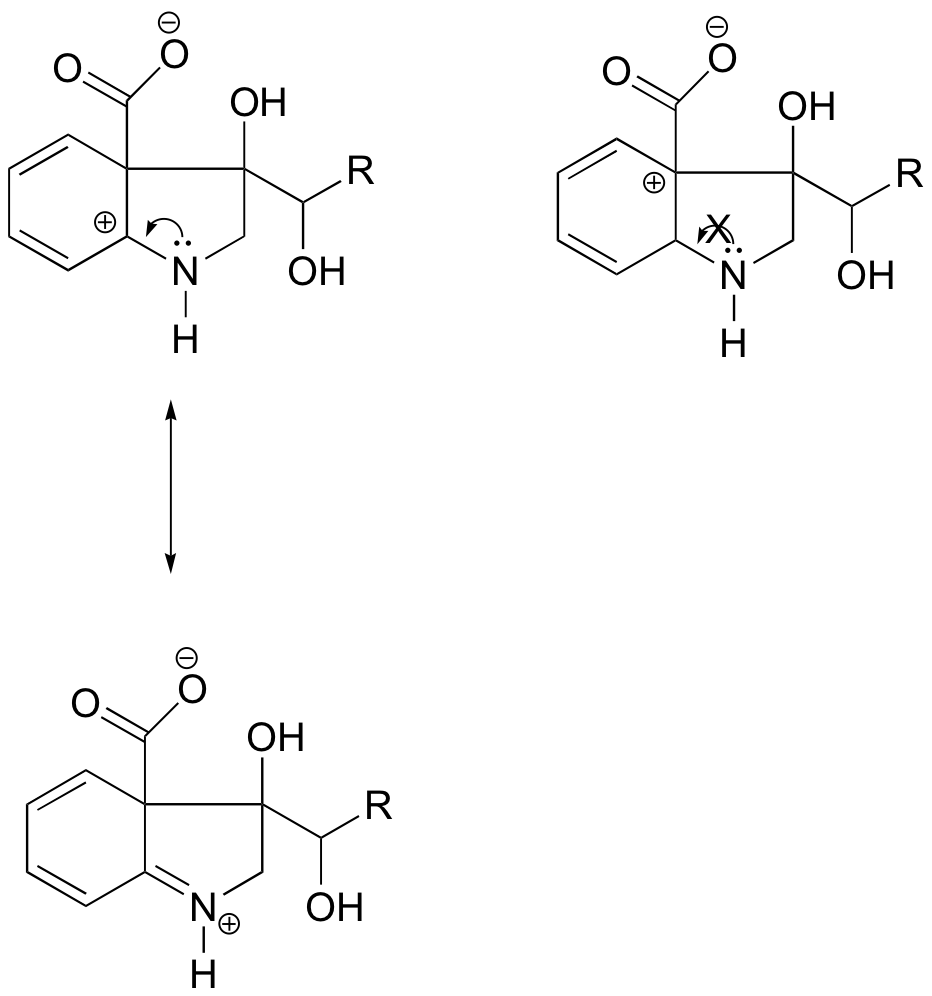
Pentru că heteroatoamele, cum ar fi oxigenul și azotul, sunt mai electronegative decât carbonul, v-ați putea aștepta ca acestea să fie, prin definiție, grupe retragătoare de electroni care destabilizează carbocațiile. De fapt, opusul este adesea adevărat: dacă atomul de oxigen sau de azot se află în poziția corectă, efectul general este stabilizarea carbocationului. Acest lucru se datorează faptului că, deși acești heteroatomi sunt grupări retragătoare de electroni prin inducție, ei sunt grupări donatoare de electroni prin rezonanță, iar acest efect de rezonanță este cel mai puternic. (Am întâlnit anterior aceeași idee atunci când am analizat aciditatea și bazicitatea relativă a fenolilor și a aminelor aromatice în secțiunea 7.4). Luați în considerare cele două perechi de specii de carbocationi de mai jos:
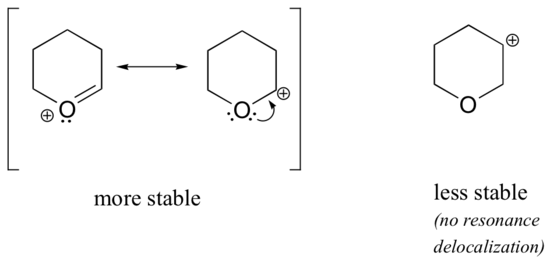
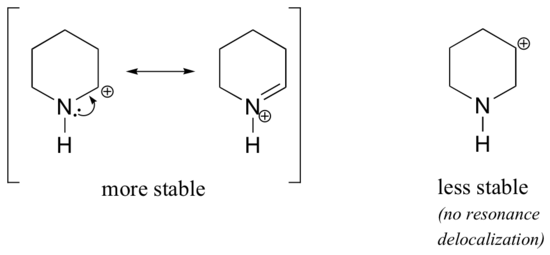
În carbocationii mai stabili, heteroatomul acționează ca o grupare donatoare de electroni prin rezonanță: de fapt, perechea singuratică de pe heteroatom este disponibilă pentru a delocaliza sarcina pozitivă. În carbocationii mai puțin stabili, carbonul cu sarcină pozitivă se află la mai mult de o legătură distanță de heteroatom și, prin urmare, nu sunt posibile efecte de rezonanță. De fapt, în aceste specii de carbocationi, heteroatomele destabilizează de fapt sarcina pozitivă, deoarece prin inducție sunt retractori de electroni.
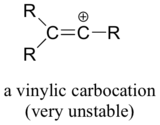
În cele din urmă, carbocationii vinilici, în care sarcina pozitivă rezidă pe un carbon cu dublă legătură, sunt foarte instabili și, prin urmare, este puțin probabil să se formeze ca intermediari în orice reacție.
Exemplu 7.9.1
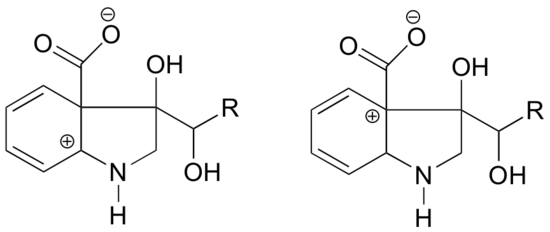
În care dintre structurile de mai jos este de așteptat ca carbocationul să fie mai stabil? Explicați.
Răspundeți
În carbocationul din stânga, sarcina pozitivă este situată într-o poziție în raport cu azotul astfel încât perechea de electroni singuratici de pe azot poate fi donată pentru a umple orbitalul gol. Acest lucru nu este posibil în cazul speciei de carbocation din dreapta.
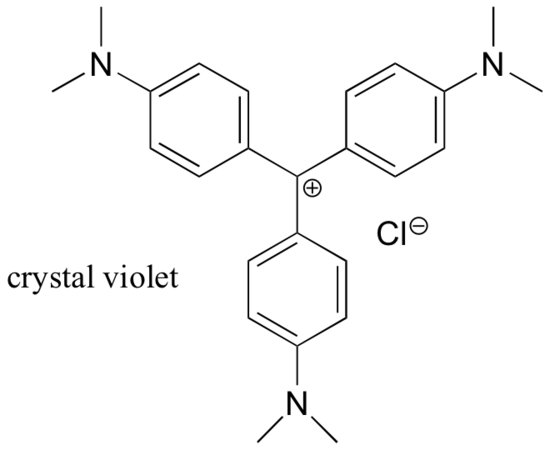
În cea mai mare parte, carbocationii sunt specii intermediare tranzitorii, de foarte mare energie, în reacțiile organice. Cu toate acestea, există câteva exemple neobișnuite de carbocationi foarte stabili care iau forma unor săruri organice. Violetul de cristal este denumirea obișnuită pentru sarea de clorură a carbocationului a cărui structură este prezentată mai jos. Observați posibilitățile structurale pentru o amplă delocalizare prin rezonanță a sarcinii pozitive și prezența a trei grupe amină donatoare de electroni.
Exemplu 7.9.2
Desenați o structură de rezonanță a cationului cristal violet în care sarcina pozitivă este delocalizată pe unul dintre atomii de azot.
Răspuns 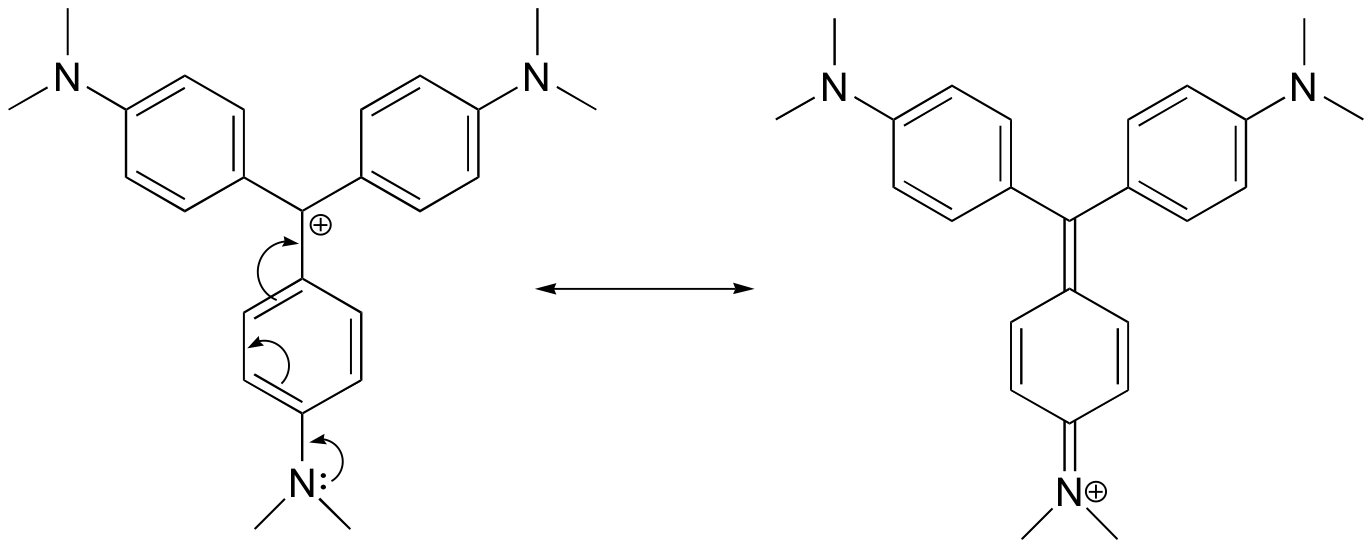
Când se ia în considerare posibilitatea ca o reacție de substituție nucleofilă să se desfășoare pe calea SN1, este esențial să se evalueze stabilitatea ipoteticului carbocation intermediar. Dacă acest intermediar nu este suficient de stabil, un mecanism SN1 trebuie considerat improbabil, iar reacția se desfășoară probabil printr-un mecanism SN2. În capitolul următor vom vedea mai multe exemple de reacții SN1 importante din punct de vedere biologic, în care intermediarul încărcat pozitiv este stabilizat prin efecte inductive și de rezonanță inerente propriei sale structuri moleculare.
Exemplu 7.9.3
Spuneți care carbocation din fiecare pereche de mai jos este mai stabil sau dacă se așteaptă ca aceștia să fie aproximativ egali. carbocationul secundar)
d) 2 (sarcina pozitivă este mai departe de fluorul care retrage electroni)
e) 1 (perechea singuratică de pe azot poate dona electroni prin rezonanță)
f) 1 (carbocation alilic – sarcina pozitivă poate fi delocalizată pe un al doilea carbon)
.