Chemguide: Suport pentru CIE A level Chemistry
Rezultat al învățării 11.2(f)
Acest enunț se referă la coeficienții de partiție.
Înainte de a continua, trebuie să găsiți și să citiți enunțul în exemplarul dumneavoastră de programă.
Coeficienți de partiție
Dacă aveți două lichide imiscibile, cum ar fi eterul și apa, și le agitați într-o pâlnie de separare, ele formează în mod evident două straturi. Eterul este mai puțin dens decât apa și astfel formează stratul superior.
Să presupunem acum că agitați un amestec de eter și apă care conține o substanță solubilă în ambele. Să presupunem că substanța, X, este mai solubilă în eter decât în apă.
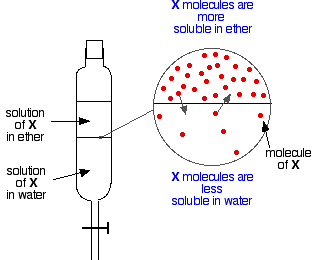
Părticulele de X vor traversa granița dintre cele două straturi lichide și veți obține în curând un echilibru dinamic stabilit. Pentru fiecare particulă care se deplasează în stratul superior, una se va deplasa înapoi în cel inferior.
Ați putea scrie o ecuație pentru acest lucru:
![]()
![]()
. . . și, ca orice alt echilibru, puteți găsi o constantă de echilibru:
![]()
![]()
Această constantă de echilibru se numește coeficient de partiție și i se dă adesea simbolul Kpc.
Ca și alte constante de echilibru, coeficienții de partiție sunt constanți la o temperatură constantă, dar au și alte restricții. Ei funcționează corect numai pentru soluții destul de diluate, iar solutul trebuie să fie în aceeași formă chimică în ambii solvenți. Acesta nu trebuie să reacționeze, să se ionizeze sau să se asocieze (să se unească în dimeri, de exemplu).
Calcularea coeficientului de partiție
O notă privind unitățile
Rețineți că coeficientul de partiție este un simplu raport a două concentrații. Nu contează ce unități de concentrație folosiți – atâta timp cât le folosiți pe cele de sus și de jos.
Ați putea folosi mol dm-3, dar cel mai adesea se folosește g cm-3 – grame pe centimetru cub.
Tehnic, parantezele pătrate pot fi folosite doar pentru concentrația în mol dm-3, dar Caietul de susținere a aplicației și schemele de notare ale CIE le folosesc și pentru alte unități.
Nu sunt pregătit să fac acest lucru și, prin urmare, voi folosi termenul „concentrația lui X” mai degrabă decât atunci când sunt folosite unități de concentrație nestandardizate.
Calcularea unui coeficient de partiție
Când o soluție de 1,00 g de X în 100 cm3 de apă a fost agitată cu 10 cm3 de eter, 0,80 g de X a fost transferată în stratul de eter. Calculați coeficientul de partiție al lui X între eter și apă.
Dacă vi se cere să calculați un coeficient de partiție între doi solvenți, concentrația primului solvent menționat se pune deasupra expresiei Kpc. Deci, în acest caz:
![]()
![]()
Aveți suficiente informații pentru a calcula ambele concentrații în g cm-3.
![]() concentrația lui X în eter = 0,80/10 g cm-3
concentrația lui X în eter = 0,80/10 g cm-3
Dacă 0,80 g au fost transferate în eter, 1,00 – 0,80 g = 0.20 g au rămas în apă.
![]() concentrația lui X în apă = 0,20/100 g cm-3
concentrația lui X în apă = 0,20/100 g cm-3
Deci:
![]()
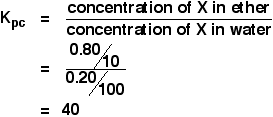
Evident, ați putea calcula concentrațiile în eter și în apă ca numere reale înainte de a le introduce în expresie. Faceți-o în modul în care vă simțiți cel mai confortabil.
Coeficienții de partiție ca acesta nu au unități – unitățile se anulează pentru că sunt aceleași sus și jos.
Calcule care implică coeficienți de partiție
Programul CIE spune în mod specific că ar trebui să puteți calcula un coeficient de partiție (cu alte cuvinte, ceea ce tocmai am făcut noi). Nu spune absolut nimic despre utilizarea lor pentru a calcula alte lucruri. Aceste calcule suplimentare sunt discutate în Broșura de susținere a aplicației și au fost cerute de două ori la examene până în iunie 2013 (ambele în 2009).
Cartea de curs nu le include (destul de corect!), deoarece programa nu le menționează, iar această carte a fost aprobată de examinatorii CIE ca fiind o „acoperire completă și precisă” a programei. Deci asta înseamnă că CIE nu va mai pune întrebări în viitor? Nu vă bazați pe asta!
Un exemplu de bază
Vom folosi același caz ca și până acum – aceiași solvenți, același X și același coeficient de partiție pe care tocmai l-am calculat.
De data aceasta vom calcula câtă cantitate ar fi fost extrasă în stratul de eter dacă am fi agitat soluția inițială de 1,00 g de X în 100 cm3 de apă cu doar 5 cm3 de eter.
Încercăm să calculăm masa de X extrasă. Să o numim m.
Acum să calculăm o expresie pentru concentrația soluției de X în eter.
![]() concentrația de X în eter = m/5 g cm-3
concentrația de X în eter = m/5 g cm-3
Cum rămâne cu apa? În apă vor rămâne (1,00 – m) g de X. Deci:
![]() concentrația lui X în apă = (1,00 – m)/100 g cm-3
concentrația lui X în apă = (1,00 – m)/100 g cm-3
Acum puteți pune toate acestea în expresia coeficientului de partiție. Amintiți-vă că am calculat deja coeficientul de partiție al lui X între eter și apă ca fiind 40.
![]()
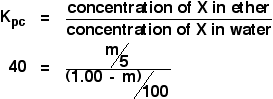
Apoi vă confruntați doar cu o parte simplă, dar ușor plictisitoare, de algebră:
![]()
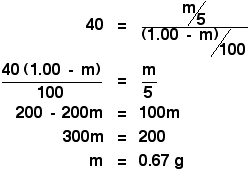
Mai plictisitor!
În calculul inițial pentru a găsi coeficientul de partiție, vi s-a spus că dacă agitați soluția inițială de 1,00 g de X în 100 cm3 de apă cu 10 cm3 de eter, ați extras 0,80 g de X.
Să o agitați cu 5 cm3 de eter, tocmai am calculat că veți extrage 0,67 g de X.
Aceasta ar lăsa în urmă 0,33 g de X în cei 100 cm3 de apă. Să presupunem că ați fi păstrat cu grijă această soluție și apoi ați fi agitat-o cu un al doilea 5 cm3 de eter proaspăt.
Cât de mult din X ați fi extras în total folosind eterul ca două loturi separate de 5 cm3 în loc de 10 cm3 dintr-o singură dată?
Să numim masa de X extrasă prin al doilea lot de eter n – ca să nu ne confundăm.
Elaborăm o expresie pentru concentrația soluției de X în eter.
![]() concentrația de X în eter = n/5 g cm-3
concentrația de X în eter = n/5 g cm-3
Cum rămâne cu apa? În apă vor rămâne (0,33 – n) g de X după a doua extracție. Deci:
![]() concentrația de X în apă = (0,33 – n)/100 g cm-3
concentrația de X în apă = (0,33 – n)/100 g cm-3
Acum puteți pune toate acestea în expresia coeficientului de partiție pentru X între eter și apă ca mai înainte.
![]()

Aceasta înseamnă că, dacă ați combina cele două loturi de 5 cm3 de eter, ați fi extras în total 0,67 + 0,22 g de X. Asta înseamnă 0.89 g.
Început vi s-a spus că, dacă ați fi făcut acest lucru o singură dată, folosind eterul ca un singur lot de 10 cm3, ați fi extras doar 0,80 g.
Obțineți o extracție mai eficientă prin împărțirea solventului în volume mai mici, așa cum s-a spus mai sus.
Vă folosiți acest tip de tehnică în timpul preparării unor compuși organici. Extrageți ceea ce încercați să preparați dintr-o soluție murdară în apă, astfel încât să ajungă într-un solvent organic. Apoi eliminați solventul prin distilare atentă.
CIE a pus o întrebare similară cu aceasta în lucrarea 4 Q8 din iunie 2009. A trebuit să calculați o valoare pentru coeficientul de partiție și apoi să o folosiți într-o extracție în două etape, exact ca mai sus. Calculul a valorat 4 puncte. Este posibil ca acest lucru să fie plictisitor și (în afară de calcularea coeficientului de partiție) să nu se regăsească în programă, dar nu vă puteți permite să nu fiți capabili să îl faceți.
.