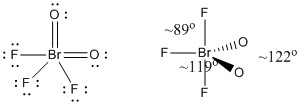Chimie anorganică intermediară
Universitatea din Rhode Island
Toamna 2013
1. Scrieți configurația electronică (folosind notația gazelor rare pentru învelișurile închise) și simbolul termenului de stare fundamentală pentru următoarele: a) Sc; b) Sc+; c) Sc2+; d) Sc3+; e) Sc-.
a) Sc
4s23d1
Doar electronul 3d contribuie la simbolul termenului: L = 2 și S = ½ dând 2D
b) Sc+
3d2
L = 3 și S = 1 dând 3F
c) Sc2+
3d1
L = 2 și S = ½ dând 2D
d) Sc3+
L = 0 și S = 0 dând 1S
d) Sc-
4s23d2
L = 3 și S = 1 dând 3F
2. Scrieți structura punctului Lewis, dați sarcinile formale pe toți atomii, preziceți geometria moleculară, estimați toate unghiurile de legătură și dați orbitalul hibrid probabil pentru următoarele: a) BrO2-; b) BrO3-; c) BrO2F3.
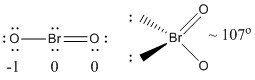
a) BrO2-
Structura Lewis:
Cărțile formale sunt date pe structura Lewis
Structura: plană curbată cu un unghi de legătură de ~107°
Orbitalul hibrid pe Br: sp3
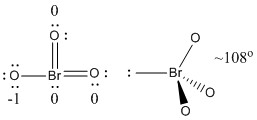
b) BrO3-
Structura Lewis:
Cărțile formale sunt date pe structura Lewis
Structura: piramidală cu unghiurile de legătură O-Br-O ~108°
Orbitalul hibrid pe Br: sp3
c) BrO2F3
Structura Lewis:
Cărțile formale sunt date pe structura Lewis
Structura: trigonal bipiramidală cu unghiurile de legătură indicate în figură
Orbitalul hibrid pe Br: dsp3
3. Duritatea absolută a unui atom se definește ca η = ½(IP – EA), IP este potențialul de ionizare, iar EA este afinitatea electronică. Prevădeți tendințele periodice ale lui η și argumentați predicția dumneavoastră.
Pentru aproape toți atomii IP >> EA, deci η va urma tendințele periodice ale IP: crește pe măsură ce ne deplasăm spre dreapta în tabelul periodic (urmând Z*) și scade ușor pe măsură ce ne deplasăm în jos în tabelul periodic, pe măsură ce raza atomică crește.
4. Cr2 are configurația electronică σ2π4δ4δ*2. Care este ordinea legăturii și câți spini nepereche sunt prevăzuți? V-ați aștepta ca Cr2 să absoarbă lumina în regiunea vizibilă a spectrului? De ce sau de ce nu?
Ordinea legăturii = ½(2 + 4 + 4 + 4 – 2) = 4 cu 2 spini neperecheați (din moment ce există 2 orbitali δ trebuie să existe și 2 orbitali δ*, care au fiecare câte un electron pe baza regulilor lui Hund). Suprapunerea alăturată a orbitalilor d pentru a forma orbitalii δ este slabă, astfel încât divizarea între orbitalii δ și δ* va fi mică. Acest lucru sugerează că energia necesară pentru a muta un electron de la HOMO la LUMO este de asemenea mică, ceea ce prezice o absorbție în partea vizibilă a spectrului.