La modul cel mai simplu, o celulă electrochimică este formată din doi conductori de electroni separați de un conductor ionic și legați de un conductor de electroni.
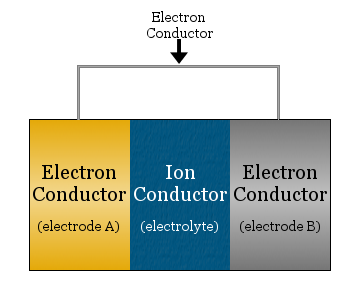
- conductorul ionic se numește electrolit
- conducătorii de electroni separați de electrolit se numesc electrozi
- conductorul de electroni folosit pentru a lega electrozii este adesea o sârmă metalică, cum ar fi cablurile de cupru
Două tipuri de celule
Există două tipuri fundamentale de celule electrochimice: galvanică și electrolitică.
Conversia de energie se realizează prin reacții redox spontane (ΔG < 0) care produc un flux de electroni.
Un flux de electroni antrenează reacții redox nespontane (ΔG ≥ 0).
Exemple
- O baterie care alimentează ceva este un exemplu de celulă galvanică.
- Bateriile reîncărcabile sunt exemple de ambele tipuri de celule: ele funcționează ca celule galvanice atunci când alimentează un dispozitiv și ca celule electrolitice atunci când sunt reîncărcate.
- Exemple de celule electrolitice sunt, de asemenea, cele folosite pentru a descompune apa în hidrogen și oxigen și cele care transformă minereul de aluminiu în aluminiu metalic.
O sursă de date termodinamice
În plus față de utilizările practice, cum ar fi cele descrise mai sus, celulele electrochimice oferă o modalitate excelentă de colectare a datelor termodinamice. de exemplu, ele permit determinarea potențialelor redox standard, din care se pot obține în mod convenabil date standard de entalpie, entropie standard și energie liberă Gibbs standard pentru reacții.
Separarea reacțiilor
Celele electrochimice pot:
- furniza energie electrică, sau
- converti minereuri metalice în metal, sau
- furniza date termodinamice,
deoarece reacțiile redox au loc separat.
Exemplu: Celula Daniell
În celulele electrochimice, reacțiile au loc la electrozi separați – și, într-adevăr, electrozii înșiși pot fi plasați în vase diferite.Să luăm în considerare una dintre primele celule galvanice, celula Daniell.
Sursa de energie a celulei Daniell este reacția spontană a zincului metalic cu sulfatul de cupru pentru a produce sulfat de zinc și cupru metalic.
ΔG° = -212.6 kJ mol-1
Când materialele sunt aduse împreună:
- în contact direct într-un vas, energia potențială chimică este transformată în energie termică și vasul de reacție se încălzește
- într-o celulă electrochimică, energia potențială chimică este transformată în energie electrică
Celula Daniell
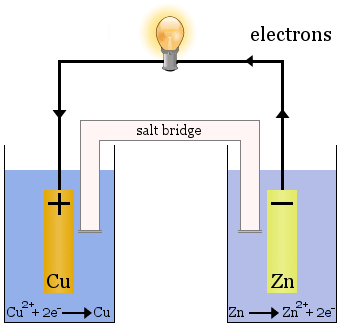
Celula Daniell este formată din două semicelule: ionii de cupru sunt reduși într-una dintre ele, iar zincul este oxidat în cealaltă.
Când celula funcționează, Cu2+ este eliminat dintr-o celulă și Zn2+ este produs în cealaltă celulă. electrodul de cupru începe să crească pe măsură ce este placat cu cupru metalic proaspăt depus, iar electrodul de zinc începe să se diminueze datorită pierderii zincului sub formă de ioni în soluție.
Ponta de sare în cazul de mai sus este un tub de sticlă umplut cu soluție saturată de KNO3.Acesta are frite la capete care împiedică amestecarea soluțiilor în fiecare dintre semicelule, dar permite trecerea ionilor pentru a completa circuitul electric și a menține fiecare semicelulă neutră din punct de vedere electric.
Forța motrice este aceeași ΔG° = -212.6 kJ mol-1 care se obține la simpla amestecare a reactanților într-un singur vas;prin separarea celor două semi-reacții, electronii trebuie să călătorească prin fir și putem folosi energia electrică.



.