- Review Article
- Enterocutaneous Fistula: Evidence-based Management
- Abstract
- Introducere
- Tabel 1
- Tabel 1: Clasificare.
- Tabel 2
- Tabelul 2: Variabile prognostice ECF.
- Clasificare
- Factori de prognostic pentru ECF
- Diagnostic
- Figura 1
- Management
- Resuscitare
- Controlul sursei
- Managementul efluentului
- Îngrijirea rănilor
- Tabelul 3
- Tabelul 3: Timpul până la managementul definitiv.
- Nutriție
- Concluzie
Review Article
Enterocutaneous Fistula: Evidence-based Management
Ryan P Dumas1*, Sarah A Moore1 și Carrie A Sims2
1Departamentul de traumatologie, terapie critică chirurgicală & Chirurgie de urgență, Școala de Medicină Perelman de la Universitatea din Pennsylvania, Philadelphia, PA, SUA
2Departamentul de Chirurgie, Divizia de Traumatologie, Îngrijire critică chirurgicală & Chirurgie de urgență, Școala de Medicină Perelman de la Universitatea din Pennsylvania, Philadelphia, PA, SUA
*Autor corespondent: Ryan P Dumas, Department ofTraumatology, Surgical Critical Care& Emergency Surgery, PerelmanSchool of Medicine at the University ofPennsylvania, 51 N. 39th Street, MOBSuite 120, Philadelphia, PA 19104,USA
Abstract
Managementul fistulei enterocutanate (ECF) este o abilitate clinică care ar trebui să se regăsească înarmamentarium-ul fiecărui chirurg generalist. Deși tratamentul definitiv se bazează frecvent peînchiderea chirurgicală, îngrijirea și diligența preoperatorie sunt primordiale pentru a asigura un rezultat de succes. Îngrijirea acestor pacienți ar trebui să se concentreze pe patru faze cheie. Prima fază este caracterizată de o recunoaștere și o resuscitare corespunzătoare. În timpul celei de-a doua faze, se realizează o evaluare și un plan nutrițional complet. Evaluarea radiografică în timpul celei de-a treia faze ajută la definirea anatomiei ECF. În cele din urmă, a patra fază se caracterizează prin închiderea definitivă în cazul în care fistula nu se vindecă spontan.Această analiză se va concentra pe aspectele cheie care definesc fiecare fază și ajută chirurgul generalist să maximizeze șansele unui rezultat pozitiv.
Introducere
Dezvoltarea unei fistule enterocutanate (ECF), definită ca o conexiune anormală între lumenul intestinal și pielea externă, este o sursă semnificativă de morbiditate și mortalitate, în ciuda progreselor înregistrate atât în îngrijirea chirurgicală, cât și în cea medicală. Cu toate acestea, incidența globală a FCE este necunoscută, majoritatea datelor referitoare la FCE provenind sub forma unor mari serii instituționale retrospective sau specifice chirurgilor. În mod remarcabil, doar 25% din toate ECF-urile sunt secundare bolilor inflamatorii intestinale, patologiei diverticulare, traumatismelor, radiațiilor și malignității . În schimb, aproape 75% din toateECF sunt rezultatul direct al unei intervenții chirurgicale laparoscopice sau deschise, o scurgere astomotică în urma uneienterectomii fiind responsabilă pentru peste 50% din aceste fistule. Leziunile iatrogene involuntare, cum ar fi enterotomiile sau leziunile termice nerecunoscute suferite în timpul unei operații, reprezintă restul fistulelor. Deoarece ECF este cel mai frecvent o problemă creată de chirurg, sarcina prevenirii, precum și a unui management adecvat, a planificării și a unui tratament definitiv revine în mod corect chirurgului.
Morbiditatea și mortalitatea în urma ECF este extrem de ridicată. Se estimează că 90% dintre pacienți vor experimenta o morbiditate legată de ECF, variind de la excoriații cutanate, la deshidratare și sepsis.Mai mult, mortalitatea atribuită unei ECF variază între 5-20% și depinde de mai mulți factori, inclusiv de infecția subiacentă și de localizarea fistulei. Deoarece principala cauză de deces la pacienții cu ECF este sepsisul, controlul sursei rămâne una dintre pietrele de temelie ale terapiei. În seriile retrospective, s-a observat că mortalitatea crește de 16 ori în cazul sepsisului și de 22 ori în cazul unei infecții necontrolate . Ca atare, tratamentul precoce și definitiv al colecțiilor nedrenate, în combinație cu antimicrobiene pe termen scurt, are potențialul de a îmbunătăți semnificativ rezultatele. În majoritatea seriilor, mortalitatea pare, de asemenea, să fie corelată cu debitul și localizarea fistulei. Mortalitatea crește de la 26% în cazul fistulelor cu debit scăzut la 50% în cazul celor cu debit ridicat, având în vedere provocările legate de lichide, electroliți și nutriție asociate cu gestionarea ECF . Mortalitatea se corelează, de asemenea, cu localizarea și scade în cazul fistulelor mai distale. În timp ce fistulele jejunale au cea mai mare mortalitate, de 29%, și sunt mult mai dificile de gestionat, mortalitatea cauzată de fistulele colonice este cea mai mică, de 6%.
Dincolo de impactul asupra pacientului, care variază de la cel fiziologic la cel psihologic, gestionarea FCE pune o presiune enormă asupra resurselor de asistență medicală. Se estimează că costul gestionării FECF depășește cu mult 500.000 de dolari și necesită o echipă multidisciplinară formată din nutriționiști, asistenți de îngrijire a rănilor și chirurgi pentru a asigura un rezultat bun . Importanța centrelor de tratament cu înaltă specializare nu trebuie subestimată și s-a demonstrat că acestea reduc semnificativ mortalitatea de la 42% la 20% .
Tabel 1

| Anatomic | Proximal sau distal | Gastric, duodenal, jejunal, ileal, colonic |
| Fiziologic | Debit mare, moderat, scăzut | Debit mare >500 cc/zi Moderat 200-500 cc/zi Debit scăzut < 200 cc/zi |
| Etiologie | Iatrogenă vs. spontană Traumatică |
Malignă Radiație Boala inflamatorie intestinală Diverticulară |
Tabel 1: Clasificare.
Tabel 1
Clasificare.
Tabel 2

| FAVORABIL. | NEFAVORABILE |
|---|---|
| Nutrițional bogat | Nutrițional sărăcit |
| – Albumină >3.0 | – Albumină scăzută, transferrină scăzută |
| Traiect fistular lung (>2cm) | Fistulă scurtă, fistulă multiplă, complexă |
| Fistulă diverticulară | Defect enteral mare (>1cm), mucoasă vizibilă |
| Fistulă mică | Fistulă mare (>500cc/zi) |
| Fistulă unică | Iradiere anterioară |
| Continuitatea intestinală | Operații multiple anterioare |
| Operație index efectuată în același centru | Referiri externe la un centru de înaltăcentru de volum |
Tabelul 2: Variabile prognostice ECF.
Tabelul 2
Variabile prognostice ale ECF.
Clasificare
Nu există o schemă de clasificare universală sau bine stabilită pentru ECF. În general, fistulele sunt clasificate anatomic, fiziologicsau în funcție de procesul patologic . În plus, fistulele pot fi clasificateîn funcție de cantitatea de ieșire zilnică. Este imperativ ca producția de fistulă să fie documentată cu exactitate, deoarece cantitatea poate dicta schimbări în management. Tabelul 1 detaliază trei paradigme diferite de clasificare.
Factori de prognostic pentru ECF
Factori de prognostic pentru ECF au fost foarte bine descriși și sunt în concordanță cu dogma chirurgicală standard. Pacienții cuo fistulă proximală, cu debit mare, însoțită de un nivel scăzut de albumină(. Dimpotrivă, pacienții fără comorbiditățicare au fistule care sunt rezultatul unei proceduri chirurgicale și au un debit scăzut au o evoluție mai favorabilă cu închideri spontane mai mari . Tabelul 2 detaliază multe dintre variabilele care pot prezice un rezultat pozitiv.
Nu se poate sublinia prea mult importanța sprijinului instituțional și a expertizei multidisciplinare ca factor de prognostic pozitiv.Mai multe studii au confirmat experiența și volumul instituțional ca factori critici în scăderea morbidității și îmbunătățirea mortalității. Recent, Asociația Canadiană de Terapie Enterostomală a codificat importanța îngrijirii multidisciplinare prin identificarea a nouă membri esențiali ai echipei în recomandările lor „ECF Best Practice”. De la chirurgi, la farmaciști și până la chirurgi, această abordare integrată a echipei recunoaște expertiza pe care fiecare specialitate o aduce în îngrijirea acestor pacienți complecși.
Diagnostic
O evoluție postoperatorie înăbușitoare complicată de ileus șidezvoltarea unei infecții postoperatorii a plăgii este un semn prevestitor pentruECF. Odată ce o fistulă este suspectată sau a fost identificată la examenul fizic, studiile radiologice sunt adjuvante necesare și 97% din toți pacienții sunt supuși unei forme de evaluare radiologică . Tomografia computerizată cu contrast este esențială, deoarece evaluează prezența unui abces asociat sau a unei colecții nedrenate. Odată ce controlul sursei a fost optimizat, fistulografia fluoroscopică joacă un rol important în definirea anatomiei fistulei. O fistulogramă va ajuta la localizarea originii, la determinarea lungimii, la evaluarea prezenței obstrucției distale și la determinarea faptului că fistula este în continuitate cu restul intestinului. Odată ce diagnosticul de FCE a fost confirmat, accentul trebuie pus pe management.
Figura 1
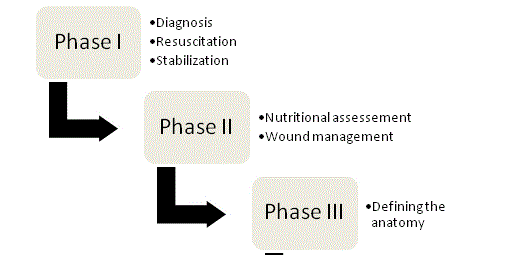
Figura 1
Cele patru faze ale gestionării ECF.
Management
Principiile managementului ECF au fost susținute pentru prima dată deChapman și colegii săi în 1964 și până în prezent ele rămân pietrele de temelie ale terapiei. În articolul lor original, Chapman și colab.au identificat patru factori cheie: resuscitarea fluidelor, controlul surselor, gestionarea efluenților și protecția pielii. Importanța nutriției a apărut recent ca un al cincilea element cheie. O abordare organizată și sistematică ar trebui întreprinsă cu fiecare pacient cu fistulă pentru a optimiza șansele unui rezultat de succes; iar managementul poate fi în cele din urmă împărțit în cele patru faze (Figura 1).
Resuscitare
Resuscitarea unui pacient cu o ECF recent diagnosticată urmează multe dintre aceleași principii ca și resuscitarea pacienților septici, iar principiile campaniei Surviving Sepsis ar trebui să servească drept cadru . Îngrijirea inițială ar trebui să se concentreze pe resuscitarea agresivă a fluidelor, evaluarea rapidă și corectarea dezechilibrelor electrolitice și normalizarea acidozei lactice. Pacienții cu ECF sunt de obicei hiponatremici, hipokaliemici și acidotici din cauza pierderilor gastro-intestinale continue.Pacienților cu fistule cu debit mare trebuie să li se înlocuiască intravenos pierderile de lichide, electroliți și bicarbonați pentru a evita deshidratarea și instabilitatea metabolică profundă în timpul perioadei inițiale de stabilizare. Monitorizarea atentă a debitului urinar și înlocuirea țintită a efluentului fistulei la fiecare 4 până la 8 ore va preveni deshidratarea continuă.
Controlul sursei
După ce pacientul este resuscitat, atenția trebuie să se îndrepte spre stabilirea controlului sursei. După cum s-a menționat anterior, o tomografie computerizată cu contrast este instrumentală în identificarea colecțiilor și abceselor nedrenate. La pacienții postoperatori, controlul sursei se realizează cel mai probabil prin radiologie intervențională. Cu toate acestea, în fața unor colecții inaccesibile sau a unei septicemii intraabdominale necontrolate, o operație poate fi inevitabilă. Antibioticele intravenoase cu spectru larg, empirice, nu ar trebui să fie utilizate în mod obișnuit pentru tratarea ECF, cu excepția cazului în care există dovezi de colecții intraabdominale sau de infecție a plăgii cu celulită asociată. Ori de câte ori este posibil, antibioticele ar trebui să fie direcționate către date specifice de cultură și limitate la nomai mult de 2 săptămâni.
Managementul efluentului
Managementul efluentului de succes poate avea un impact semnificativ asupra stării de volum, echilibrului electrolitic, nutriției și integrității pielii.Managementul medical adjuvant al efluentului ECF s-a concentrat în mod tradițional pe două domenii principale: neutralizarea acidului și reducerea volumului.Utilizarea inhibitorilor pompei de protoni poate îndeplini ambele obiective, iar doza trebuie titrată până când pH-ul efluentului este mai mare de 6 și volumul de ieșire este mai mic de 1L/zi . Deși psyllium poate fi extrem de util pentru a mări volumul efluentului și pentru a crește timpul de tranzit, agenții antimotilitate și antisecretori, inclusiv loperamida, atropinedifenoxilatul, codeina, tinctura de opiu și chiar metadona, sunt pilonul principal al reducerii volumului. Având în vedere rolul său de inhibitor universal al hormonilor gastrointestinali, au fost efectuate numeroase cercetări pentru a studia efectele somatostatinei exogene asupra pacienților cu FEC. În ciuda unui număr semnificativ de studii randomizate controlate, concluziile semnificative sunt dificil de elucidat din cauza dimensiunii reduse a eșantioanelor și a designului inconsecvent al studiilor. Octreotida, un analog de somatostatină cu durată de viață mai lungă, a fost, de asemenea, investigată ca adjuvant al ECF, cu rezultate promițătoare. Octreotida 100 mcg de trei ori pe zi poate reduce volumul efluentului și s-a demonstrat că scade timpul până la închiderea spontană în unele studii . Ca atare, ar putea fi justificată o încercare de terapie cu octreotidă timp de 72 de ore cu o monitorizare atentă a debitului fistulei, în special în cazurile în care alte terapii nu au reușit să reducă volumul debitului . Efectele secundare frecvente includ hiperglicemie, dureri de cap și colelitiază.
În timp ce datele sunt clare că fistulele cu debit scăzut au o rată crescută de închidere spontană, este mai puțin clar că scăderea volumului de debit va îmbunătăți închiderea fistulei. Cu toate acestea, scăderea volumului de debit poate ușura în mod semnificativ povara gestionării fistulelor și poate avea un impact pozitiv asupra bunăstării pacientului.
Îngrijirea rănilor
Poate unul dintre cele mai dificile și mai solicitante aspecte ale gestionării FCE este controlul local al efluentului. Succesulenteric ne poate rupe rapid pielea și poate provoca iritații care sunt dificil de tratat. Ca atare, gestionarea adecvată a pielii cu creme de protecție, bariere de umezeală, aparate de pungă și dispozitive de aspirare sunt primordiale. Fistulele cu debit mare, în special, necesită adesea o rețea complexă de drenaje, pungi și aspirație pentru a controla în mod adecvat efluentul. Echipele înalt specializate de îngrijire a plăgilor și terapeuții enterostomali sunt de neprețuit atât pentru gestionarea plăgilor, cât și pentru confortul pacientului.
Cu utilizarea omniprezentă a terapiei cu presiune negativă (NPT) pentru gestionarea plăgilor și a abdomenului deschis, nu este surprinzător faptul că NPT a devenit parte din arsenalul chirurgical pentru tratarea FECF. În cea mai mare serie de până acum, Wainstein et al. au raportat experiența lor cu 91 de pacienți cu fistule cu debit mare tratate cu presiune negativă cuprinsă între -350 și -600 mmHg. În plus față de scăderea semnificativă a debitului de efluent de la o medie de 1400 cc/zi la 138 cc/zi, s-a obținut închiderea spontană la 46% dintre pacienți.În 2016, Misky et al. au publicat o meta-analiză care a investigat utilizarea NPT în ECF. Folosind zece studii retrospective cu un total de 151 de pacienți, acești autori au constatat că rata mediană de închidere spontană a fost de 65% (variind de la 7%-100%), cu un timp median până la închidere de 58 de zile. Acești cercetători au raportat, de asemenea, o rată de noi fistule de 4,4% – o complicație cunoscută care a dat de gândit unor practicieni.Deși sunt în mod clar necesare mai multe investigații pentru a determina dacă NPT poate îmbunătăți în mod definitiv ratele de închidere a ECF sau reduce timpul până la închiderea spontană, beneficiile pozitive ale acestor pansamente nu ar trebui să fie trecute cu vederea. Cel puțin, această tehnologie poate facilita gestionarea FCE prin controlul efluenților, protejarea pielii și reducerea frecvenței schimbării pansamentelor.
Tabelul 3

| Investigatorii | Practica instituțională |
|---|---|
| Hollington | 8 luni |
| Evenson | 4 luni |
| Rahbour | 12 Luni |
| Datta | 6 Luni |
| Lynch | 6 Luni |
| Li | 6 luni |
| Mcintyre | 6 luni |
Tabelul 3: Timpul până la managementul definitiv.
Tabelul 3
Timpul până la managementul definitiv.
Nutriție
EvaluareStarea nutrițională a unui pacient cu ECF este de o importanță primordială. Înainte de apariția formulelor enterale pe bază de peptide și a nutriției parenterale totale (TPN), seriile istorice retrospective evidențiază povara malnutriției la pacienții cu ECF. Într-o serie de 157 de pacienți din anii 1950 și 1960, aproape 75% dintre pacienții cu fistule proximale erau malnutriți. Rezultate similare au fost raportate deChapman et al. care au constatat că doar o mică minoritate de pacienți aveau o nutriție optimă; și că odată ce nutriția a fost îmbunătățită, mortalitatea legată de ECF a scăzut de la 55% la 12-16%.
O evaluare nutrițională completă ar trebui efectuată la fiecare pacient cu o ECF. Deși ecuația Harris-Benedict oferă un bun punct de plecare pentru calcularea necesarului nutrițional, este larg acceptat faptul că pacienții cu ECF sunt catabolici și hipermetabolici.În general, acești pacienți au nevoie de un suport caloric sporit cu cel puțin 25-30 kcal/kg/zi în carbohidrați și grăsimi și 1,5 până la 2 grame de proteine/kg/zi.
Starea nutrițională și progresul trebuie reevaluate în mod regulat. În plus față de greutățile zilnice, ar trebui urmărite analizele regulate de nutriție, cum ar fi, albumina, prealbum in, transferul și CRP.S-a demonstrat că albumina preoperatorie, în special, este cel mai puternic predictor al mortalității și morbidității după o intervenție chirurgicală generală, iar hipoalbuminemia rămâne un predictor semnificativ al rezultatelor slabe la pacienții cu ECF. Cu toate acestea, probabil cea mai studiată proteină din ECF este transferrina, iar nivelurile mai mari de 140 au fost asociate cu rate mai mari de închidere spontană și cu o mortalitate redusă. Deși balanța de azot poate fi un instrument util, această măsură standard poate fi dificilă la pacienții cu fistule cu debit ridicat. Teste suplimentare, cum ar fi calorimetria indirectă, pot fi luate în considerare în cazurile mai complexe care nu răspund la tratamentul standard.
Nutriția parenterală vs. nutriția enterală
Nutriția parenterală a jucat un rol critic în managementul FEC, utilizarea sa fiind ferm stabilită de Dudrick în 1969.În articolul său sentinelă care descrie managementul optim al TPN, Dudrick a concluzionat că: „cu utilizarea exclusivă a hiperalimentării parenterale, se obține o creștere în greutate, un echilibru pozitiv al azotului, creștere și dezvoltare în mod regulat”. De atunci, NPT a fost adoptată în mod universal ca mijloc de furnizare a nutriției, promovând în același timp „odihna intestinală” și simplificând gestionarea efluenților.În timp ce NPT reduce secrețiile gastrointestinale cu 30%-50%, reducând astfel incidența deshidratării și a dezechilibrelor electrolitice, nu există studii randomizate care să abordeze impactul NPT asupra conversiei anabolice, a ratelor de închidere spontană sau a mortalității. Cu toate acestea, NPT rămâne o modalitate populară de tratament pe termen lung, în ciuda complicațiilor grave, inclusiv infecția și disfuncția hepatică.
Mai recent, totuși, utilizarea nutriției enterale în ECF a început să câștige teren. Utilizarea nutriției enterale are o serie de avantaje, inclusiv costuri reduse, mai puține infecții și o funcție imunologică îmbunătățită în comparație cu NPT . Mai mult, chiar și furnizarea a doar 20% din calorii pe cale enterală poate contribui la menținerea florei intestinale și la scăderea translocației bacteriene.
Diferite serii au raportat un succes surprinzător al alimentației enterale la pacienții cu ECF. Într-o serie retrospectivă realizată de Li et al. 86,4% din 1168 de pacienți au fost gestionați eficient cu suport enteral.Alimentația enterală poate fi utilizată cu succes chiar și în cazul unei fistule cu debit mare, atunci când este combinată cu formule elementare, agenți antimotilitate și agenți de încărcare a fibrelor. Într-o serie de 335 de pacienți cu fistule cu debit mare, Levy et al. au reușit să obțină cu succes independența TPN la 85% din cohorta lor folosind alimentația enterală. În mod interesant,în ciuda alimentației enterale și a lipsei de „repaus intestinal”, mortalitatea și ratele de închidere spontană au fost similare cu cele din seriile anterioare.
În cazul unei FCE cu debit mare și cu un membru distal mucocutanat, fistulocliza poate fi un adjuvant important la alimentația enterală standard. Practica fistuloclizei își are originea în practica de realimentare a chimului la nou-născuți și se poate referi fie la realimentarea din nou a sugarilor, fie la suplimentarea alimentației suplimentare cu tuburi enterale prin intermediul unui cateter plasat în membrul distal al unui ECF. Teubner și colab. au descris pentru prima dată fistulocliza ca terapie pentru ECF în 2004, într-o serie de cazuri de doisprezece pacienți cu fistule proximale. De atunci, o serie de rapoarte de caz și serii mici au demonstrat eficacitatea nutrițională a acestei tehnici. În comparație cu o cohortă de pacienți care au primit ECF fără fistulocliză, pacienții cu fistulă cu debit mare tratați cu fistulocliză au prezentat o îmbunătățire semnificativă a funcției hepatice și a parametrilor nutriționali . Fistulocliza poate fi deosebit de utilă la pacienții care dezvoltă complicații legate de NPT, inclusiv infecții, probleme de acces venos sau insuficiență hepatică. Cu toate acestea, pot apărea complicații și pot include obstrucția în cazul în care activitatea peristaltică a intestinului subțire avansează cateterul fistulei distal în intestinul subțire.
Vitaminele și mineralele sunt adesea deficitare la pacienții cu ECF.Deficiențele în vitaminele liposolubile sunt frecvente, în timp ce deficiențele în vitaminele hidrosolubile sunt rare, cu excepția cazului în care fistula se află în jejunul proximal. Mai mult decât atât, deoarece vitamina B12 este absorbită numai în cei 50-60 cm terminali ai ileonului, este posibil ca mulți pacienți cu FCE să aibă nevoie de vitamina B12 injectabilă. Magneziul este frecvent irosit în fistulele cu debit mare și ar trebui să fie completat fie cu sulfat de magneziu intravenos, fie cu clorură de magneziu pe cale orală pentru o mai bună absorbție enterală. În cele din urmă, a fost recomandată o doză mare de zinc și vitamina C . În timp ce Omega-3 și uleiul de pește au fost studiate în mediul de terapie intensivă cu unele beneficii, aceste suplimente nu au fost niciodată evaluate la pacienții cu ECF și nu sunt utilizate în mod obișnuit.
Considerații operaționale
Rata de închidere spontană a ECF variază între 15 și 75% în literatura de specialitate. Această gamă largă de rate de închidere reflectă probabil diferențele dintre populațiile de pacienți și modelele de practică instituțională . Este mult mai puțin probabil ca fistulele să se închidă spontan după 4 săptămâni, doar 10% din fistule închizându-se după două luni. Deoarece ratele de închidere spontană a FCE sunt scăzute, intervenția chirurgicală este adesea singura strategie definitivă de management.
Declarația de a opera o FCE, totuși, nu ar trebui luată cu ușurință, deoarece ratele de recidivă în urma îndepărtării FCE variază între 13 și 34% . Deși principiile intervenției chirurgicale pentruECF implică multe dintre principiile de bază ale chirurgiei generale, timpul până la operație este poate cel mai important factor de luat în considerare. Fazioet al. au demonstrat importanța managementului de așteptare în cazul pacienților cu ECFs. Atunci când intervenția chirurgicală a avut loc la mai puțin de 6 săptămâni de la momentul formării ECF, mortalitatea a depășit 20%. Cu toate acestea, prin întârzierea operației cu mai mult de 6 săptămâni, mortalitatea a scăzut la 11%.Mai mult, operația timpurie poate duce la creșterea riscului de recidivă. Într-o serie realizată de Lynch și colab., pacienții operați între 2 și 12 săptămâni de formare a ECF au avut o rată de recidivă de 28%, în timp ce o întârziere mai mare de 12 săptămâni a scăzut această rată la 15% . Tabelul 3 arată perioada de timp pe care autorii experți sugerează să o aștepte înainte de a lua în considerare o intervenție chirurgicală pentru un ECF care nu se cicatrizează.
Managementul chirurgical ar trebui să fie urmărit numai cu investiția și înțelegerea deplină atât a pacientului cât și a chirurgului. ECF-urile sunt cazuri lungi, dificile din punct de vedere tehnic, cu risc de complicații semnificative. Operațiile necesită adesea o mobilizare completă a intestinului de la Ligamentul de Treitz până la rect.Având în vedere că 36% dintre fistulele recurente sunt rezultatul unor leziuni create în timpul operației de închidere a ECF, trebuie să se acorde o mare atenție pe parcursul lizei aderențelor pentru a evita orice leziune involuntară a intestinului sănătos. Tratamentul intestinului fistulos trebuie să includă întotdeauna o rezecție intestinală și o astomie primară. Supracoaserea sau rezecția de margine a fistulei duce invariabil la o recidivă mai mare (36% vs. 16%).
Concluzie
Fistula entero-cutanată este una dintre cele mai dificile complicații cu care se confruntă chirurgul generalist. Utilizarea unei abordări atente,sistematice și centrate pe pacient va ajuta la maximizarea rezultatelor clinice de succes. În ciuda consecvenței principiilor de gestionare a FCE la toți pacienții, fiecare fistulă este unică, iar gestionarea acesteia este definită în mare parte de producția sa, precum și de localizarea și comorbiditățile pacientului. Experiența specifică a chirurgului și a instituției subliniază importanța intervenției întârziate.Cu toate că atât chirurgii, cât și pacienții pot avea o dorință puternică de a trece la închiderea chirurgicală, pacienții sunt cel mai bine deserviți de cel puțin 6 luni de gestionare neoperatorie. În cele din urmă, îngrijirea pe termen lung a pacienților cu ECF necesită, de multe ori, un tratament multidisciplinar coordonat de chirurg.
- Hollington P, Mawdsley J, Lim W, Gabe SM, Forbes A, Windsor AJ. O experiență de 11 ani de fistulă enterocutanată. Br J Surg. 2004; 91:1646-51.
- Li J, Ren J, Zhu W, Yin L, Han J. Managementul fistulelor enterocutanate: Experiență clinică de 30 de ani. Chin Med J (Engl). 2003;116:171-5.
- McIntyre PB, Ritchie JK, Hawley PR, Bartram CI, Lennard-Jones JE. Management of enterocutaneous fistulas: O analiză a 132 de cazuri. Br J Surg. 1984;71:293-6.
- Soeters PB, Ebeid AM, Fischer JE. Revizuirea a 404 pacienți cu fistule gastrointestinale. Impactul nutriției parenterale. Ann Surg. 1979;190:189-202.
- Rahbour G, Gabe SM, Ullah MR, Thomas GP, Al-Hassi HO, Yassin NA, et al. Experiența de șapte ani de fistulă enterocutanată cu analiza univariată și multivariată a factorilor asociați cu vindecarea: dezvoltarea unui sistem de notare validat. Colorectal Dis. 2013;15:1162-70.
- Gonzalez-Pinto I, Gonzalez EM. Optimizarea tratamentului fistulelor gastrointestinale superioare. Gut. 2001;49 Suppl 4:iv22-31.
- Lloyd DA, Gabe SM, Windsor AC. Nutriția și managementul fistulei enterocutanate. Br J Surg. 2006;93:1045-55.
- Berry SM, Fischer JE. Clasificarea și fiziopatologia fistulelor enterocutanate. Surg Clin North Am. 1996;76:1009-18.
- Fischer JE. Fiziopatologia fistulelor enterocutanate. World J Surg. 1983;7:446-50.
- Draus JM, Jr., Huss SA, Harty NJ, Cheadle WG, Larson GM. Fistula enterocutanată: se îmbunătățesc tratamentele? Chirurgie. 2006;140:570-6.
- Martinez JL, Luque-de-Leon E, Mier J, Blanco-Benavides R, Robledo F. Managementul sistematic al fistulelor enterocutanate postoperatorii: factori legați de rezultate. World J Surg. 2008;3:436-43.
- Misky A, Hotouras A, Ribas Y, Ramar S, Bhan C. A systematic literature review on the use of vacuum assisted closure for enterocutaneous fistula. Colorectal Dis. 2016;18:846-51.
- Campos AC, Andrade DF, Campos GM, Matias JE, Coelho JC. Un model multivariat pentru a determina factorii de prognostic în fistulele gastrointestinale. J Am Coll Surg. 1999;188:483-90.
- Levy E, Frileux P, Cugnenc PH, Honiger J, Ollivier JM, Parc R. High-output external fistulae of the small bowel: management with continuous enteral nutrition. Br J Surg. 1989;76:676-9.
- Lundy JB, Fischer JE. Perspective istorice în îngrijirea pacienților cu fistulă enterocutanată. Clin Colon Rectal Surg. 2010;23:133-41.
- Bleier JI, Hedrick T. Metabolic support of the enterocutaneous fistula patient. Clin Colon Rectal Surg. 2010;23:142-8.
- Teixeira PGR, Inaba K, Dubose J, Salim A, Brown C, Rhee P, et al. Fistula enterocutanată care complică laparotomia traumatică: O povară majoră de resurse. Am Surg. 2009;75:30-2.
- Irving M, White R, Tresadern J. Three years’ experience with an intestinal failure unit. Ann R Coll Surg Engl. 1985;67:2-5.
- Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. Fistule enterice: principii de gestionare. J Am Coll Surg. 2009;209:484-91.
- Gribovskaja-Rupp I, Melton GB. Fistula enterocutanată: Strategii dovedite și actualizări. Clin Colon Rectal Surg. 2016;29:130-7.
- McNaughton V, Canadian Association for Enterostomal Therapy ECFBPRP, Brown J, Hoeflok J, Martins L, McNaughton V, et al. Summary of best practice recommendations for management of enterocutaneous fistulae from the Canadian Association for Enterostomal Therapy ECF Best Practice Recommendations Panel. J Wound Ostomy Continence Nurs. 2010;37:173-84.
- Evenson AR, Fischer JE. Managementul actual al fistulei enterocutanate. Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract. 2006;10:455-64.
- Chapman R, Foran R, Dunphy JE. Managementul fistulelor intestinale. Am J Surg. 1964;108:157-64.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Campania Surviving sepsis: orientări internaționale pentru gestionarea sepsisului sever și a șocului septic: 2012. Crit Care Med. 2013;41:580-637.
- Hesse U, Ysebaert D, de Hemptinne B. Role of somatostatin-14 and its analogues in the management of gastrointestinal fistulae: clinical data. Gut. 2001;49:iv11-21.
- Wainstein DE, Fernandez E, Gonzalez D, Chara O, Berkowski D. Treatment of high-output enterocutaneous fistulas with a vacuum-compaction device. O experiență de zece ani. World J Surg. 2008;32:430-5.
- Edmunds LH, Jr., Williams GM, Welch CE. Fistule externe provenite din tractul gastro-intestinal. Ann Surg. 1960;152:445-71.
- Polk TM, Schwab CW. Susținerea metabolică și nutrițională a pacientului cu fistulă enterocutanată: o abordare în trei faze. World J Surg. 2012;36:524-33.
- Gibbs J, Cull W, Henderson W, Daley J, Hur K, Khuri SF. Nivelul preoperator al albuminei serice ca predictor al mortalității și morbidității operatorii: rezultate din Studiul național de risc chirurgical VA. Arch Surg. 1999;134:36-42.
- Martinez JL, Luque-de-Leon E, Ballinas-Oseguera G, Mendez JD, Juarez-Oropeza MA, Roman-Ramos R. Factori predictivi de recidivă și mortalitate după repararea chirurgicală a fistulei enterocutanate. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract. 2012;16:156-63; 63-4.
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE. Poate alimentația intravenoasă ca unic mijloc de nutriție să susțină creșterea la copil și să restabilească pierderea în greutate la un adult? Un răspuns afirmativ. Ann Surg. 1969;169:974-84.
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. Enteral versus parenteral nutrition in critically ill patients: an updated systematic review and meta-analysis of randomized controlled trials. Crit Care. 2016;20:117.
- Teubner A, Morrison K, Ravishankar HR, Anderson ID, Scott NA, Carlson GL. Fistulocliza poate înlocui cu succes alimentația parenterală în sprijinul nutrițional al pacienților cu fistulă enterocutanată. British Journal of Surgery. 2004;91:625-31.
- Ham M, Horton K, Kaunitz J. Fistulocliză: raport de caz și revizuire a literaturii. Nutr Clin Pract. 2007;22:553-7.
- Wu Y, Ren J, Wang G, Zhou B, Ding C, Gu G, et al. Fistulocliza îmbunătățește funcția hepatică și starea de nutriție la pacienții cu fistulă enterică superioară cu debit ridicat. Gastroenterol Res Pract. 2014;2014.
- Schecter WP. Managementul fistulelor enterocutanate. Surg Clin North Am. 2011;91:481-91.
- Haffejee AA. Managementul chirurgical al fistulelor enterocutanate cu debit ridicat: o experiență de 24 de ani. Curr Opin Clin Nutr Metab Care. 2004;7:309-16.
- Ross H. Chirurgia operatorie pentru fistula enterocutanată. Clin Colon Rectal Surg. 2010;23:190-4.
- Lynch AC, Delaney CP, Senagore AJ, Connor JT, Remzi FH, Fazio VW. Rezultatul clinic și factorii predictivi de recidivă după intervenția chirurgicală pentru fistula enterocutanată. Ann Surg. 2004;240:825-31.
- Runstrom B, Hallbook O, Nystrom PO, Sjodahl R, Olaison G. Outcome of 132 consecutive reconstructive operations for intestinal fistula–staged operation without primary anastomosis improved outcome in retrospective analysis. Scand J Surg. 2013;102:152-7.
- Reber HA, Roberts C, Way LW, Dunphy JE. Managementul fistulelor gastrointestinale externe. Ann Surg. 1978;188:460-7.
.