În ramura mediată celular a răspunsului imun adaptativ, peptidele scurte sunt legate de moleculele complexului major de histocompatibilitate (MHC) clasa I și clasa II și sunt prezentate la suprafața celulară unde sunt recunoscute de receptorii de antigen ai limfocitelor T. Legarea unui receptor de celule T (TCR) care recunoaște un anumit complex MHC-peptidă induce limfocitele naive să se diferențieze în celule efectoare (celule T citotoxice și celule T ajutătoare) care distrug celulele gazdă infectate sau stimulează producția de anticorpi și în celule de memorie care asigură imunitate protectoare împotriva reinfectării.
Structura și funcția moleculelor MHC
Două familii multigene situate în regiunea genomică MHC codifică moleculele de legare a antigenului care prezintă peptide străine la suprafața celulară. În realitate, moleculele MHC prezintă, de asemenea, peptide autoderivate. Cu toate acestea, selecția timică negativă împotriva celulelor T autoreactive împiedică complexele MHC-peptide proprii MHC să declanșeze un răspuns imunitar. Moleculele MHC de clasă I sunt exprimate pe majoritatea celulelor nucleate și prezintă, de obicei, peptide endogene derivate din agenți patogeni intracelulari care se replică în citosol (de exemplu, viruși). Proteinele citosolice sunt degradate în fragmente peptidice scurte de către proteazom și sunt mai întâi transportate în reticulul endoplasmatic (ER) de către transportatorii dependenți de ATP TAP1 & 2 pentru încărcarea MHCI și apoi la suprafața celulară pentru a fi prezentate celulelor T CD8+ citotoxice circulante, a căror funcție este de a induce apoptoza și liza celulei țintă infectate. (Figurile sunt adaptate după Murphy et al. (2008) Figurile 3.12, 3.25, 5.5, & 5.11.)
Expresia constitutivă a locilor MHC clasa II este limitată la celulele prezentatoare de antigen din sistemul imunitar (APC, de exemplu macrofage, celule dendritice și limfocite B). Moleculele MHCII sunt stabilizate și sunt împiedicate să se lege de antigen în timp ce sunt rezidente în ER prin asocierea cu lanțul invariant de clasă II (Ii sau CD74), iar apoi sunt redirecționate din calea secretorie implicită în calea endocitică. Acolo, ei întâlnesc peptide derivate din agenți patogeni care se replică în vezicule intracelulare sau din agenți patogeni extracelulari și proteine care sunt transportate în celulă. Legarea stabilă a peptidelor este catalizată de dimerul MHCII DMα/β neclasic și permite complexelor MHCII-peptide să scape din calea endocitică pentru a se prezenta la suprafața celulară. Recunoașterea de către celulele T CD4+ activează celula gazdă țintă pentru a stimula mecanismele antibacteriene (la macrofage) sau pentru a declanșa producția de anticorpi și răspunsul imun umoral.
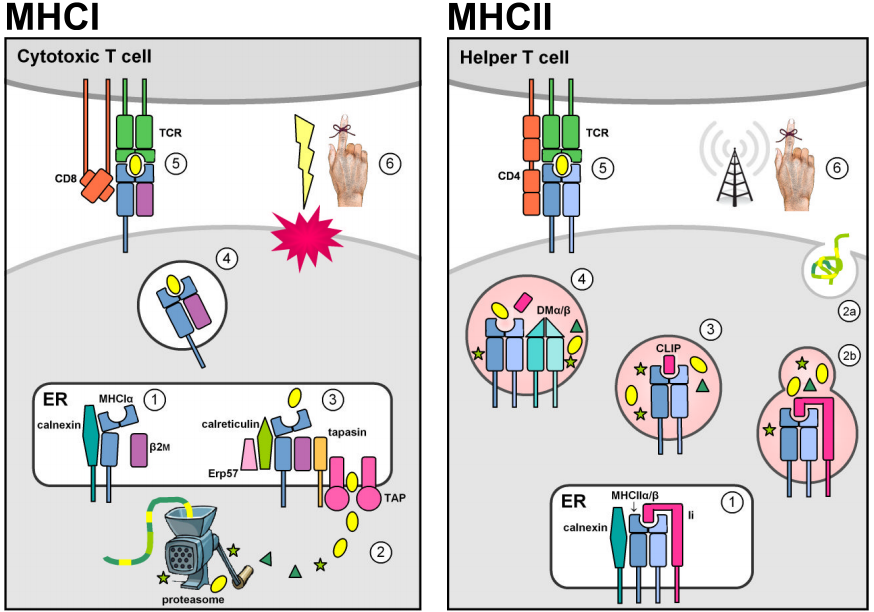
Similitudinile structurale ale moleculelor MHCI și MHCII reflectă probabil descendența lor dintr-un strămoș comun. Moleculele MHC mature sunt glicoproteine membranare integrale de tip I, compuse dintr-un șanț de legare a peptidelor și domenii asemănătoare imunoglobulinelor, transmembranare și citoplasmatice. Porțiunile extracelulare ale moleculelor MHC constau din două domenii membranare-distale care formează împreună o cavitate de legare a peptidelor care este delimitată de două elice α întrerupte care se sprijină pe o foaie β antiparalelă și două domenii asemănătoare imunoglobulinelor (asemănătoare Ig) apropiate de membrană care participă la legarea coreceptorilor CD4 și CD8.
În ciuda acestor asemănări structurale, subunitățile proteice sunt codificate diferit pentru moleculele de clasa I și II. Moleculele MHCI sunt heterodimeri formați prin asocierea necovalentă între un lanț greu MHCIα și β2-microglobulina (β2m), care este codificată de un locus în mare parte invariabil situat în afara regiunii genomice MHC. Lanțul greu contribuie atât la fanta de legare a peptidelor, cât și la unul dintre domeniile de tip Ig, în timp ce β2m furnizează doar o a doua regiune de tip Ig căreia îi lipsește o ancoră transmembranară. Moleculele MHC clasa II sunt heterodimeri care se formează prin asocierea necovalentă a unui lanț α și a unui lanț β, ambii contribuind cu un singur domeniu de legare a peptidelor și cu domenii de tip Ig cu ancorare membranară și fiecare dintre acestea fiind transcris dintr-un locus distinct care se găsește de obicei în regiunea MHC.
Membrii familiei de gene MHC pot fi subdivizați în continuare în loci clasici sau neclasici, pe lângă pseudogene nefuncționale. Loci clasici MHC Ia sunt exprimați pe scară largă și sunt de obicei asociați cu o variabilitate ridicată a secvenței și cu o selecție pozitivă care acționează asupra substituțiilor la nivelul reziduurilor din regiunea de legare a peptidelor (PBR). În schimb, loci MHC Ib neclasici au o expresie redusă sau o distribuție tisulară limitată, un polimorfism mai scăzut și pot avea funcții restrânse sau modificate. Pentru genele de clasă II, termenul „clasic” se referă de obicei la toți loci de prezentare a antigenului, în timp ce termenul „neclasic” este rezervat pentru gene precum DMα/β care îndeplinesc roluri accesorii în calea de prezentare a antigenului. Deși această clasificare funcțională a membrilor familiei de gene oferă un vocabular de lucru util, granița dintre loci clasici și nonclasici nu este întotdeauna clară în practică, iar unii loci MHCI nonclasici sunt polimorfici, se exprimă pe scară largă sau se leagă de liganzi peptidici în maniera tradițională a genelor clasice.
Primorfismul extrem la nivelul populației și dovezile de selecție de echilibrare indică faptul că este probabil să fie necesară o variație alelică substanțială a genelor MHC pentru a recunoaște și a răspunde la un ansamblu divers de agenți patogeni. Cu toate acestea, în ciuda duplicării extinse a genelor la unele specii, indivizii exprimă, de obicei, doar un număr moderat de loci MHC clasici, iar revenirea la moștenirea disomică este, de asemenea, observată la unele specii de Xenopus poliploide. Se consideră că restricțiile privind variația MHC intraindividuală (cel puțin pentru loci clasici foarte bine exprimați) reflectă un compromis funcțional între creșterea repertoriului alelic pentru a prezenta o varietate mai mare de peptide patogene și reducerea corespunzătoare a repertoriului de celule T care ar fi necesară pentru a menține autotoleranța. Moleculele MHC individuale trebuie, prin urmare, să fie capabile de o legare permisivă a peptidelor pentru a recunoaște în mod adecvat o gamă largă de antigene străine. Cu toate acestea, este necesar, de asemenea, să se genereze complexe MHC-peptide stabile, care să persiste o durată suficientă pentru a permite recunoașterea celulelor T și care să nu schimbe peptide la suprafața celulară, ceea ce ar putea duce la distrugerea celulelor neinfectate. O astfel de stabilitate este, în general, asociată cu interacțiuni intermoleculare de mare afinitate și, prin urmare, restrictive.
Moleculele MHC reconciliază aceste cerințe de legare concurente printr-o soluție structurală elegantă: contactele dintre reziduurile foarte conservate din regiunea de legare a peptidelor (PBR) a moleculei MHC și atomii lanțului principal al peptidei stabilizează legarea promiscuă a majorității liganzilor peptidici, în timp ce reziduurile polimorfe care căptușesc șanțul de legare a peptidelor creează buzunare neregulate cu stereochimie diferită care găzduiesc reziduuri peptidice într-o manieră dependentă de secvență. Restricțiile impuse de buzunarele de legare a catenei laterale variază atât între alele, cât și între buzunarele dintr-o singură moleculă MHC. Se spune că buzunarele care impun cerințe de legare mai stricte găzduiesc reziduuri peptidice de „ancoră primară”, în timp ce „ancorele secundare” sunt mai flexibile în preferințele lor de legare. Împreună, aceste specificități determină motivul de legătură peptidică al unei anumite alele MHC pentru a conferi selectivitate la prezentarea antigenului.