En elektrokemisk cell består i sin enklaste form av två elektronledare som är åtskilda av en jonledare och förbundna med en elektronledare.
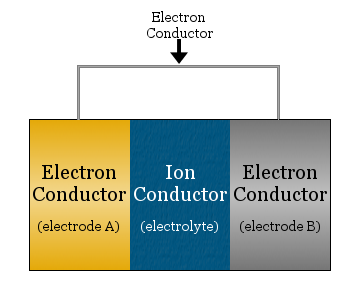
- Ionledaren kallas elektrolyt
- Elektronledarna som skiljs åt av elektrolyten kallas elektroder
- Elektronledaren som används för att förbinda elektroderna är ofta en metalltråd, t.ex. kopparledningar
Två typer av celler
Det finns två grundläggande typer av elektrokemiska celler: galvaniska och elektrolytiska.
Energieomvandlingen sker genom spontana (ΔG < 0) redoxreaktioner som producerar ett flöde av elektroner.
Ett flöde av elektroner driver icke-spontana (ΔG ≥ 0) redoxreaktioner.
Exempel
- Ett batteri som driver något är ett exempel på en galvanisk cell.
- Uppladdningsbara batterier är exempel på båda typerna av celler: de fungerar som galvaniska celler när de driver en enhet och som elektrolytiska celler när de laddas upp.
- Exempel på elektrolytiska celler är också de som används för att dela upp vatten i vätgas och syre, och de som omvandlar aluminiummalm till aluminiummetall.
En källa till termodynamiska data
Förutom praktiska användningsområden, som de som beskrivs ovan, utgör elektrokemiska celler ett utmärkt sätt att samla in termodynamiska data.De gör det till exempel möjligt att bestämma standardredoxpotentialer, varifrån man på ett smidigt sätt kan få fram data om standardenthalpier, standardentropier och standard-Gibbs fria energi för reaktioner.
Skilda reaktioner
Elektrokemiska celler kan:
- leverera elektricitet, eller
- konvertera metallmalmer till metall, eller
- tillhandahålla termodynamiska data,
omed anledning av att redoxreaktionerna äger rum separat.
Exempel: Daniell-cellen
I elektrokemiska celler sker reaktionerna vid separata elektroder – och själva elektroderna kan vara placerade i olika kärl.Se på en av de tidiga galvaniska cellerna, Daniell-cellen.
Daniellcellens energikälla är den spontana reaktionen mellan zinkmetall och kopparsulfat för att producera zinksulfat och kopparmetall.
ΔG° = -212.6 kJ mol-1
När materialen förs samman:
- i direkt kontakt i ett kärl omvandlas kemisk potentiell energi till värmeenergi och reaktionskärlet blir varmare
- i en elektrokemisk cell omvandlas kemisk potentiell energi till elektrisk energi
Daniellcellen
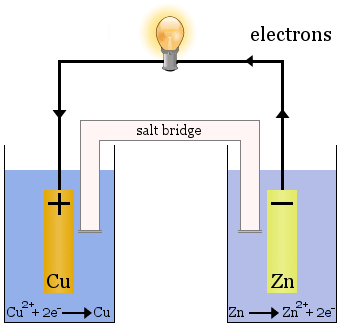
Daniellcellen består av två halvceller: Kopparjoner reduceras i den ena och zink oxideras i den andra.
När cellen fungerar avlägsnas Cu2+ från den ena cellen och Zn2+ produceras i den andra cellen.Kopparelektroden börjar växa när den pläteras med nyupplagd kopparmetall och zinkelektroden börjar minska på grund av förlusten av zink i form av joner till lösningen.
Saltbryggan i fallet ovan är en glasrörsrör som är fylld med mättad KNO3-lösning.Den har fritta i ändarna som förhindrar blandning av lösningarna i var och en av halvcellerna, men den tillåter joner att passera för att slutföra den elektriska kretsen och hålla varje halvcell elektriskt neutral.
Drivkraften är densamma ΔG° = -212.6 kJ mol-1 som erhålls när man helt enkelt blandar reaktanterna i ett kärl; genom att separera de två halvreaktionerna måste elektronerna passera genom ledningen och vi kan använda den elektriska energin.

.