- Review Article
- Enterokutan fistel: Evidensbaserad behandling
- Abstract
- Introduktion
- Tabell 1
- Tabell 1: Klassificering.
- Tabell 2
- Tabell 2: Prognostiska variabler för ECF.
- Klassificering
- Prognostiska faktorer för ECF
- Diagnos
- Figur 1
- Hantering
- Resuscitering
- Källkontroll
- Hantering av utflöde
- Sårvård
- Tabell 3
- Tabell 3: Tidsåtgång till slutgiltig behandling.
- Näring
- Slutsats
Review Article
Enterokutan fistel: Evidensbaserad behandling
Ryan P Dumas1*, Sarah A Moore1 och Carrie A Sims2
1Avdelningen för traumatologi, kirurgisk intensivvård & akutkirurgi, Perelman School of Medicine vid University of Pennsylvania, Philadelphia, PA, USA
2Avdelningen för kirurgi, Division of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
*Korresponderande författare: Ryan P Dumas, Department ofTraumatology, Surgical Critical Care& Emergency Surgery, PerelmanSchool of Medicine at the University of Pennsylvania, 51 N. 39th Street, MOBSuite 120, Philadelphia, PA 19104,USA
Abstract
Hanteringen av enterokutana fistlar är en klinisk färdighet som bör ingå i varje allmänkirurgs armamentarium. Även om den slutgiltiga behandlingen ofta är beroende av kirurgisk stängning är preoperativ vård och noggrannhet av största vikt för att säkerställa ett lyckat resultat. Vården av dessa patienter bör inriktas på fyra viktiga faser. Den första fasen kännetecknas av korrekt identifiering och återupplivning. Under den andra fasen görs en fullständig bedömning och planering av näringsläget. Radiografisk utvärdering under den tredje fasen hjälper till att definiera ECF-anatomin. Slutligen kännetecknas den fjärde fasen av definitiv stängning om fisteln misslyckas med att läka spontant.Denna genomgång kommer att fokusera på de viktigaste aspekterna som definierar varje fas och hjälper allmänkirurgen att maximera chanserna för ett positivt resultat.
Introduktion
Utvecklingen av en enterokutan fistel (ECF), definierad som en avvikande förbindelse mellan tarmlumen och den yttre huden, är en betydande källa till sjuklighet och mortalitet trots framsteg inom både kirurgisk och medicinsk vård. Den totala incidensen av ECF är dock okänd och de flesta uppgifter om ECF kommer i form av stora institutionella retrospektiva eller kirurgspecifika serier. Det är anmärkningsvärt att endast 25 % av alla ECF är sekundära till inflammatorisk tarmsjukdom, divertikelpatologi, trauma, strålning och malignitet . Däremot är nästan 75 % av alla ECF:er ett direkt resultat av antingen laparoskopisk eller öppen kirurgi, och över 50 % av dessa fistlar orsakas av ett astomotiskt läckage efter en enterektomi. Oavsiktliga iatrogena skador som t.ex. enterotomier eller oidentifierad värmeskada som uppkommit under en operation står för de återstående fistlarna . Eftersom ECF oftast är ett problem som orsakas av kirurgen är det kirurgen som har ansvaret för förebyggande åtgärder och lämplig hantering, planering och slutgiltig behandling.
Morbiditeten och mortaliteten efter ECF är mycket hög. Uppskattningsvis 90 % av patienterna kommer att uppleva en ECF-relaterad morbiditet som sträcker sig från hudutslag till uttorkning och sepsis.Dessutom varierar mortaliteten till följd av ECF mellan 5 och 20 % och är beroende av ett antal faktorer, bland annat underliggande infektion och fistelns placering. Eftersom den främsta dödsorsaken hos patienter med ECF är sepsis är kontroll av källan fortfarande en av behandlingens hörnstenar. I retrospektiva serier noterades att dödligheten ökade 16 gånger vid sepsis och 22 gånger vid okontrollerad infektion . Därför kan en tidig och definitiv behandling av odränerade samlingar i kombination med kortvariga antimikrobiella medel avsevärt förbättra resultaten. I de flesta serier tycks mortaliteten också korrelera med fistelutgång och fistelplacering. Mortaliteten ökar från 26 % i fistlar med låg utmatning till 50 % i fistlar med hög utmatning med tanke på de vätske-, elektrolyt- och näringsmässiga utmaningar som är förknippade med ECF-hantering . Mortaliteten korrelerar också med platsen och minskar med mer distala fistlar. Medan jejunalfistlar har den högsta mortaliteten på 29 % och är betydligt mer utmanande att hantera, är mortaliteten från kolonfistlar den lägsta på 6 % .
Ovanpå patientens påverkan, som sträcker sig från både fysiologisk och psykologisk, innebär ECF-hanteringen en enorm påfrestning på hälso- och sjukvårdsresurserna. Det uppskattas att kostnaden för ECF-hantering är långt över 500 000 dollar och kräver ett multidisciplinärt team av nutritionister, sårvårdssjuksköterskor och kirurger för att säkerställa ett bra resultat . Betydelsen av högspecialiserade behandlingscentra bör inte underskattas och har visat sig minska dödligheten avsevärt från 42 % till 20 %.
Tabell 1

| Anatomisk | Proximal eller distal | Gastrisk, duodenal, jejunal, ileal, kolonialt |
| Fysiologisk | Hög, måttlig, låg produktion | Hög produktion >500 cc/dygn Måttlig 200-500 cc/dygn Låg produktion < 200 cc/dygn |
| Etiologi | Iatrogen vs. Spontan Traumatisk |
Malignt Bestrålning Inflammatorisk tarmsjukdom Divertikulär |
Tabell 1: Klassificering.
Tabell 1
Klassificering.
Tabell 2

| FAVORITERAT. | OFFENTLIGT |
|---|---|
| Näringsmässigt rikligt försett | Näringsmässigt utarmat |
| – Albumin >3.0 | -Lågt albumin, lågt transferrin |
| Lång fistelkanal (>2cm) | Kort fistel, multipla, komplexa fistlar |
| Divertikulär fistel | Stor enteral defekt (>1cm), synlig slemhinna |
| Låg produktion | Hög produktion (>500cc/dag) |
| Enstaka fistel | Förutlig strålning |
| Intestinal kontinuitet | Flera tidigare operationer |
| Indexoperation utförd vid samma centrum | Extern remittering till en hög-volymcenter |
Tabell 2: Prognostiska variabler för ECF.
Tabell 2
ECF prognostiska variabler.
Klassificering
Det finns inget universellt eller väletablerat klassificeringsschema förECF. Fistlar klassificeras i allmänhet anatomiskt, fysiologiskt eller efter sjukdomsprocess . Fistlar kan dessutom klassificeras efter mängden dagligt utflöde. Det är absolut nödvändigt att fistelutflödet dokumenteras noggrant eftersom mängden kan diktera förändringar i hanteringen. Tabell 1 beskriver tre olika klassificeringsparadigm.
Prognostiska faktorer för ECF
De prognostiska faktorerna för ECF har beskrivits mycket väl och överensstämmer med standardkirurgiska dogmer. Patienter med en proximal fistel med hög produktion åtföljd av ett lågt albumin(. Omvänt har patienter utan komorbiditeter som har fistlar som är resultatet av ett kirurgiskt ingrepp och har låg produktion ett bättre resultat med högre spontana slutarvärden. I tabell 2 beskrivs många av de variabler som kan förutsäga ett framgångsrikt resultat.
Vikten av institutionellt stöd och multidisciplinär expertis som en positiv prognostisk faktor kan inte nog betonas.Flera studier har bekräftat att institutionell erfarenhet och volym är kritiska faktorer när det gäller att minska morbiditeten och förbättra mortaliteten. Nyligen kodifierade Canadian Association for Enterostomal Therapy vikten av multidisciplinär vård genom att identifiera nio viktiga teammedlemmar i sina ”ECF Best Practice”-rekommendationer. Denna integrerade teamstrategi, som sträcker sig från kirurger till apotekare och läkare, erkänner den expertis som varje specialitet bidrar med när det gäller att ta hand om dessa komplexa patienter.
Diagnos
Ett smältande postoperativt förlopp som kompliceras av ileus och utveckling av en postoperativ sårinfektion är ett tecken på att det finns en risk för ECF. När en fistel misstänks eller har identifierats vid fysisk undersökning är radiologiska undersökningar nödvändiga komplement och 97 % av alla patienter genomgår någon form av radiologisk utvärdering. Kontrastförstärkt datortomografi är nödvändig, eftersom den gör det möjligt att upptäcka om det finns en associerad abscess eller en icke dränerad samling. När källkontrollen har optimerats spelar fluoroskopisk fistulografi en viktig roll för att definiera fistelns anatomi. Ett fistulogram hjälper till att lokalisera ursprunget, bestämma längden, utvärdera förekomsten av distalobstruktion och avgöra om fisteln är i kontinuitet med resten av tarmen. När diagnosen ECF väl har bekräftats bör fokus flyttas till behandling.
Figur 1
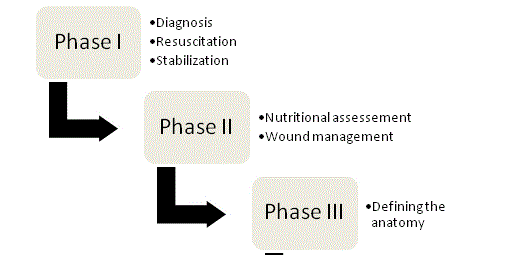
Figur 1
Fyra faser i förvaltningen av ECF.
Hantering
De grundläggande principerna för ECF-hantering förespråkades för första gången av Chapman och hans kollegor 1964, och de utgör fortfarande hörnstenarna i behandlingen. I sin ursprungliga artikel identifierade Chapman et al. fyra nyckelfaktorer: återupplivning av vätska, källkontroll, hantering av avloppsvatten och hudskydd. Vikten av näring har nyligen framkommit som en femte nyckelfaktor. Ett organiserat, systematiskt tillvägagångssätt bör tillämpas på varje fistelpatient för att optimera chanserna till ett lyckat resultat, och hanteringen kan i slutändan delas in i de fyra faserna (figur 1).
Resuscitering
Resuscitering av en patient med en nydiagnostiserad ECF följer många av samma principer som vid återupplivning av septiska patienter, och principerna i kampanjen Surviving Sepsis Campaign bör tjäna som ramverk. Den initiala vården bör inriktas på aggressiv vätskeåterupplivning, snabb bedömning och korrigering av elektrolytobalans och normalisering av mjölksyra. Patienter med ECF är vanligen hyponatremiska, hypokalemiska och acidotiska på grund av pågående gastrointestinala förluster.Patienter med högproducerande fistlar bör få vätske-, elektrolyt- och bikarbonatförlusterna ersatta intravenöst för att undvika uttorkning och djupgående metabolisk instabilitet under den inledande stabiliseringsperioden. Noggrann övervakning av urinproduktionen och riktad ersättning av fistelutflödet var fjärde till åttonde timme förhindrar pågående uttorkning.
Källkontroll
När patienten är återupplivad bör uppmärksamheten flyttas till att etablera källkontroll. Som tidigare nämnts är en kontrastförstärktCT-skanning viktig för att identifiera odränerade samlingar och abscesser. Hos postoperativa patienter är det mest troligt att källkontrollen utförs av interventionell radiologi. Vid otillgängliga ansamlingar eller okontrollerad intraabdominell sepsis kan dock en operation vara oundviklig. Bredspektrum, empiriska intravenösa antibiotika bör inte användas rutinmässigt för att behandla ECF såvida det inte finns bevis för intraabdominella ansamlingar eller sårinfektion med tillhörande cellulit. När det är möjligt bör antibiotika riktas mot specifika odlingsdata och begränsas till nomore än 2 veckor.
Hantering av utflöde
Hanteringen av utflöde vid framgång kan ha en betydande inverkan på volymstatus, elektrolytbalans, nutrition och hudintegritet.Adjungerad medicinsk hantering av ECF effluent har traditionellt fokuserat på två huvudområden: syraneutralisering och volymminskning.Användningen av protonpumpshämmare kan uppnå båda målen och dosen bör titreras tills effluentens pH är större än 6 ochvolymen av utflödet är mindre än 1L/dag . Även om psyllium kan vara ytterst användbart för att öka volymen i utflödet och öka transiteringstiden, är antimotitilitets- och antisekretoriska medel, inklusive loperamid, atropindifenoxylat, kodein, opiumtinktur och till och med metadon, den viktigaste metoden för att minska volymen. Med tanke på att somatostatin är en universell hormonhämmare i mag-tarmkanalen har mycket forskning ägnats åt att studera effekterna av exogent somatostatin på patienter med EKSF. Trots ett stort antal randomiserade kontrollerade studier är det svårt att dra några viktiga slutsatser på grund av att urvalet är litet och studiedesignen inkonsekvent. Octreotid, en somatostatinanalog med längre verkningstid, har också undersökts som tillägg till ECF med lovande resultat. Octreotid 100 mcg tre gånger dagligen kan minska utflödesvolymen och har i vissa studier visat sig minska tiden till spontan stängning. Det kan därför vara motiverat att pröva oktreotidbehandling i 72 timmar med noggrann övervakning av fistelns utflöde, särskilt i de fall där andra behandlingar inte har lyckats minska utflödesvolymen. Vanliga biverkningar är bland annat hyperglykemi, huvudvärk och kolelithiasis.
Men det är tydligt att fistlar med låg utmatningsvolym har en ökad risk för spontan stängning, men det är inte lika tydligt att en minskning av utmatningsvolymen kommer att förbättra stängningen av fisteln. Trots detta kan en minskning av utflödesvolymen avsevärt underlätta fistelhanteringen och ha en positiv inverkan på patientens välbefinnande.
Sårvård
En av de kanske mest utmanande och resurskrävande aspekterna av ECF-hanteringen är den lokala kontrollen av avloppsvattnet. Framgångsrikenteri kan snabbt bryta ner huden och orsaka irritation som är svår att behandla. Därför är lämplig hudbehandling med barriärkrämer, fuktbarriärer, påsar och sugutrustning av största vikt. Särskilt fistlar med hög produktion kräver ofta ett invecklat nätverk av dräneringar, påsar och sug för att kontrollera utflödet på ett adekvat sätt. Högspecialiserade sårvårdsteam och enterostomaterapeuter är ovärderliga för både sårbehandling och patientens komfort.
Med tanke på den allestädes närvarande användningen av negativtrycksterapi (NPT) för behandling av sår och öppna bukhålor är det inte förvånande att NPT har blivit en del av den kirurgiska utrustningen för att ta hand om ECF. I den största serien hittills rapporterade Wainstein et al. sin erfarenhet av 91 patienter med högflödesfistlar som behandlats med ett negativt tryck på mellan -350 och -600 mmHg. Förutom en betydande minskning av utflödet från i genomsnitt 1400 cc/dag till 138 cc/dag, uppnåddes spontan stängning hos 46 % av patienterna. 2016 publicerade Misky et al. en metaanalys som undersökte användningen av NPT vid ECF. Med hjälp av tio retrospektiva studier med sammanlagt 151 patienter fann dessa författare att medianvärdet för spontan stängning var 65 % (med en variation från 7 % till 100 %) med en mediantid till stängning på 58 dagar. Dessa forskare rapporterade också en ny fistelfrekvens på 4,4 % – en känd komplikation som har fått vissa utövare att tveka.Även om det krävs ytterligare undersökningar för att fastställa om NPT definitivt kan förbättra antalet stängningar av ECF eller förkorta tiden till spontan stängning, får man inte bortse från de positiva fördelarna med dessa förband. Denna teknik kan åtminstone underlätta hanteringen av ECF genom att kontrollera utflödet, skydda huden och minska frekvensen av förbandsbyten.
Tabell 3

| Investigatörer | Institutionell praxis |
|---|---|
| Hollington | 8 månader |
| Evenson | 4 månader |
| Rahbour | 12 månader |
| Datta | 6 månader |
| Lynch | 6 månader |
| Li | 6 månader |
| Mcintyre | 6 månader |
Tabell 3: Tidsåtgång till slutgiltig behandling.
Tabell 3
Tidsperspektiv till definitiv behandling.
Näring
BedömningNäringsstatusen hos en ECF-patient är av yttersta vikt. Före introduktionen av peptidbaserade enterala formler och total parenteral nutrition (TPN) belyser retrospektiva historiska serier den stora bördan av undernäring hos ECF-patienter. I en serie med 157 patienter från 1950- och 1960-talen var nästan 75 % av patienterna med proximala fistlar undernärda. Liknande resultat rapporterades av Chapman et al. som fann att endast en liten minoritet av patienterna hade optimal nutrition och att när nutritionen förbättrades sjönk den ECF-relaterade dödligheten från 55 % till 12-16 %.
En fullständig nutritionsbedömning bör utföras på alla patienter med ECF. Även om Harris-Benedict-ekvationen är en bra utgångspunkt för att beräkna näringsbehovet är det allmänt accepterat att ECF-patienter är katabola och hypermetaboliska.I allmänhet behöver dessa patienter ökat kaloriunderstöd med minst 25-30 kcal/kg/dag i form av kolhydrater och fett och 1,5 till 2 gram protein/kg/dag.
Näringsstatus och framsteg bör utvärderas regelbundet. Förutom den dagliga vikten bör regelbundna näringslaboratorier, t.ex. albumin, prealbumin, överföring och CRP, följas upp.Särskilt albumin före operation har visat sig vara den starkaste förutsägelsefaktorn för dödlighet och sjuklighet efter kirurgiska ingrepp, och hypoalbuminemi är fortfarande en viktig förutsägelse för dåliga resultat hos ECF-patienter. Det kanske mest studerade proteinet i ECF är dock transferrin, och nivåer över 140 har förknippats med ökad spontan stängning och minskad dödlighet . Även om kvävebalansen kan vara ett användbart verktyg kan detta standardmått vara svårt hos patienter med fistlar med högt utflöde. Ytterligare tester som indirekt kalorimetri kan övervägas i mer komplexa fall som inte svarar på standardbehandling.
Parenteral vs enteral nutrition
Parenteral nutrition har spelat en avgörande roll i hanteringen av ECF med dess användning som fast etablerades av Dudrick 1969.I sin sentinelartikel som beskrev den optimala hanteringen av TPN drog Dudrick slutsatsen att: ”Med uteslutande användning av parenteral hyperalimentation uppnås regelbundet viktökning, positiv kvävebalans, tillväxt och utveckling”. Sedan dess har TPN antagits allmänt som ett sätt att tillhandahålla näring samtidigt som man främjar ”tarmvila” och förenklar hanteringen av avloppsvatten.Medan TPN minskar GI-sekretet med 30-50 %, vilket minskar förekomsten av uttorkning och elektrolytobalans, finns det inga randomiserade studier som tar upp TPN:s inverkan på anabolisk omvandling, spontant slutande eller mortalitet. Trots detta förblir TPN en populär långsiktig behandlingsmetod trots allvarliga komplikationer som infektion och leverdysfunktion.
På senare tid har dock användningen av enteral nutrition vid ECF fått allt större genomslag. Användningen av enteral nutrition har ett antal fördelar, bland annat minskade kostnader, färre infektioner och förbättrad immunologisk funktion jämfört med TPN . Dessutom kan till och med så lite som 20 % av kalorierna via en enteral väg bidra till att upprätthålla tarmfloran och minska bakterietranslokationen.
Flera serier har rapporterat överraskande framgångar med enteral nutrition hos ECF-patienter. I en retrospektiv serie av Li et al. hanterades 86,4 % av 1168 patienter på ett effektivt sätt med enteralt stöd.Enteral nutrition kan till och med användas framgångsrikt vid högproducerande fistlar när den kombineras med elementära formler, antimotilationsmedel och fiberfyllnadsmedel. I en serie på 335 patienter med högflödesfistlar kunde Levy et al. framgångsrikt uppnå TPN-oberoende hos 85 % av sin grupp med hjälp av enteral nutrition. Intressant nog, trots enteral näring och avsaknaden av ”tarmvila”, var mortaliteten och graden av spontan stängning likartad med tidigare serier.
I samband med en högproducerande ECF med en distal mukokutan lem kan fistuloklys vara ett viktigt komplement till standard enteral näring. Fistuloklys har sitt ursprung i praxis för utfodring av syre hos nyfödda och kan hänvisa till antingen återmatning av sugga eller komplettering av ytterligare enteral sondmatning via en kateter som är placerad i den distala delen av en ECF. Teubner et al. beskrev först fistuloklys som behandling av ECF 2004 i en fallserie av tolv patienter med proximala fistlar. Sedan dess har ett antal fallrapporter och små serier visat att denna teknik är effektiv i näringshänseende. Jämfört med en matchad kohort av patienter som fått TEN utan fistuloklys hade patienter med högflödesfistlar som behandlats med fistuloklys avsevärt förbättrade leverfunktions- och näringsparametrar . Fistuloklys kan vara särskilt användbart för patienter som utvecklar TPN-relaterade komplikationer, inklusive infektioner, problem med venös anslutning eller leversvikt. Komplikationer kan dock förekomma och kan inkludera obstruktion om tunntarmens peristaltiska aktivitet skulle föra fistelkatetern distalt in i tunntarmen.
Vitaminer och mineraler är ofta utarmade hos ECF-patienter.Brister i fettlösliga vitaminer är vanliga, medan brister i vattenlösliga vitaminer är sällsynta, såvida inte fisteln ligger i den proximala jejunum. Eftersom B12-vitamin endast absorberas i de sista 50-60 cm av ileum kan injicerbart B12-vitamin behövas hos många ECF-patienter. Magnesium slösas ofta bort i fistlar med hög produktion och bör fyllas på med antingen intravenöst magnesiumsulfat eller oral magnesiumklorid för förbättrad enteral absorption. Slutligen har det rekommenderats att man ska tillföra höga doser av både zink och C-vitamin. Omega-3 och fiskolja har studerats inom intensivvården med viss nytta, men dessa tillskott har aldrig utvärderats hos ECF-patienter och används inte rutinmässigt.
Operativa överväganden
Frekvensen för spontan stängning av ECF varierar mellan 15 och 75 % i litteraturen. Detta breda spektrum av stängningsfrekvenser återspeglar troligen skillnader i patientpopulationer och institutionella praxismönster. Det är betydligt mindre sannolikt att fistlar stängs spontant efter 4 veckor och endast 10 % av fistlarna stängs efter två månader. Eftersom andelen spontana stängningar av ECF är låg är kirurgiskt ingrepp ofta den enda definitiva behandlingsstrategin.
Beslutet att operera en ECF bör dock inte tas för lättvindigt eftersom återfallsfrekvensen efter att en ECF avlägsnats varierar mellan 13 och 34 % . Även om principerna för kirurgiskt ingrepp vid ECF omfattar många av de grundläggande principerna för allmän kirurgi, är tiden för operation kanske den viktigaste faktorn att ta hänsyn till. Fazioet al. har visat på vikten av att man väntar på behandling när man tar hand om ECF-patienter. När operationen skedde mindre än 6 veckor från tidpunkten för ECF-bildningen översteg dödligheten 20 %. Genom att fördröja operationen mer än 6 veckor minskade dock mortaliteten till 11 %.Dessutom kan en tidig operation eventuellt leda till ökad återfallsrisk. I en serie av Lynch et al. hade patienter som opererades mellan 2 och 12 veckor efter bildandet av ECF en recidivfrekvens på 28 %, medan en fördröjning på mer än 12 veckor minskade denna frekvens till 15 %. Tabell 3 visar den tid som expertförfattarna föreslår att man skall vänta innan man överväger ett operativt ingrepp vid en icke läkt ECF.
Operativ behandling bör endast ske med full investering och förståelse från både patient och kirurg. ECF-avslutningar är långa, tekniskt utmanande fall med risk för betydande komplikationer. Operationerna kräver ofta en fullständig mobilisering av tarmen från Treitz ligament till rektum.Med tanke på att 36 % av de återkommande fistlarna är resultatet av skador som uppstått under operationen för stängning av ECF, bör man vara mycket försiktig under hela lyseringen av adhesioner för att undvika oavsiktliga skador på den friska tarmen. Hanteringen av den fistulösa tarmen bör alltid omfatta en tarmresektion och en primär astomos. Om fisteln är överkörd eller om den är resekterad i kanten resulterar det alltid i ett högre antal återfall (36 % jämfört med 16 %).
Slutsats
Enterokutan fistel är en av de mest utmanande komplikationerna för allmänkirurgen. Genom att använda ett försiktigt, systematiskt och patientcentrerat tillvägagångssätt kan man maximera de framgångsrika kliniska resultaten. Trots att principerna för ECF-hantering är konsekventa för alla patienter är varje fistel unik och dess hantering bestäms till stor del av dess utflöde samt av dess läge och patientens samsjuklighet. Kirurgspecifik och institutionell erfarenhet understryker betydelsen av ett fördröjt ingripande.Även om både kirurger och patienter kan ha en stark önskan att fortsätta med en kirurgisk stängning är patienterna bäst betjänta av minst sex månaders icke-operativ behandling. I slutändan kräver den långsiktiga vården av ECF-patienter multidisciplinär vård som ofta samordnas av kirurgen.
- Hollington P, Mawdsley J, Lim W, Gabe SM, Forbes A, Windsor AJ. En 11-årig erfarenhet av enterokutan fistel. Br J Surg. 2004; 91:1646-51.
- Li J, Ren J, Zhu W, Yin L, Han J. Behandling av enterokutana fistlar: 30 års klinisk erfarenhet. Chin Med J (Engl). 2003;116:171-5.
- McIntyre PB, Ritchie JK, Hawley PR, Bartram CI, Lennard-Jones JE. Behandling av enterokutana fistlar: En genomgång av 132 fall. Br J Surg. 1984;71:293-6.
- Soeters PB, Ebeid AM, Fischer JE. Genomgång av 404 patienter med gastrointestinala fistlar. Påverkan av parenteral nutrition. Ann Surg. 1979;190:189-202.
- Rahbour G, Gabe SM, Ullah MR, Thomas GP, Al-Hassi HO, Yassin NA, et al. Seven-year experience of enterocutaneous fistula with univariate and multivariate analysis of factors associated with healing: development of a validated scoring system. Colorectal Dis. 2013;15:1162-70.
- Gonzalez-Pinto I, Gonzalez EM. Optimering av behandlingen av övre gastrointestinala fistlar. Gut. 2001;49 Suppl 4:iv22-31.
- Lloyd DA, Gabe SM, Windsor AC. Nutrition och behandling av enterokutana fistlar. Br J Surg. 2006;93:1045-55.
- Berry SM, Fischer JE. Klassificering och patofysiologi av enterokutana fistlar. Surg Clin North Am. 1996;76:1009-18.
- Fischer JE. Patofysiologi vid enterokutana fistlar. World J Surg. 1983;7:446-50.
- Draus JM, Jr., Huss SA, Harty NJ, Cheadle WG, Larson GM. Enterokutan fistel: förbättras behandlingarna? Kirurgi. 2006;140:570-6.
- Martinez JL, Luque-de-Leon E, Mier J, Blanco-Benavides R, Robledo F. Systematisk behandling av postoperativa enterokutana fistlar: faktorer relaterade till resultat. World J Surg. 2008;3:436-43.
- Misky A, Hotouras A, Ribas Y, Ramar S, Bhan C. A systematic literature review on the use of vacuum assisted closure for enterocutaneous fistula. Colorectal Dis. 2016;18:846-51.
- Campos AC, Andrade DF, Campos GM, Matias JE, Coelho JC. En multivariat modell för att fastställa prognostiska faktorer vid gastrointestinala fistlar. J Am Coll Surg. 1999;188:483-90.
- Levy E, Frileux P, Cugnenc PH, Honiger J, Ollivier JM, Parc R. High-output external fistulae of the small bowel: management with continuous enteral nutrition. Br J Surg. 1989;76:676-9.
- Lundy JB, Fischer JE. Historiska perspektiv i vården av patienter med enterokutana fistlar. Clin Colon Rectal Surg. 2010;23:133-41.
- Bleier JI, Hedrick T. Metabolic support of the enterocutaneous fistula patient. Clin Colon Rectal Surg. 2010;23:142-8.
- Teixeira PGR, Inaba K, Dubose J, Salim A, Brown C, Rhee P, et al. Enterokutan fistel vid traumalaparotomi: En stor resursbelastning. Am Surg. 2009;75:30-2.
- Irving M, White R, Tresadern J. Three years’ experience with an intestinal failure unit. Ann R Coll Surg Engl. 1985;67:2-5.
- Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. Enteriska fistlar: principer för behandling. J Am Coll Surg. 2009;209:484-91.
- Gribovskaja-Rupp I, Melton GB. Enterokutana fistlar: beprövade strategier och uppdateringar. Clin Colon Rectal Surg. 2016;29:130-7.
- McNaughton V, Canadian Association for Enterostomal Therapy ECFBPRP, Brown J, Hoeflok J, Martins L, McNaughton V, et al. Sammanfattning av rekommendationer för bästa praxis för hantering av enterokutana fistlar från Canadian Association for Enterostomal Therapy ECF Best Practice Recommendations Panel. J Wound Ostomy Continence Nurs. 2010;37:173-84.
- Evenson AR, Fischer JE. Aktuell behandling av enterokutan fistel. Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract. 2006;10:455-64.
- Chapman R, Foran R, Dunphy JE. Behandling av tarmfistlar. Am J Surg. 1964;108:157-64.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41:580-637.
- Hesse U, Ysebaert D, de Hemptinne B. Role of somatostatin-14 and its analogues in the management of gastrointestinal fistulae: clinical data. Gut. 2001;49:iv11-21.
- Wainstein DE, Fernandez E, Gonzalez D, Chara O, Berkowski D. Treatment of high-output enterocutaneous fistulas with a vacuum-compaction device. En tioårig erfarenhet. World J Surg. 2008;32:430-5.
- Edmunds LH, Jr., Williams GM, Welch CE. Externa fistlar som uppstår från mag-tarmkanalen. Ann Surg. 1960;152:445-71.
- Polk TM, Schwab CW. Metaboliskt och näringsmässigt stöd för patienten med enterokutan fistel: ett tillvägagångssätt i tre faser. World J Surg. 2012;36:524-33.
- Gibbs J, Cull W, Henderson W, Daley J, Hur K, Khuri SF. Preoperativ serumalbuminnivå som en prediktor för operativ dödlighet och morbiditet: resultat från National VA Surgical Risk Study. Arch Surg. 1999;134:36-42.
- Martinez JL, Luque-de-Leon E, Ballinas-Oseguera G, Mendez JD, Juarez-Oropeza MA, Roman-Ramos R. Faktorer som förutsäger återfall och dödlighet efter kirurgisk reparation av enterokutan fistel. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract. 2012;16:156-63; 63-4.
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE. Kan intravenös utfodring som enda näringsmedel stödja tillväxten hos ett barn och återställa viktförlust hos en vuxen? Ett jakande svar. Ann Surg. 1969;169:974-84.
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. Enteral versus parenteral nutrition in critically ill patients: an updated systematic review and meta-analysis of randomized controlled trials. Crit Care. 2016;20:117.
- Teubner A, Morrison K, Ravishankar HR, Anderson ID, Scott NA, Carlson GL. Fistuloklys kan framgångsrikt ersätta parenteral matning vid näringsstöd till patienter med enterokutan fistel. British Journal of Surgery. 2004;91:625-31.
- Ham M, Horton K, Kaunitz J. Fistuloclysis: case report and literature review. Nutr Clin Pract. 2007;22:553-7.
- Wu Y, Ren J, Wang G, Zhou B, Ding C, Gu G, et al. Fistuloclysis improves liver function and nutritional status in patients with high-output upper enteric fistula. Gastroenterol Res Pract. 2014;2014.
- Schecter WP. Hantering av enterokutana fistlar. Surg Clin North Am. 2011;91:481-91.
- Haffejee AA. Kirurgisk behandling av enterokutana fistlar med hög produktion: en 24-årig erfarenhet. Curr Opin Clin Nutr Metab Care. 2004;7:309-16.
- Ross H. Operativ kirurgi vid enterokutan fistel. Clin Colon Rectal Surg. 2010;23:190-4.
- Lynch AC, Delaney CP, Senagore AJ, Connor JT, Remzi FH, Fazio VW. Kliniskt resultat och faktorer som förutsäger återfall efter enterokutan fistelkirurgi. Ann Surg. 2004;240:825-31.
- Runstrom B, Hallbook O, Nystrom PO, Sjodahl R, Olaison G. Outcome of 132 consecutive reconstructive operations for intestinal fistula–staged operation without primary anastomosis improved outcome in retrospective analysis. Scand J Surg. 2013;102:152-7.
- Reber HA, Roberts C, Way LW, Dunphy JE. Hantering av externa gastrointestinala fistlar. Ann Surg. 1978;188:460-7.