Lärandemål
- Använda cellnotation för att beskriva galvaniska celler
- Beskriv de grundläggande komponenterna i galvaniska celler
Galvaniska celler, även kända som voltaiska celler, är elektrokemiska celler där spontana oxidations-reduktionsreaktioner producerar elektrisk energi. När man skriver ekvationerna är det ofta lämpligt att dela upp oxidations-reduktionsreaktionerna i halvreaktioner för att underlätta balanseringen av den övergripande ekvationen och för att betona de faktiska kemiska omvandlingarna.
Fundera på vad som händer när en ren kopparmetallbit placeras i en lösning av silvernitrat (figur 1). Så snart kopparmetallen tillsätts börjar silvermetallen att bildas och kopparjoner passerar in i lösningen. Den blå färgen på lösningen längst till höger indikerar förekomsten av kopparjoner. Reaktionen kan delas upp i sina två halvreaktioner. Halva reaktioner separerar oxidationen från reduktionen, så var och en kan betraktas individuellt.
Ekvationen för reduktionshalvreaktionen måste fördubblas så att antalet elektroner som ”vunnits” i reduktionshalvreaktionen motsvarade antalet elektroner som ”förlorats” i oxidationshalvreaktionen.

Galvaniska eller voltaiska celler innebär spontana elektrokemiska reaktioner där halvreaktionerna separeras (figur 2) så att strömmen kan flöda genom en extern tråd. Bägaren till vänster i figuren kallas halvcell och innehåller en 1 M lösning av kopparnitrat(II) med en kopparmetallbit delvis nedsänkt i lösningen. Kopparmetallen är en elektrod. Kopparn genomgår oxidation; därför är kopparelektroden en anod. Anoden är ansluten till en voltmeter med en tråd och voltmeterns andra terminal är ansluten till en silverelektrod med en tråd. Silvret genomgår reduktion och därför är silverelektroden katod. Halvcellen till höger i figuren består av silverelektroden i en 1 M lösning av silvernitrat (AgNO3). Vid denna punkt flyter ingen ström – det vill säga, ingen betydande rörelse av elektroner genom ledningen sker eftersom kretsen är öppen. Kretsen sluts med hjälp av en saltbrygga, som överför strömmen med rörliga joner. Saltbryggan består av en koncentrerad, icke-reaktiv elektrolytlösning, t.ex. den natriumnitratlösning (NaNO3) som används i det här exemplet. När elektronerna flödar från vänster till höger genom elektroden och tråden passerar nitratjoner (anjoner) genom den porösa pluggen till vänster in i kopparnitratlösningen (II). Detta håller bägaren till vänster elektriskt neutral genom att neutralisera laddningen på de koppar(II)-joner som bildas i lösningen när kopparmetallen oxideras. Samtidigt som nitratjonerna rör sig till vänster rör sig natriumjoner (katjoner) till höger, genom den porösa proppen och in i silvernitratlösningen till höger. Dessa tillsatta katjoner ”ersätter” de silverjoner som avlägsnas från lösningen när de reducerades till silvermetall, vilket gör att bägaren till höger hålls elektriskt neutral. Utan saltbryggan skulle avdelningarna inte förbli elektriskt neutrala och ingen betydande ström skulle flyta. Men om de två avdelningarna är i direkt kontakt är en saltbrygga inte nödvändig. I det ögonblick då kretsen är avslutad visar voltmetern +0,46 V, detta kallas cellpotentialen. Cellpotentialen skapas när de två olikartade metallerna kopplas samman och är ett mått på den energi per laddningsenhet som finns tillgänglig från oxidations-reduktionsreaktionen. Volt är den härledda SI-enheten för elektrisk potential
I denna ekvation är A strömmen i ampere och C laddningen i coulombs. Observera att volt måste multipliceras med laddningen i coulombs (C) för att få energi i joule (J).
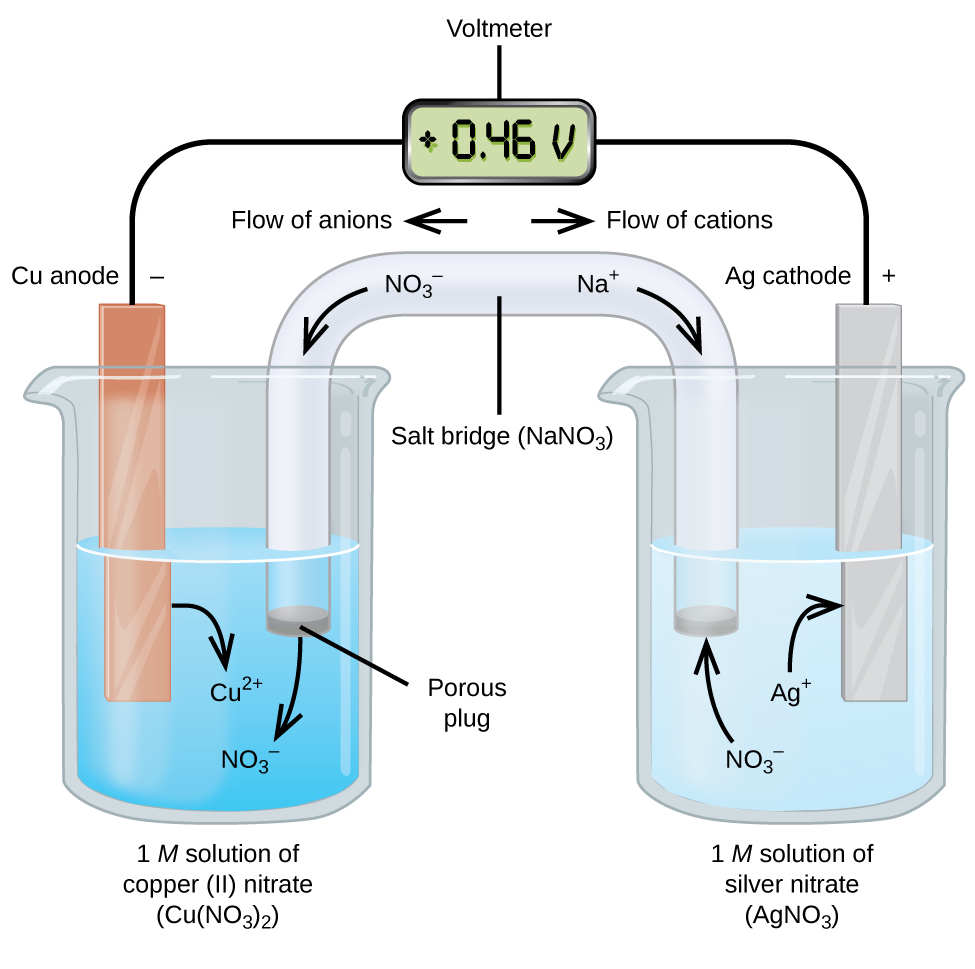
När den elektrokemiska cellen är konstruerad på detta sätt indikerar en positiv cellpotential en spontan reaktion och att elektronerna flödar från vänster till höger. Det är mycket som händer i figur 2, så det är lämpligt att sammanfatta saker och ting för detta system:
- Elektronerna flödar från anoden till katoden: från vänster till höger i den galvaniska standardcellen i figuren.
- Elektroden i den vänstra halvcellen är anod eftersom oxidation sker här. Namnet syftar på flödet av anjoner i saltbryggan mot den.
- Elektroden i den högra halvcellen är katoden eftersom reduktion sker här. Namnet hänvisar till flödet av katjoner i saltbryggan mot den.
- Oxidation sker vid anoden (den vänstra halvcellen i figuren).
- Reduktion sker vid katoden (den högra halvcellen i figuren).
- Cellpotentialen, +0.46 V, i detta fall, beror på de inneboende skillnaderna i arten av de material som används för att tillverka de två halvcellerna.
- Saltbryggan måste vara närvarande för att stänga (fullborda) kretsen och både en oxidation och en reduktion måste inträffa för att strömmen ska kunna flöda.
Det finns många möjliga galvaniska celler, så en kortfattad notation används vanligtvis för att beskriva dem. Cellnotationen (ibland kallad celldiagram) ger information om de olika arter som är inblandade i reaktionen. Denna notation fungerar även för andra typer av celler. En vertikal linje, │, betecknar en fasgräns och en dubbel linje, ‖, en saltbrygga. Information om anoden skrivs till vänster, följt av anodlösningen, därefter saltbryggan (om sådan finns), därefter katodlösningen och slutligen information om katoden till höger. Cellnotationen för den galvaniska cellen i figur 2 är då
Notera att spectatorjoner inte är inkluderade och att den enklaste formen av varje halvreaktion användes. När de olika jonernas ursprungliga koncentrationer är kända brukar de inkluderas.
En av de enklaste cellerna är Daniell-cellen. Det är möjligt att konstruera detta batteri genom att placera en kopparelektrod i botten av en burk och täcka metallen med en kopparsulfatlösning. En zinksulfatlösning flyter ovanpå kopparsulfatlösningen; sedan placeras en zinkelektrod i zinksulfatlösningen. Genom att kopparelektroden ansluts till zinkelektroden kan en elektrisk ström flöda. Detta är ett exempel på en cell utan saltbrygga, och joner kan flöda över gränssnittet mellan de två lösningarna.
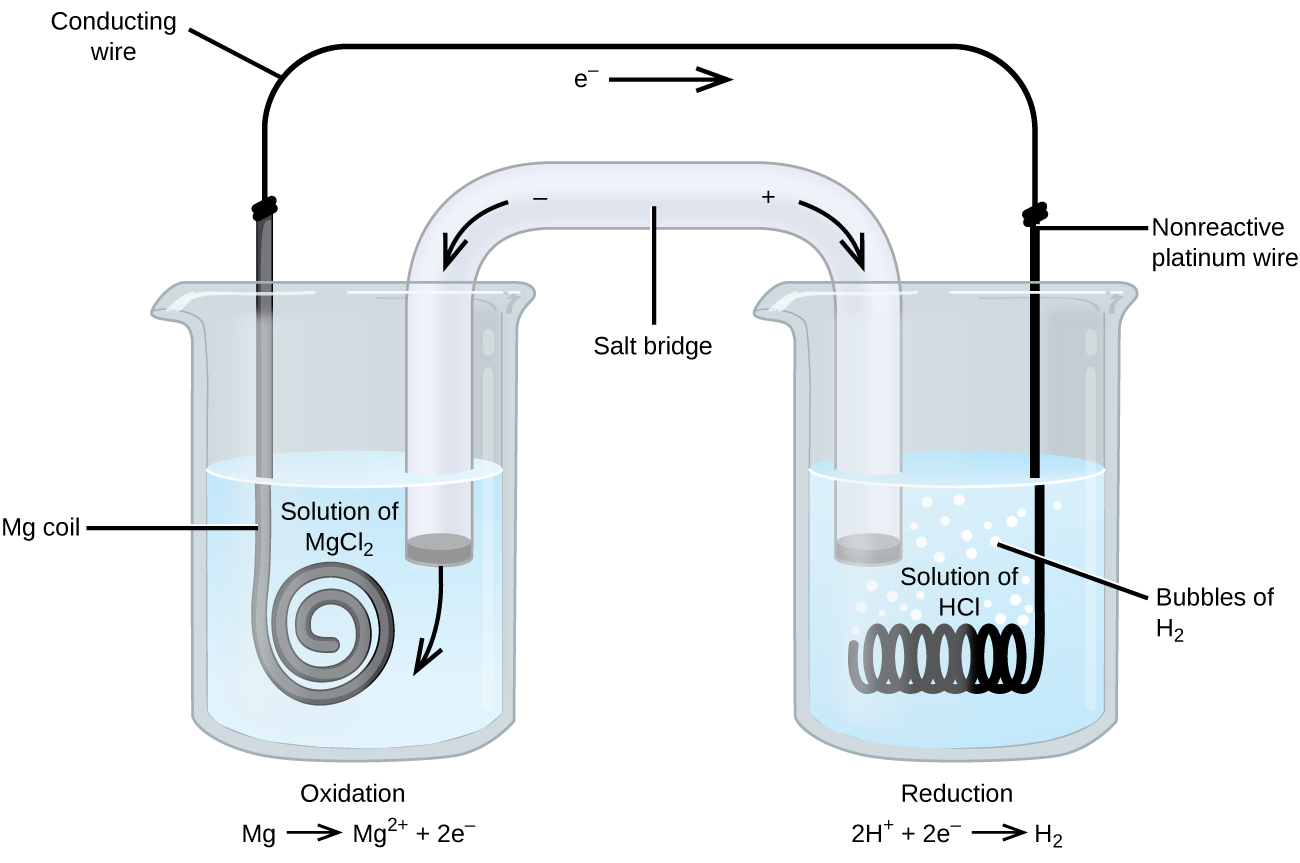
Vissa oxidations-reduktionsreaktioner involverar arter som är dåliga ledare av elektricitet, och därför används en elektrod som inte deltar i reaktionerna. Ofta är elektroden platina, guld eller grafit, som alla är inerta för många kemiska reaktioner. Ett sådant system visas i figur 3. Magnesium genomgår oxidation vid anoden till vänster i figuren och vätejoner genomgår reduktion vid katoden till höger. Reaktionen kan sammanfattas som
Cellen använde en inert platintråd som katod, så cellens notation är
Magnesiumelektroden är en aktiv elektrod eftersom den deltar i oxidations-reduktionsreaktionen. Inerta elektroder, som platinaelektroden i figur 3, deltar inte i oxidations-reduktionsreaktionen och finns med för att strömmen ska kunna flöda genom cellen. Platina eller guld är i allmänhet bra inerta elektroder eftersom de är kemiskt oreaktiva.
Exempel 1
Användning av cellbeteckning
Anta en galvanisk cell som består av
Skriv oxidations- och reduktionshalvreaktionerna och skriv reaktionen med cellnotation. Vilken reaktion sker vid anoden? Katoden?
Lösning
Vid inspektion oxideras Cr när tre elektroner förloras för att bilda Cr3+, och Cu2+ reduceras när det får två elektroner för att bilda Cu. Balansering av laddningen ger
Cellnotationen använder den enklaste formen av varje ekvation och börjar med reaktionen vid anoden. Inga koncentrationer angavs så: \text{Cr}(s){\mid}\text{Cr}^{3+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s). Oxidation sker vid anoden och reduktion vid katoden.
Användning av cellbeteckning
Tänk på en galvanisk cell som består av
Skriv oxidations- och reduktionshalvreaktionerna och skriv reaktionen med cellnotation. Vilken reaktion sker vid anoden? Katoden?
Lösning
Som man ser det, oxideras Fe2+ när en elektron förloras för att bilda Fe3+, och MnO4- reduceras när den får fem elektroner för att bilda Mn2+. Balansering av laddningen ger
Cellnotationen använder den enklaste formen av varje ekvation och börjar med reaktionen vid anoden. Det är nödvändigt att använda en inert elektrod, till exempel platina, eftersom det inte finns någon metall närvarande för att leda elektronerna från anoden till katoden. Inga koncentrationer angavs så: \text{Pt}(s){\mid}\text{Fe}^{2+}(aq)\text{,}\;\text{Fe}^{3+}(aq){\parallel}\text{MnO}_4^{\;\;-}(aq)\text{,}\;\text{H}^{+}(aq)\text{,}\;\text{Mn}^{2+}(aq){\mid}\text{Pt}(s). Oxidation sker vid anoden och reduktion vid katoden.
Kontrollera din inlärning
Använd cellnotering för att beskriva den galvaniska cellen där koppar(II)-joner reduceras till kopparmetall och zinkmetall oxideras till zinkjoner.
Svar:
Utifrån den information som ges i problemet:
\begin{array}{lr @{{}\longrightarrow{}} l} \text{anode\;(oxidation):} & \text{Zn}(s) & \text{Zn}^{2+}(aq)\;+\;2\text{e}^{-} \\\text \katoden\;(reduktion):} & \text{Cu}^{2+}(aq)\;+\;2\text{e}^{-} & \text{Cu}(s) \\\ \hline \\\\ \text{overall:} & \text{Zn}(s)\;+\;\text{Cu}^{2+}(aq) & \text{Zn}^{2+}(aq)\;+\;\text{Cu}(s) \end{array}
Använda cell-notation:
\text{Zn}(s){\mid}\text{Zn}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s).
Elektrokemiska celler består vanligtvis av två halvceller. Halvcellerna separerar oxidationshalvreaktionen från reduktionshalvreaktionen och gör det möjligt för strömmen att flöda genom en extern tråd. Den ena halvcellen, som normalt avbildas på vänster sida i en figur, innehåller anoden. Oxidation sker vid anoden. Anoden är ansluten till katoden i den andra halvcellen, som ofta visas på höger sida i en figur. Reduktion sker vid katoden. Genom att lägga till en saltbrygga sluts kretsen så att strömmen kan flöda. Anjoner i saltbryggan strömmar mot anoden och katjoner i saltbryggan strömmar mot katoden. Dessa joners rörelse sluter kretsen och håller varje halvcell elektriskt neutral. Elektrokemiska celler kan beskrivas med hjälp av cellnotation. I denna notation visas information om reaktionen vid anoden till vänster och information om reaktionen vid katoden till höger. Saltbryggan representeras av en dubbel linje, ‖. De fasta, flytande eller vattenhaltiga faserna inom en halvcell skiljs åt av en enkel linje, │. De olika arternas fas och koncentration anges efter artnamnet. Elektroder som deltar i oxidations-reduktionsreaktionen kallas aktiva elektroder. Elektroder som inte deltar i oxidations-reduktionsreaktionen men som finns där för att låta strömmen flöda är inerta elektroder. Inerta elektroder tillverkas ofta av platina eller guld, som är oförändrade vid många kemiska reaktioner.
Kemi Övningar i slutet av kapitlet
- Skriv följande balanserade reaktioner med cellnotering. Använd vid behov platina som en inert elektrod.
(a) \text{Mg}(s)\;+\;\text{Ni}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Ni}(s)
(b) 2\text{Ag}^{+}(aq)\;+\;\text{Cu}(s)\;{\longrightarrow}\;\text{Cu}^{2+}(aq)\;+\;2\text{Ag}(s)
(c) \text{Mn}(s)\;+\;\text{Sn(NO}_3)_2(aq)\;{\longrightarrow}\;\text{Mn(NO}_3)_2(aq)\;+\;\text{Au}(s)
(d) 3\text{CuNO}_3(aq)\;+\;\text{Au(NO}_3)_3(aq)\;{\longrightarrow}\;3\text{Cu(NO}_3)_2(aq)\;+\;\text{Au}(s)
- Genom följande cellbeteckningar, bestäm den oxiderade arten, den reducerade arten samt oxidationsmedlet och reduktionsmedlet, utan att skriva de balanserade reaktionerna.
(a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s)
(b) \text{Ni}(s){\mid}\text{Ni}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s)
- För cellbeteckningarna i föregående problem, skriva motsvarande balanserade reaktioner.
- Balansera följande reaktioner och skriv reaktionerna med hjälp av cellnotation. Strunta i eventuella inerta elektroder, eftersom de aldrig ingår i halvreaktionerna.
(a) \text{Al}(s)\;+\;\text{Zr}^{4+}(aq)\;{\longrightarrow}\;\text{Al}^{3+}(aq)\;+\;\text{Zr}(s)
(b) \text{Ag}^{+}(aq)\;+\;\text{NO}(g)\;{\longrightarrow}\;\text{Ag}(s)\;+\;\text{NO}_3^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(acidic\;solution)}
(c) \text{SiO}_3^{\;\;2-}(aq)\;+\;\text{Mg}(s)\;{\longrightarrow}\;\text{Si}(s)\;+\;\text{Mg(OH)}_2(s)\;\;\;\;\;\;\;\text{(basic\;solution)}
(d) \text{ClO}_3^{\;\;-}(aq)\;+\;\text{MnO}_2(s)\;{\longrightarrow}\;\text{Cl}^{\;\;-}(aq)\;+\;\text{MnO}_4^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(basic\;lösning)}
- Identifiera den oxiderade arten, den reducerade arten samt oxidationsmedlet och reduktionsmedlet för alla reaktioner i föregående problem.
- Använd cellnotation utifrån den tillhandahållna informationen för att beskriva följande system:
(a) I den ena halvcellen bildar en lösning av Pt(NO3)2 Pt-metall, medan Cu-metallen i den andra halvcellen går in i en Cu(NO3)2-lösning med alla koncentrationer av lösta ämnen 1 M.
(b) Katoden består av en guldelektrod i en 0,55 M Au(NO3)3-lösning och anoden är en magnesiumelektrod i 0,55 M Au(NO3)3-lösning.75 M Mg(NO3)2-lösning.
(c) Den ena halvcellen består av en silverelektrod i en 1 M AgNO3-lösning och i den andra halvcellen oxideras en kopparelektrod i 1 M Cu(NO3)2.
- Varför behövs en saltbrygga i galvaniska celler som den i figur 2?
- Den konstaterades att en aktiv (metall-)elektrod förlorar massa när oxidations-reduktionsreaktionen tillåts fortsätta. Var elektroden en del av anoden eller katoden? Förklara.
- Aktiva elektroder deltar i oxidations-reduktionsreaktionen. Eftersom metaller bildar katjoner skulle elektroden förlora massa om metallatomer i elektroden skulle oxidera och gå i lösning. Oxidation sker vid anoden.
- Massan hos tre olika metallelektroder, var och en från en annan galvanisk cell, bestämdes före och efter det att strömmen som genereras av oxidations-reduktionsreaktionen i varje cell fick flöda under några minuter. Den första metallelektroden, som fick beteckningen A, visade sig ha ökat i massa; den andra metallelektroden, som fick beteckningen B, förändrades inte i massa; och den tredje metallelektroden, som fick beteckningen C, visade sig ha förlorat massa. Gör en kvalificerad gissning om vilka elektroder som var aktiva och vilka som var inerta elektroder och vilka som var anod(er) och vilka som var katod(er).
Glossar
aktiv elektrod elektrod elektrod som deltar i oxidations-reduktionsreaktionen i en elektrokemisk cell; massan hos en aktiv elektrod förändras under oxidations-reduktionsreaktionen anodelektrod i en elektrokemisk cell vid vilken oxidation sker; information om anoden registreras på den vänstra sidan av saltbron i cellnotation katodelektrod i en elektrokemisk cell där reduktion sker; information om katoden registreras på den högra sidan av saltbron i cellnotation cellnotation kortfattat sätt att representera reaktionerna i en elektrokemisk cell cellpotentialdifferens elektrisk potential som uppstår när olika metaller är sammankopplade; Drivkraften för flödet av laddning (ström) i oxidations-reduktionsreaktioner Galvanisk cell Elektrokemisk cell som innebär en spontan oxidations-reduktionsreaktion; elektrokemiska celler med positiv cellpotential; även kallad voltaisk cell Inert elektrod Elektrode som låter strömmen flöda, men som inte på annat sätt deltar i oxidations-reduktionsreaktionen i en elektrokemisk cell; massan hos en inert elektrod förändras inte under oxidations-reduktionsreaktionen; inerta elektroder är ofta tillverkade av platina eller guld, eftersom dessa metaller är kemiskt oreaktiva. Voltaic cell ett annat namn för en galvanisk cell
Lösningar
Svar på kemiövningar i slutet av kapitlet
1. (a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Ni}^{2+}(aq){\mid}\text{Ni}(s); (b) \text{Cu}(s){\mid}\text{Cu}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s); (c) \text{Mn}(s){\mid}\text{Mn}^{2+}(aq){\parallel}\text{Sn}^{2+}(aq){\mid}\text{Sn}(s); (d) \text{Pt}(s){\mid}\text{Cu}^{+}(aq)\text{,\;Cu}^{2+}(aq){\parallel}\text{Au}^{3+}(aq){\mid}\text{Au}(s)
3. (a) \text{Mg}(s)\;+\;\text{Cu}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Cu}(s); (b) 2\text{Ag}^{+}(aq)\;+\;\text{Ni}(s)\;{\longrightarrow}\;\text{Ni}^{2+}(aq)\;+\;2\text{Ag}(s)
5. Oxiderad art = reduktionsmedel: (a) Al(s), b) NO(g), c) Mg(s) och d) MnO2(s); reducerade arter = oxidationsmedel: (a) Zr4+(aq); (b) Ag+(aq); (c) \text{SiO}_3^{\;\;2-}(aq); och (d) \text{ClO}_3^{\;\;-}(aq)
7. Utan saltbryggan skulle kretsen vara öppen (eller bruten) och ingen ström kunde flyta. Med en saltbrygga förblir varje halvcell elektriskt neutral och ström kan flyta genom kretsen.
9. Man fann att en aktiv (metall)elektrod ökar sin massa när oxidations-reduktionsreaktionen tillåts fortgå. Var elektroden en del av anoden eller katoden? Förklara.