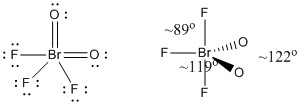Intermediär oorganisk kemi
University of Rhode Island
Hösten 2013
Tentamen 1
1. Skriv elektronkonfigurationen (med hjälp av sällsynta gasnotationer för slutna skal) och grundtillståndets termsymbol för följande: a) Sc; b) Sc+; c) Sc2+; d) Sc3+; e) Sc-.
a) Sc
4s23d1
Endast 3d-elektronen bidrar till termsymbolen: L = 2 och S = ½ vilket ger 2D
b) Sc+
3d2
L = 3 och S = 1 vilket ger 3F
c) Sc2+
3d1
L = 2 och S = ½ vilket ger 3F
c) Sc2+
3d1
L = 2 och S = ½ vilket ger 2D
d) Sc3+
L = 0 och S = 0 vilket ger 1S
d) Sc-
4s23d2
L = 3 och S = 1 vilket ger 3F
2. Skriv Lewis punktstruktur, ange de formella laddningarna för alla atomer, förutsäg molekylgeometrin, uppskatta alla bindningsvinklar och ange den troliga hybridorbitalet för följande: a) BrO2-; b) BrO3-; c) BrO2F3.
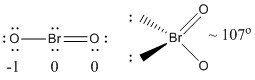
a) BrO2-
Lewisstruktur:
Formella laddningar anges på Lewisstrukturen
Struktur: böjd planär med en bindningsvinkel på ~107°
Hybridorbital på Br: sp3
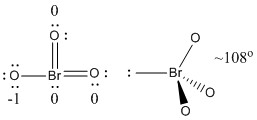
b) BrO3-
Lewisstruktur:
Formella laddningar anges på Lewisstrukturen
Struktur: Pyramidal med bindningsvinklar O-Br-O ~108°
Hybridorbital på Br: sp3
c) BrO2F3
Lewisstruktur:
Formella laddningar anges på Lewisstrukturen
Struktur: trigonal bipyramidal med bindningsvinklar som visas i figuren
Hybridorbital på Br: dsp3
3. En atoms absoluta hårdhet definieras som η = ½(IP – EA), IP är joniseringspotentialen och EA är elektronaffiniteten. Förutsäg de periodiska trenderna för η och motivera din förutsägelse.
För nästan alla atomer är IP >> EA, så η kommer att följa de periodiska trenderna för IP: ökande när man rör sig till höger i det periodiska systemet (efter Z*) och något minskande när man rör sig nedåt i det periodiska systemet när atomradien ökar.
4. Cr2 har elektronkonfigurationen σ2π4δ4δ*2. Vilken är bindningsordningen och hur många oparade spins förutses? Skulle du förvänta dig att Cr2 absorberar ljus i det synliga området av spektrumet? Varför eller varför inte?
Bindningsordningen = ½(2 + 4 + 4 – 2) = 4 med 2 oparade spins (eftersom det finns 2 δ-orbitaler måste det också finnas 2 δ*-orbitaler, som var och en har en elektron enligt Hunds regler). Överlappningen sida vid sida av d-orbitaler för att bilda δ-orbitaler är dålig så att uppdelningen mellan δ- och δ*-orbitalerna blir liten. Detta tyder på att den energi som krävs för att flytta en elektron från HOMO till LUMO också är liten, vilket förutsäger en absorption i den synliga delen av spektrumet.