I den cellmedierade delen av det adaptiva immunsvaret binds korta peptider till MHC-molekyler av klass I och klass II och presenteras på cellytan där de känns igen av T-lymfocyternas antigenreceptorer. Bindning av en T-cellsreceptor (TCR) som känner igen ett visst MHC-peptidkomplex leder till att naiva lymfocyter differentieras till effektorceller (cytotoxiska och hjälpande T-celler) som förstör infekterade värdceller eller stimulerar antikroppsproduktion, och minnesceller som ger skyddande immunitet mot återinfektion.
Struktur och funktion hos MHC-molekyler
Två multigenfamiljer som är belägna inom den genomiska MHC-regionen kodar för antigenbindande molekyler som presenterar främmande peptider på cellytan. I själva verket presenterar MHC-molekylerna även egenutvecklade peptider. Negativt urval i thymus mot autoreaktiva T-celler förhindrar dock MHC-självpeptidkomplex från att framkalla ett immunsvar. MHC-klass I-molekyler uttrycks på de flesta cellkärnor och innehåller vanligtvis endogena peptider som härrör från intracellulära patogener som replikerar i cytosolen (t.ex. virus). Cytosoliska proteiner bryts ned till korta peptidfragment av proteasomen och transporteras först in i det endoplasmatiska retikulumet (ER) av de ATP-beroende transportörerna TAP1 & 2 för MHCI-laddning och sedan till cellytan för presentation till cirkulerande cytotoxiska CD8+ T-celler, vilkas funktion är att framkalla apoptos och lysis av den infekterade målcellen. (Figurerna är anpassade från Murphy et al. (2008) fig. 3.12, 3.25, 5.5, & 5.11.)
Det konstitutiva uttrycket av MHC klass II loci är begränsat till antigenpresenterande celler i immunsystemet (APCs, t.ex. makrofager, dendritiska celler och B-lymfocyter). MHCII-molekyler stabiliseras och hindras från att binda antigen när de befinner sig i ER genom förening med den invarianta kedjan av klass II (Ii, eller CD74), och omdirigeras sedan från den standardiserade sekretoriska vägen till den endocytära vägen. Där möter de peptider som härrör från patogener som replikerar i intracellulära vesiklar eller från extracellulära patogener och proteiner som transporteras in i cellen. Stabil peptidbindning katalyseras av den icke-klassiska MHCII DMα/β-dimeren och gör det möjligt för MHCII-peptidkomplex att fly från den endocytära vägen för att presenteras på cellytan. Erkännande av CD4+ T-celler aktiverar målvärdscellen för att stimulera antibakteriella mekanismer (i makrofager) eller för att utlösa antikroppsproduktion och det humorala immunsvaret.
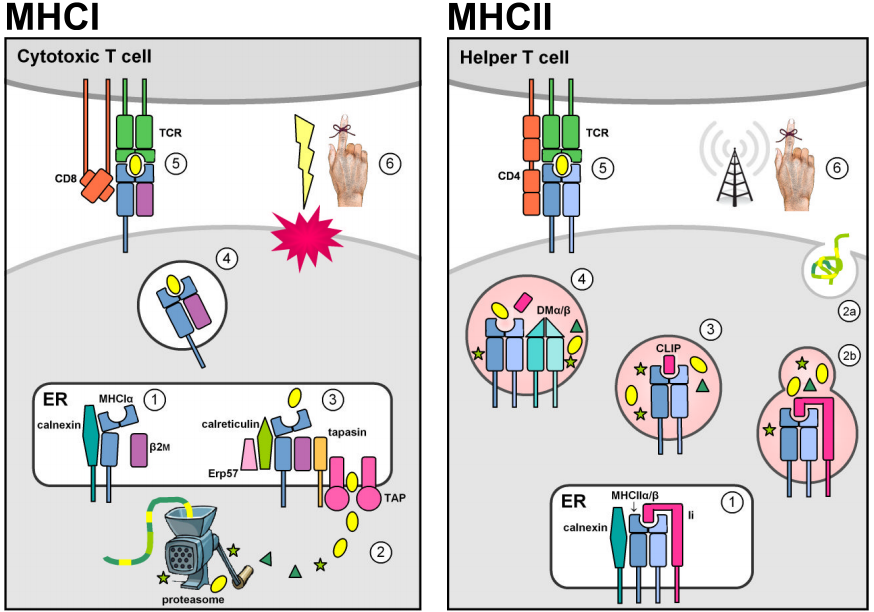
Strukturella likheter mellan MHCI- och MHCII-molekylerna återspeglar sannolikt att de härstammar från en gemensam förfader. Mogna MHC-molekyler är integrala membranglykoproteiner av typ I som består av ett peptidbindande spår och immunoglobulinliknande, transmembran- och cytoplasmiska domäner. De extracellulära delarna av MHC-molekylerna består av två membran-distala domäner som tillsammans bildar ett peptidbindande hålrum som avgränsas av två avbrutna α-helixer som vilar ovanpå ett antiparallellt β-ark, och två membranproximala immunglobulinliknande (Ig-liknande) domäner som deltar i bindning av CD4- och CD8-korreceptorerna.
Trots dessa strukturella likheter kodas proteinsubenheterna på olika sätt för molekyler av klass I och II. MHCI-molekyler är heterodimerer som bildas genom icke-kovalent association mellan en MHCIα tung kedja och β2-mikroglobulin (β2m), som kodas av ett i stort sett invariant locus som ligger utanför MHC-genomregionen. Den tunga kedjan bidrar med både den peptidbindande klyftan och en av de Ig-liknande domänerna, medan β2m endast bidrar med en andra Ig-liknande region som saknar ett transmembranankare. MHC-klass II-molekyler är heterodimerer som bildas genom icke-kovalent förening av en α- och en β-kedja, som båda bidrar med enstaka peptidbindande och membranförankrade Ig-liknande domäner, och som var och en transkriberas från en distinkt locus som vanligen återfinns inom MHC-regionen.
MHC-genfamiljemedlemmar kan delas upp ytterligare i klassiska eller icke-klassiska loci, förutom ickefunktionella pseudogener. Klassiska MHC Ia loci har ett brett uttryck och är vanligtvis förknippade med hög sekvensvariabilitet och positivt urval som verkar på substitutioner vid rester i den peptidbindande regionen (PBR). Icke-klassiska MHC Ib loci har istället minskat uttryck eller begränsad vävnadsdistribution, lägre polymorfism och kan ha begränsade eller modifierade funktioner. För klass II-gener avser ”klassisk” vanligtvis alla antigenpresenterande loci, medan termen ”icke-klassisk” är reserverad för gener som DMα/β som har accessoriska roller i antigenpresenteringsvägen. Även om denna funktionella kategorisering av genfamiljemedlemmar ger en användbar arbetsvokabulär är gränsen mellan klassiska och icke-klassiska loci inte alltid tydlig i praktiken och vissa icke-klassiska MHCI-loci är polymorfa, brett uttryckta eller binder peptidiska ligander på traditionellt sätt som klassiska gener.
Extrem polymorfism på befolkningsnivå och bevis på balanserande selektion tyder på att det troligen behövs en avsevärd allelisk variation av MHC-gener för att känna igen och reagera på en varierad samling av patogener. Trots omfattande genduplikation hos vissa arter uttrycker individer vanligtvis endast ett måttligt antal klassiska MHC-loci, och återgång till disomisk nedärvning observeras också hos vissa polyploida Xenopus-arter. Begränsningar av intraindividuell MHC-variation (åtminstone för högt uttryckta klassiska loci) anses återspegla en funktionell avvägning mellan att öka den alleliska repertoaren för att presentera en större variation av patogena peptider och den åtföljande minskningen av T-cellsrepertoaren som skulle behövas för att upprätthålla självtolerans. Enskilda MHC-molekyler måste därför kunna binda peptider på ett tillåtande sätt för att kunna känna igen ett brett spektrum av främmande antigener på ett adekvat sätt. Det finns emellertid också ett behov av att generera stabila MHC-peptidkomplex som kommer att bestå tillräckligt länge för att möjliggöra T-cellsigenkänning och som inte kommer att utbyta peptider på cellytan, vilket skulle kunna leda till att icke-infekterade celler förstörs. En sådan stabilitet är i allmänhet förknippad med intermolekylära interaktioner med hög affinitet och därmed restriktiva intermolekylära interaktioner.
MHC-molekyler förenar dessa konkurrerande bindningskrav genom en elegant strukturell lösning: kontakter mellan högt bevarade rester i MHC-molekylens peptidbindande region (PBR) och huvudkedjeatomer i peptiden stabiliserar den promiskuösa bindningen av de flesta peptidliga ligander, medan polymorfa rester som kantar det peptidbindande spåret skapar oregelbundna fickor med olika stereokemi som rymmer peptidrester på ett sekvensberoende sätt. Begränsningar som påförs av sidokedjebindande fickor varierar både mellan alleler och mellan fickor inom en enskild MHC-molekyl. Fickor med strängare bindningskrav sägs rymma peptidrester med ”primärt ankare”, medan ”sekundära ankare” är mer flexibla i sina bindningspreferenser. Tillsammans bestämmer dessa specificiteter det peptidbindande motivet för en viss MHC-allel för att ge selektivitet vid antigenpresentation.