ATP, NAD OCH FAD
ATP
Celler använder en molekyl som kallas Adenosintrifosfat (eller ATP) som energikälla (se figur 2). Fosfaterna i denna molekyl kan leverera energi till substrat i våra celler. Det finns enzymer i våra celler som kan ta bort en fosfat från ATP och fästa den vid en annan molekyl – vanligtvis ett protein (se figur 3). När detta sker säger vi att proteinet har fosforylerats. Tänk på den tredje fosfaten som en liten säck med energi. När den överförs till ett protein kan denna energi användas för att göra något. I figur 3 till exempel ändrar proteinet sin form när det blir fosforylerat. När proteiner ändrar sin form kallar vi det ofta för en konformationsförändring av proteinstrukturen. Det finns många proteiner i kroppen som använder en fosfat från ATP för att framkalla en konformationsförändring. Denna förändring av proteinformen möjliggör i slutändan saker som muskelkontraktion, cellrörlighet, membrantransport och enzymverkan. Celler och liv existerar endast om det finns en jämn och stadig tillgång till ATP.
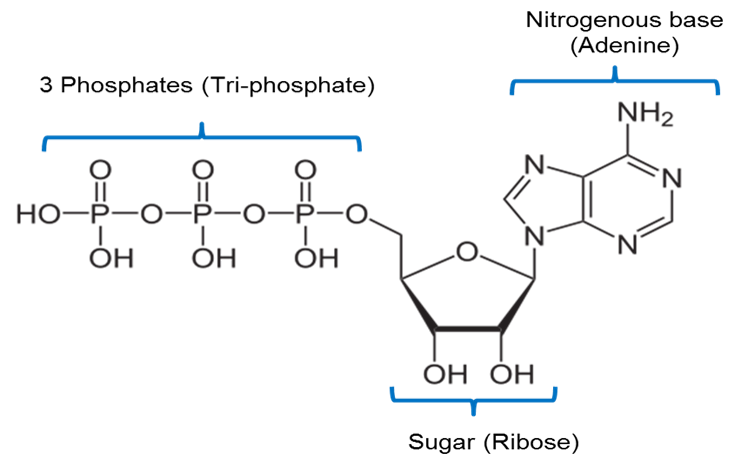
Bild skapad av JS at BYU Idaho F2013.
Bilden ovan är en representation av ATP:s kemiska struktur. ATP innehåller en kvävebaserad bas som kallas adenin som är förenad med ett socker med 5 kol som kallas ribose och 3 fosfatgrupper.
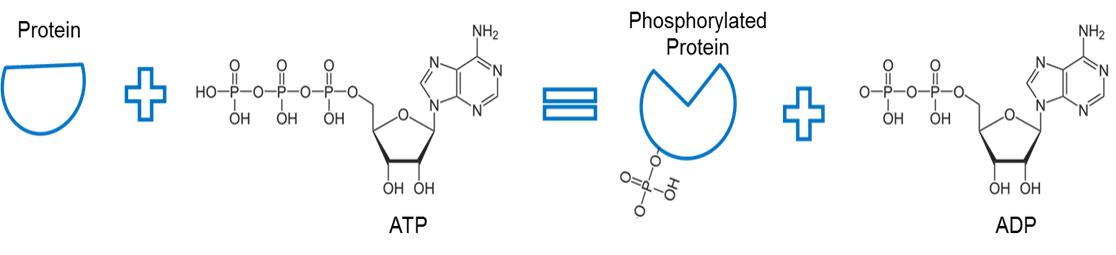
Bild skapad av JS vid BYU Idaho F2013.
ATP används för att fosforylera ett protein. Ett enzym, som kallas kinas (ej avbildat), tar bort en fosfat från ATP och underlättar en bindning mellan fosfatet och något annat protein. Bindningen av en fosfat till ett protein på detta sätt kallas fosforylering. Fosfatbandet med proteinet har högre energi. Lägg märke till att fosforylering använder denna energi för att orsaka en konformationsförändring av proteinets form.
NAD och FAD
Nicotinamide Adenine Dinucleotide (NAD) och Flavin Adenine Dinucleotide (FAD) är coenzymer som är involverade i reversibla oxidations- och reduktionsreaktioner. Det sägs ofta att dessa föreningar är elektronbärare eftersom de tar emot elektroner (blir reducerade) under kataboliska steg i nedbrytningen av organiska molekyler som kolhydrater och lipider. Därefter kan dessa reducerade koenzymer donera dessa elektroner till någon annan biokemisk reaktion som normalt är involverad i en process som är anabolisk (som syntesen av ATP).
NAD+ / NADH
Nicotinamid Adenin Dinucleotid i sitt oxiderade tillstånd kallas NAD+, efter att ha reducerats (eller tagit emot elektroner) benämns det som NADH. Se figur 4 för en molekylär illustration. Vitaminet Niacin (även kallat B3) används för att härleda denna förening. Niacin tillhandahåller den organiska ringstruktur som direkt deltar i överföringen av en väteatom och två elektroner. NAD+ finns ofta tillsammans med ett ”dehydrogenas”-enzym. En dehydrogenasreaktion avlägsnar två väteatomer; en som hydrid (:H-) (en hydrid är en väteatom med två elektroner) och en som en vätekation (H+) (och naturligtvis har en vätekation inga elektroner). Hydridet binder sig till NAD+ och skapar en reducerad förening av Nictinamide Adenine Dinucleotide (NADH). Den andra väteatomen (H+) släpps ut i lösningen se figur 4.
När du undersöker reaktionerna för metabolism, leta efter reaktioner som ger NADH. NADH kommer att vara viktigt eftersom det kommer att leverera de väteatomer och elektroner som det plockar upp till biokemiska processer som kan använda elektronerna och väteatomer för att göra ATP.
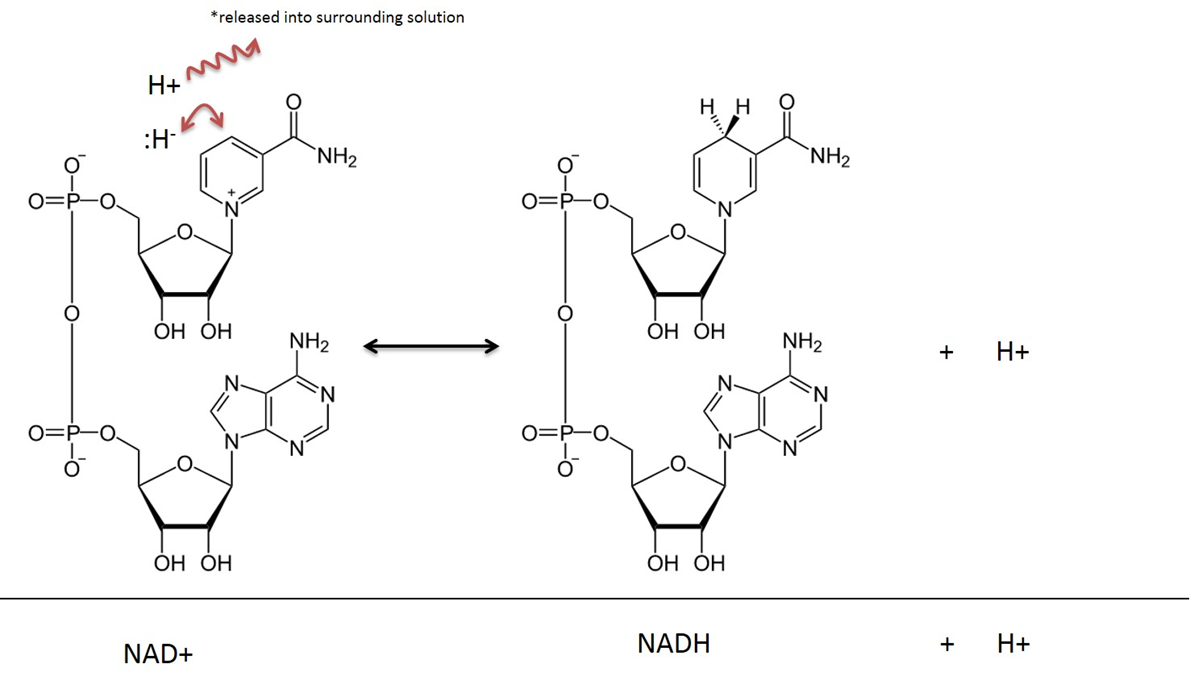
Bild skapad av JS at BYU Idaho F2013.
I ämnesomsättningsreaktioner som involverar NAD avlägsnas två väteatomer och två elektroner från ett substrat och överförs till NAD+. NAD+ tar emot en hydridjon (ett väte med två elektroner) och blir till nikotinamidadenindinukleotid i reducerad form (NADH). Den vätekatjon som också fångas in i reaktionen släpps ut i den omgivande lösningen. Kom ihåg att denna reaktion är reversibel.
I förklaringen av reaktioner som inträffar i ämnesomsättningen är det vanligt att man bortser från det H+ som släpps ut i lösningen och i denna text kommer resultatet av NAD-reduktionen att avbildas som helt enkelt NADH, i stället för NADH + H+.
FAD / FADH2
Flavinadenin-dinukleotid i sitt oxiderade tillstånd kallas FAD. Efter att ha reducerats kallas den för FADH2. Se figur 5 för en molekylär illustration. Vitaminet riboflavin (eller B2) används för att härleda denna förening. Riboflavin tillhandahåller de ringstrukturer som direkt kommer att delta i överföringen av två väteatomer (var och en med en elektron den här gången). I likhet med NAD arbetar FAD tillsammans med ett ”dehydrogenas”-enzym. Reaktionen avlägsnar två väteatomer; vardera en proton med en elektron. Båda väteatomerna binds till FAD. Denna reaktion släpper inte ut ett H+ i lösningen som reduktionen av NAD gör.
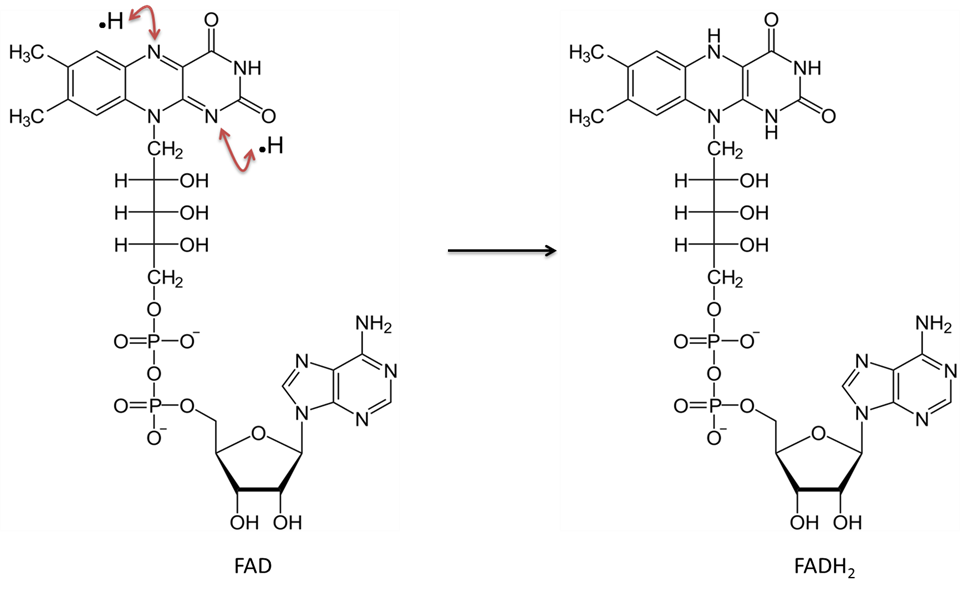
Bild skapad av JS at BYU Idaho F2013.
Flavin adenin dinukleotid i den oxiderade formen (FAD) tar emot två väteatomer (var och en med en elektron) och blir FADH2.
När du undersöker reaktionerna för metabolism, letar du efter en reaktion som ger FADH2. I likhet med NADH kommer FADH2 att vara viktig eftersom den levererar väteämnen och elektroner till biokemiska processer som kan använda elektronerna och väteämnena för att tillverka ATP.
**Du kan använda knapparna nedan för att gå till nästa eller föregående läsning i den här modulen**

