Generiskt namn: naftifine hydrochloride
Doseringsform: gel
Medicinskt granskad av Drugs.com. Senast uppdaterad den 1 april 2020.
- Översikt
- Biverkningar
- Dosering
- Professionell
- Graviditet
- Mer
- Indikationer och Användning av Naftin Gel
- Naftin Gel Dosering och administrering
- Doseringsformer och styrkor
- Kontraindikationer
- Varningar och försiktighetsåtgärder
- Lokala biverkningar
- Biverkningar
- Erfarenheter från kliniska prövningar
- Erfarenheter efter marknadsintroduktion
- Användning hos särskilda populationer
- Graviditet
- Lactation
- Pediatrisk användning
- Geriatrisk användning
- Naftin Gel Beskrivning
- Naftin ® Gel – klinisk farmakologi
- Aktionsmekanism
- Farmakodynamik
- Farmakokinetik
- Mikrobiologi
- Nonklinisk toxikologi
- Carcinogenes, mutagenes, Försämrad fertilitet
- Kliniska studier
- Hur tillhandahålls/förvaras och hantering
- Patientrådgivning
- PRINCIPAL DISPLAY PANEL – 45g Tube Carton
- PRINCIPAL DISPLAY PANEL – 60 g Tube Carton
- Mer om Naftin (naftifine topical)
- Konsumentresurser
- Resurser för yrkesverksamma
- Andra formuleringar
- Relaterade behandlingsguider
Indikationer och Användning av Naftin Gel
NAFTIN ® Gel är ett svampdödande allylamin som är indicerat för behandling av interdigital tinea pedis orsakad av organismen Trichophyton rubrum, Trichophyton mentagrophytes och Epidermophyton floccosum.
Naftin Gel Dosering och administrering
Applicera ett tunt lager NAFTIN ® Gel en gång dagligen på de drabbade områdena plus en cirka ½ tum marginal av frisk omgivande hud i 2 veckor.
Endast för topisk användning. NAFTIN ® Gel är inte avsedd för oftalmisk, oral eller intravaginal användning.
Doseringsformer och styrkor
Gel, 2%. Varje gram innehåller 20 mg naftifinhydroklorid i en färglös till gul gel.
Kontraindikationer
Ingen.
Varningar och försiktighetsåtgärder
Lokala biverkningar
Om irritation eller överkänslighet utvecklas vid användning av NAFTIN ® Gel ska behandlingen avbrytas.
Biverkningar
Erfarenheter från kliniska prövningar
Då kliniska prövningar utförs under mycket varierande förhållanden kan biverkningsfrekvenser som observerats i kliniska prövningar av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och kanske inte avspeglar frekvenser som observerats i klinisk praxis.
I två randomiserade, vehikelkontrollerade prövningar behandlades 1143 försökspersoner med NAFTIN ® Gel jämfört med 571 försökspersoner som behandlades med vehikel. Försökspersonerna var 12 till 92 år gamla, var huvudsakligen män (76 %) och 59 % kaukasiska, 38 % svarta eller afroamerikanska och 23 % spansktalande eller latinamerikanska. Försökspersonerna fick doser en gång dagligen, lokalt, i 2 veckor för att täcka de drabbade hudområdena plus en ½ tum marginal av omgivande frisk hud. De vanligaste biverkningarna var reaktioner på applikationsstället som förekom med 2 % i Naftin Gel-armen jämfört med 1 % i fordonarmen. De flesta biverkningarna var lindriga i allvarlighetsgrad.
I en öppen pediatrisk farmakokinetik- och säkerhetsstudie fick 22 pediatriska försökspersoner i åldern 12-17 år med interdigital tinea pedis Naftin ® Gel. Incidensen av biverkningar i den pediatriska populationen var liknande den som observerades i den vuxna populationen.
Kumulativa irritationstester visade att NAFTIN ® Gel kan orsaka irritation. Det fanns inga bevis för att NAFTIN ® Gel orsakar kontaktsensibilisering, fototoxicitet eller fotoallergenicitet på frisk hud.
Erfarenheter efter marknadsintroduktion
Då dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta frekvensen av dem eller att fastställa ett orsakssamband med läkemedelsexponering. Följande biverkningar har identifierats vid användning av naftifinhydroklorid efter godkännandet: blåsor, brännande känsla, skorpbildning, torrhet, erytem/rodnad, inflammation, irritation, maceration, smärta, pruritus/klåda, utslag och svullnad.
Användning hos särskilda populationer
Graviditet
Risksammanfattning
Det finns inga tillgängliga data om NAFTIN® Gel-användning hos gravida kvinnor för att utvärdera en läkemedelsassocierad risk för allvarliga fosterskador, missfall eller negativa resultat för modern eller fostret.
I reproduktionsstudier på djur sågs inga negativa effekter på embryofetal utveckling vid orala doser administrerade under organogenesiperioden upp till 37 gånger den högsta rekommenderade dosen för människa (MRHD) hos dräktiga råttor eller subkutana doser administrerade under organogenesiperioden upp till 4 gånger MRHD hos dräktiga råttor eller 7 gånger MRHD hos dräktiga kaniner ( se Data).
Alla graviditeter har en bakgrundsrisk för fosterskador, förlusten eller andra negativa resultat. Den uppskattade bakgrundsrisken för större fosterskador och missfall för den angivna populationen är okänd. I USA:s allmänna befolkning är den uppskattade bakgrundsrisken för större missbildningar och missfall i kliniskt erkända graviditeter 2 till 4 % respektive 15 till 20 %.
Data
Data om djur
Studier av systemisk embryofetal utveckling har utförts på råttor och kaniner. För att jämföra doser från djur till människa har MRHD fastställts till 4 g 2 % gel per dag (1,33 mg/kg/dag för en individ på 60 kg).
Orala doser på 30, 100 och 300 mg/kg/dag naftifinhydroklorid administrerades under organogenesiperioden till dräktiga honråttor. Inga behandlingsrelaterade effekter på embryofetal toxicitet noterades vid doser upp till 300 mg/kg/dag (37 gånger MRHD baserat på mg/m 2 jämförelse). Subkutana doser av 10 och 30 mg/kg/dag naftifinhydroklorid administrerades under organogenesiperioden till dräktiga honråttor. Inga behandlingsrelaterade effekter på embryofetal toxicitet noterades vid 30 mg/kg/dag (4 gånger MRHD baserat på mg/m 2 jämförelse). Subkutana doser av 3, 10 och 30 mg/kg/dag naftifinhydroklorid administrerades under organogenesiperioden till dräktiga honkaniner. Inga behandlingsrelaterade effekter på embryofetal toxicitet noterades vid 30 mg/kg/dag (7 gånger MRHD baserat på mg/m 2 jämförelse).
En peri- och postnatal utvecklingsstudie genomfördes på råttor. Orala doser av 30, 100 och 300 mg/kg/dag naftifinhydroklorid administrerades till honråttor från gestationsdag 14 till laktationsdag 21. Minskad viktökning hos honorna under dräktigheten och hos avkomman under laktationen noterades vid 300 mg/kg/dag (37 gånger MRHD baserat på mg/m 2 jämförelse). Ingen utvecklingstoxicitet noterades vid 100 mg/kg/dag (12 gånger MRHD baserat på mg/m 2 jämförelse).
Lactation
Risksammanfattning
Det finns ingen information tillgänglig om förekomsten av naftifinhydroklorid i humanmjölk, om läkemedlets effekter på det ammade spädbarnet eller om läkemedlets effekter på mjölkproduktionen efter topisk applicering av Naftin Gel på kvinnor som ammar. Det är inte känt om naftifinhydroklorid utsöndras i mänsklig mjölk. Eftersom många läkemedel utsöndras i mänsklig mjölk bör försiktighet iakttas när naftifinhydroklorid administreras till en ammande kvinna.
Bristen på kliniska data under amning omöjliggör en tydlig bestämning av risken Naftin Gel för ett spädbarn under amning. Därför bör de utvecklingsmässiga och hälsomässiga fördelarna med amning övervägas tillsammans med moderns kliniska behov av Naftin Gel och eventuella negativa effekter på det ammade spädbarnet från Naftin Gel eller från det underliggande tillståndet hos modern.
Pediatrisk användning
Säkerheten och effekten av NAFTIN® Gel har fastställts i åldersgruppen 12 till 18 år med interdigital tinea pedis.
Användning av NAFTIN® Gel i denna åldersgrupp stöds av bevis från adekvata och välkontrollerade prövningar hos vuxna med ytterligare säkerhets- och PK-data från en öppen prövning, utförd på 22 ungdomar ≥12 år som exponerades för NAFTIN® Gel i en dos på cirka 4 g/dag .
Säkerhet och effektivitet hos pediatriska patienter <12 år har inte fastställts.
Geriatrisk användning
Under kliniska prövningar exponerades 99 försökspersoner (9 %) i åldern 65 år och äldre för NAFTIN ® Gel. Säkerhet och effektivitet liknade dem som rapporterades av yngre försökspersoner.
Naftin Gel Beskrivning
NAFTIN ® Gel är en klar till gul gel för enbart topisk användning. Varje gram NAFTIN ® Gel innehåller 20 mg naftifinhydroklorid, en syntetisk svampdödande allylaminförening.
Kemiskt sett är naftifin HCl (E)-N-Cinnamyl-N-metyl-1-naftalenmetylaminhydroklorid.
Molekylformeln är C 21H 21N∙HCl med en molekylvikt på 323,86.
Strukturformeln för naftifinhydroklorid är :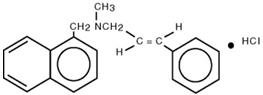
NAFTIN ® Gel innehåller följande inaktiva beståndsdelar: alkohol, bensylalkohol, edetatdinatrium, hydroxyetylcellulosa, renat vatten, propylenglykol, polysorbat 20 och trolamin.
Naftin ® Gel – klinisk farmakologi
Aktionsmekanism
NAFTIN ® Gel är ett lokalt svampdödande läkemedel .
Farmakodynamik
Farmakodynamiken för NAFTIN ® Gel har inte fastställts.
Farmakokinetik
Biotillgänglighetsstudier in vitro och in vivo har visat att naftifin tränger in i hornlagret i tillräcklig koncentration för att hämma tillväxten av dermatofyter.
Farmakokinetisk analys av plasmaprover från 32 försökspersoner med tinea pedis som behandlades med en genomsnittlig dos på 3,9 gram NAFTIN ® Gel som applicerades en gång dagligen på båda fötterna i 14 dagar visade ökad exponering under behandlingsperioden, med ett geometriskt medelvärde (CV%) AUC 0-24 (area under plasmakoncentrations-versus-tid-kurvan från tid 0 till 24 timmar) på 10,5 (118) ng∙hr/ml på dag 1 och en AUC 0-24 på 70 (59) ng∙hr/ml på dag 14. Ackumuleringskvoten baserad på AUC var cirka 6.
Maximumkoncentrationen (C max) ökade också under behandlingsperioden; geometriskt medelvärde (CV%) av C max efter en engångsdos var 0,9 (92) ng/mL på dag 1; C max på dag 14 var 3,7 (64) ng/mL. Median T max var 20,0 timmar (intervall: 8, 20 timmar) efter en enda applicering på dag 1 och 8,0 timmar (intervall: 0, 24 timmar) på dag 14. Trågplasmakoncentrationerna ökade under försöksperioden och nådde steady state efter 11 dagar. I samma farmakokinetiska prövning var den fraktion av dosen som utsöndrades i urinen under behandlingsperioden mindre än eller lika med 0,01 % av den applicerade dosen.
I en andra prövning utvärderades farmakokinetiken för NAFTIN ® Gel hos 22 pediatriska försökspersoner i åldern 12-17 år med tinea pedis. Försökspersonerna behandlades med en genomsnittlig dos på 4,1 gram NAFTIN ® Gel som applicerades på det drabbade området en gång dagligen i 14 dagar. Resultaten visade att den systemiska exponeringen ökade under behandlingsperioden. Geometriskt medelvärde (CV%) AUC0-24 var 15,9 (212) ng∙hr/mL på dag 1 och 60,0 (131) ng∙hr/mL på dag 14. Geometriskt medelvärde (CV%) Cmax efter en engångsdos var 1,40 (154) ng/mL på dag 1 och 3,81 (154) ng/mL på dag 14. Fraktionen av dosen som utsöndrades i urinen under behandlingsperioden var mindre än eller lika med 0,003 % av den applicerade dosen.
Mikrobiologi
Aktionsmekanism
Naftifin är ett svampdödande medel som tillhör allylaminklassen. Även om den exakta verkningsmekanismen mot svampar inte är känd verkar naftifinhydroklorid störa sterolbiosyntesen genom att hämma enzymet squalen 2, 3-epoxidas. Hämningen av enzymaktiviteten av detta allylamin resulterar i minskade mängder steroler, särskilt ergosterol, och en motsvarande ackumulering av squalen i cellerna.
Mekanism för resistens
Till dags dato har en mekanism för resistens mot naftifin inte identifierats.
Naftifin har visat sig vara aktivt mot de flesta isolat av följande svampar, både in vitro och vid kliniska infektioner, enligt beskrivningen i avsnitt INDIKATIONER OCH ANVÄNDNING:
- Trichophyton rubrum
- Trichophyton mentagrophytes
- Epidermophyton floccosum
Nonklinisk toxikologi
Carcinogenes, mutagenes, Försämrad fertilitet
I en tvåårig hudkarcinogenicitetsstudie administrerades naftifinhydrokloridkräm till Sprague-Dawley-råttor i topiska doser på 1 %, 2 % och 3 % (10, 20 och 30 mg/kg/dag naftifinhydroklorid). Inga läkemedelsrelaterade tumörer noterades i denna studie upp till den högsta dosen som utvärderades i denna studie på 30 mg/kg/dag (36 gånger MRHD baserat på AUC-jämförelse).
Naftifinhydroklorid visade inga tecken på mutagen eller klastogen potential baserat på resultaten av två in vitro gentoxicitetstester (Ames-assay och kromosomavvikelseassay för kromosomceller i kinesisk hamster ovariecell) och ett in vivo gentoxicitetstest (micronukleusassay för musens benmärg).
Oral administrering av naftifinhydroklorid till råttor, under hela parningen, dräktigheten, födseln och laktationen, visade inga effekter på tillväxt, fertilitet eller reproduktion, vid doser upp till 100 mg/kg/dag (12 gånger MRHD baserat på mg/m 2 jämförelse).
Kliniska studier
NAFTIN ® Gel har utvärderats med avseende på effekt i två randomiserade, dubbelblinda, vehikelkontrollerade multicenterstudier som inkluderade 1175 försökspersoner med symtomatisk och dermatofytkulturpositiv interdigital tinea pedis. Försökspersonerna randomiserades till NAFTIN ® Gel eller vehikel. Försökspersonerna applicerade naftifinhydrokloridgel 2 % eller vehikel på det drabbade området på foten en gång dagligen i två veckor. Tecken och symtom på interdigital tinea pedis (närvaro eller frånvaro av erytem, pruritus och fjällning) bedömdes och kaliumhydroxid (KOH)-undersökning och dermatofytodling utfördes 6 veckor efter den första behandlingen.
Medelåldern för studiepopulationen var 45 år, 77 % var män och 60 % var kaukasiska, 35 % var svarta eller afroamerikanska och 26 % var spansktalande eller latinamerikanska. Vid baslinjen bekräftades att försökspersonerna hade tecken och symtom på interdigital tinea pedis, positiv KOH-undersökning och bekräftad dermatofytkultur. Det primära effektmåttet var andelen försökspersoner med fullständig botning 6 veckor efter behandlingsstart (4 veckor efter den senaste behandlingen). Fullständig bot definieras som både klinisk bot (avsaknad av erytem, pruritus och fjällning) och mykologisk bot (negativ KOH- och dermatofytkultur).
Effektivitetsresultaten vid vecka 6, fyra veckor efter avslutad behandling, presenteras i tabell 1 nedan.
| Stegförsök 1 | Stegförsök 2 | |||
|---|---|---|---|---|
| Endpunkt | NAFTIN ® Gel, 2% N=382 n (%) |
Förpackning N=179 n (%) |
NAFTIN ® Gel, 2% N=400 n (%) |
Vehicle N=213 n (%) |
| * Fullständigt botande är ett sammansatt slutresultat av både mykologiskt botande och kliniskt botande. Klinisk bot definieras som frånvaro av erytem, pruritus och fjällning (grad 0). † Effektiv behandling är ett negativt KOH-preparat och negativ dermatofytkultur, erytem, fjällning och pruritus av graderna 0 eller 1 (frånvarande eller nästan frånvarande). ‡ Mykologisk bot definieras som negativ KOH- och dermatofytkultur. | ||||
| Komplett botemedel * | 64 (17%) | 3 (2%) | 104 (26%) | 7 (3%) |
| Behandlingseffektivitet † | 207 (54%) | 11 (6%) | 203 (51%) | 15 (7%) |
| Mykologiskt Cure ‡ | 250 (65%) | 25 (14%) | 235 (59%) | 22 (10%) |
Hur tillhandahålls/förvaras och hantering
Hur levereras
NAFTIN ® Gel är en färglös till gul gel som levereras i hopfällbara rör i följande storlek:
45g – NDC 54766-772-45
60g – NDC 54766-772-60
Lagring
Lagra NAFTIN ® Gel vid 25°C (77°F); utflykter tillåtna till 15-30°C (59-86°F) .
Patientrådgivning
- Informera patienterna om att NAFTIN ® Gel endast är avsedd för lokal användning. NAFTIN ® Gel är inte avsedd för oftalmisk, oral eller intravaginal användning.
- Patienterna ska uppmanas att kontakta sin läkare om irritation uppstår vid användning av NAFTIN ® Gel.
Distribueras av Sebela Pharmaceuticals Inc.
645 Hembree Parkway, Suite I, Roswell, GA 30076
www.sebelapharma.com
Toll Free 1-844-732-3521
©2020 Sebela Pharmaceuticals Inc. Alla rättigheter förbehållna.
PRINCIPAL DISPLAY PANEL – 45g Tube Carton

NDC 54766-772-45
NAFTIN ®
(Naftifine Hydrochloride) Gel, 2%
Sebela Pharmaceuticals Inc.
Endast för topisk användning
Inte för oftalmisk användning, Oral eller intravaginal användning
45g
Endast på recept
PRINCIPAL DISPLAY PANEL – 60 g Tube Carton

NDC 54766-772-60
NAFTIN®
(Naftifine Hydrochloride) Gel, 2%
Sebela Pharmaceuticals Inc.
Endast för topisk användning
Inte för oftalmisk användning, Oral eller intravaginal användning
60g
Rx Only
| NAFTIN naftifinhydrokloridgel |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
Etiketterare – Sebela Pharmaceuticals Inc. (079104574)
| Etablering | |||
| Namn | Adress | ID/FEI | Verksamhet |
| DPT Laboratories, Ltd. | 832224526 | tillverkning(54766-772), analys(54766-772), märkning(54766-772) | |
Mer om Naftin (naftifine topical)
- Biverkningar
- Under graviditet eller amning
- Dosering Information
- Prissättning & Kuponger
- En Español
- 3 Recensioner
- Generisk tillgänglighet
- Läkemedelsklass:
Konsumentresurser
- Patientinformation
- Naftin Topical (Avancerad läsning)
Resurser för yrkesverksamma
- Förskrivningsinformation
- Naftifin (AHFS Monografi)
Andra formuleringar
- Naftin-MP Topical
Relaterade behandlingsguider
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Medicinsk ansvarsfriskrivning