Lokaliserad vs. delokaliserad
Skillnaden mellan ”lokaliserad” och ”delokaliserad” existerar endast när vi beskriver elektronernas rörelse med hjälp av Lewis bindningsteori.
Enligt denna teori uppvisar lokaliserade elektroner ett normalt beteende. Ett lokaliserat lone pair förblir nära en atom. Ett lokaliserat bindningspar rör sig mellan två atomer.
Resonanshybrider innehåller med nödvändighet några ”onormala” elektroner. Ett lone pair kan tyckas ha vissa bindningsegenskaper; i stället för att hålla sig nära en atom besöker det två atomer. Ett bindningspar kan tyckas röra sig mellan två olika atompar. Dessa elektroner går utanför de gränser som Lewis teori har satt upp för dem, och vi betraktar dem som delokaliserade.
Det enklaste sättet att upptäcka delokaliserade elektroner är att jämföra elektronernas placering i två resonansformer. Om ett par förekommer på ett ställe i en form och på ett annat ställe i en annan form är paret delokaliserat.
Du kan se delokaliserat beteende i resonansformerna I och II nedan. Båda formerna innehåller två delokaliserade elektronpar. Kan du hitta dem? Vilken typ av elektronpar är delokaliserade i varje struktur?
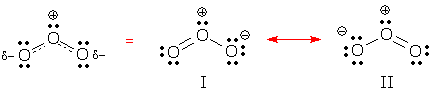
(Svar: dessa former innehåller ett delokaliserat bindningspar och ett delokaliserat ensampar.)
Delokaliserade bindningar och delokaliserade laddningar
Den ”delokaliserade” beteckningen gäller även för bindningar och laddningar.
En delokaliserad bindning är en bindning som förekommer i vissa resonansformer, men inte i andra. Resonansform I innehåller 2 lokaliserade bindningar och 1 delokaliserad bindning.
En delokaliserad laddning är en formell laddning som förekommer på en atom i vissa resonansformer och på andra atomer i andra former. Ozonets negativa laddning är delokaliserad över de två ändarna O, medan den positiva laddningen är lokaliserad på centrum O.