Azidjonen: Struktur, egenskaper och substitutionsreaktioner
Azidjonen (N3- ) är en av de kemiska enheter som bara ser konstig ut.

- Tre nitrogener på rad? check
- Två negativa laddningar och en positiv laddning, för en nettoladdning på -1 ? check
- Stabil? check (så länge den behandlas varsamt).
Det visar sig att azidjonen kan vara ytterst användbar för att bilda C-N-bindningar i nukleofila substitutionsreaktioner.
Innehållsförteckning
- Azidjonen är en fantastisk nukleofil
- Organiska azider som ”maskerade” aminer
- Exploderande på startfältet
- Nukleofil acylsubstitution med azidsalter: Acylazider
- Rearrangering av acylazider: Curtius-omarrangemanget
- Mer exempel på nukleofila azider: Azidjonen är en utmärkt nukleofil i SN2-reaktioner
Azidjonen är den konjugerade basen till hydrazonsyra, HN3. Trots att den bara är svagt basisk (HN3:s pKa är bara 4,6) är N3 en extremt bra nukleofil – enligt ett mått mer nukleofil än någon amin (se inlägget: Aminers nukleofilitet). Det är inte svårt att rationalisera varför det kan vara så när man stannar upp och tänker efter. Med fyra nukleofila ensamma par begränsade till en mycket liten volym är sannolikheten för en kollision med en elektrofil som resulterar i en reaktion mycket högre än vad den skulle vara för en amin med skrymmande alkylgrupper, för att bara ta ett exempel.
Du kan tänka dig N3- som en mager, elak, kväveförsedd missil som levererar sin nyttolast på kol snabbt, effektivt och utan betydande sidoreaktioner.
I SN2-reaktioner förskjuts primära och sekundära alkylhalogenider och sulfonater lätt av N3- , vilket resulterar i alkylazider:
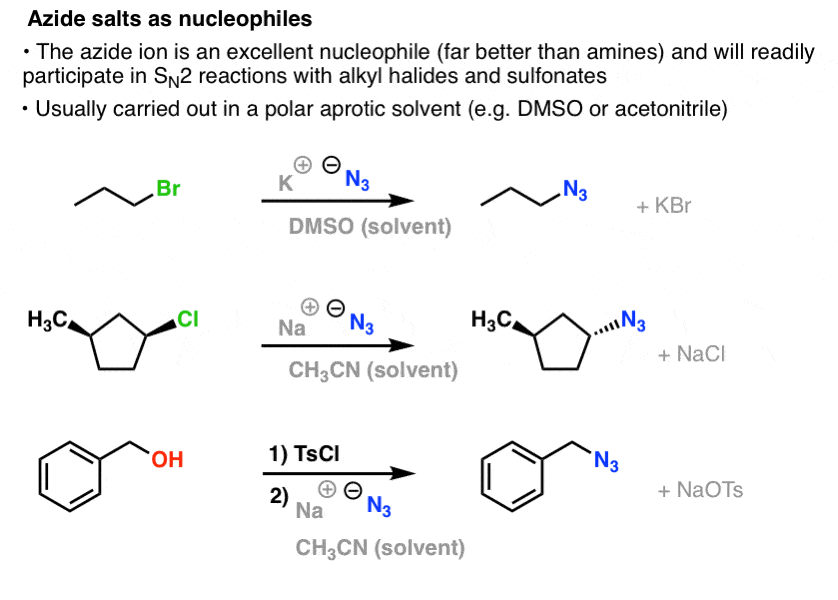
Det vanliga tillvägagångssättet är att använda ett azidsalt, såsom NaN3 eller KN3, tillsammans med lämplig alkylhalogenid i ett polärt aprotiskt lösningsmedel såsom acetonitril (CH3CN) eller dimetylsulfoxid (DMSO).
De organiska azidprodukterna är relativt stabila, även om de ser lite konstiga ut. Vissa har till och med funnit användning som läkemedel (t.ex. AZT, nedan till höger) eller som användbara sonder för att studera kemisk biologi. .
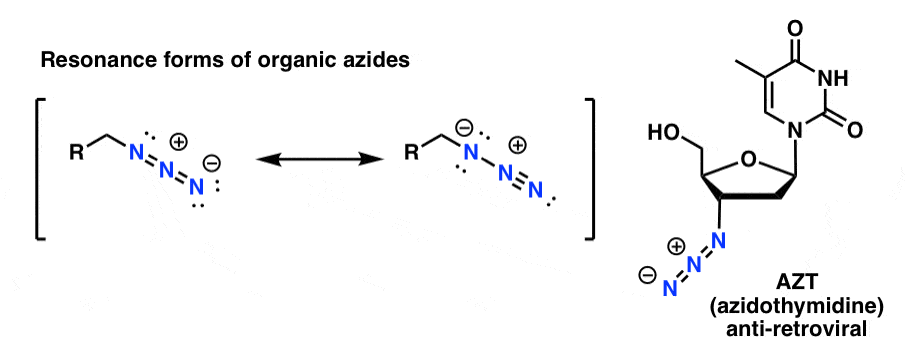
För våra syften är den mest användbara egenskapen hos organiska azider att de fungerar som ”maskerade” aminer.
2. Organiska azider som ”maskerade aminer”
Notera resonansformen ovan med en kväve-nitrogen trippelbindning. Om organiska azider behandlas med ett reduktionsmedel, t.ex. LiAlH4 eller till och med katalytisk hydrering (Pd/C , H2) kan de reduceras till primära aminer, varvid N2 frigörs i processen.
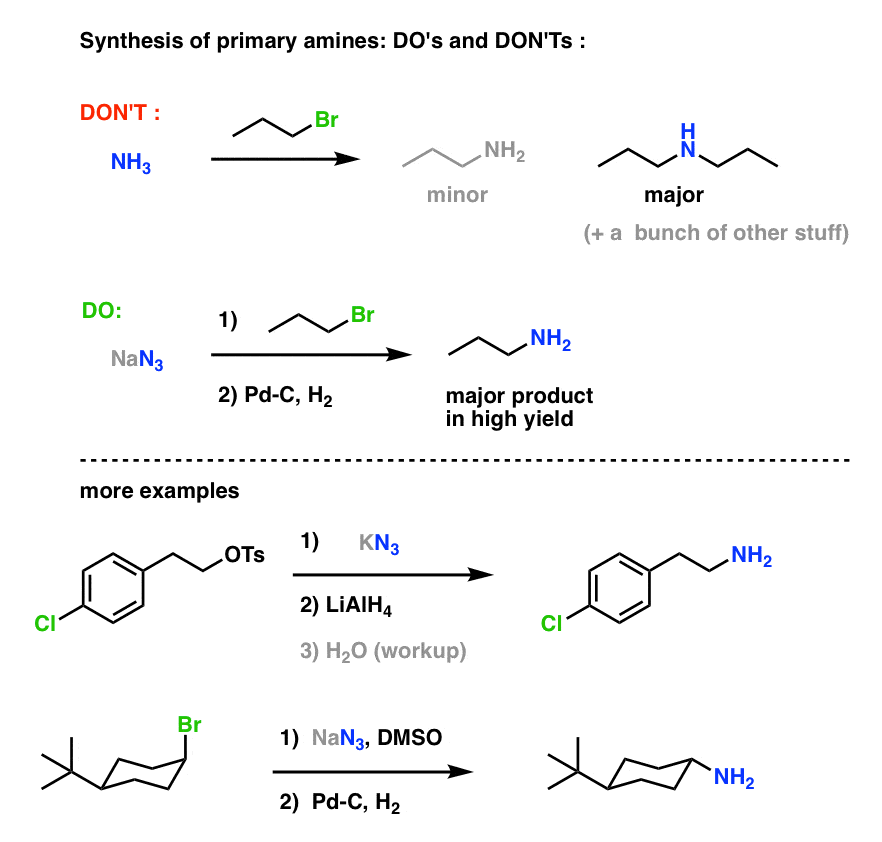
Detta utgör en mycket användbar väg till primära aminer från alkylhalogenider!
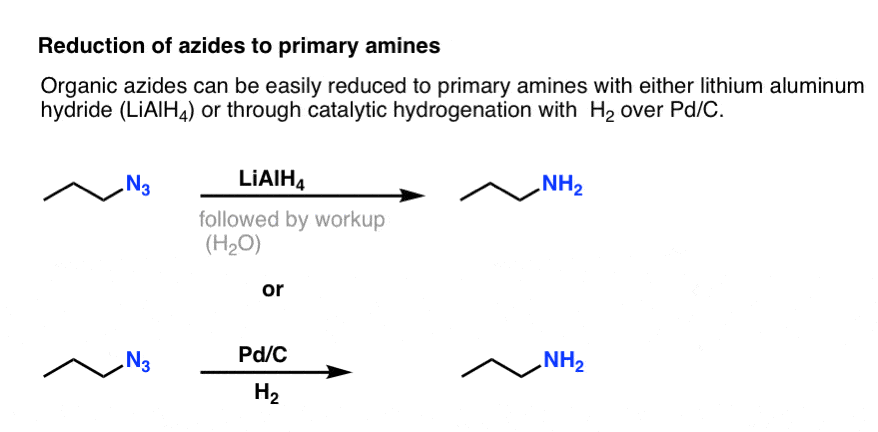
Vi har tidigare utforskat Gabriel-syntesen som en väg till primära aminer , men denna väg är överlägsen eftersom aziden kan reduceras till amin under skonsamma förhållanden (t.ex. hydrogenering). Ingen av dessa högtemperaturs klyvning av ftalimid med hydrazin att oroa sig för.
Vi såg också att framställning av primära aminer genom direkt behandling av alkylhalogenider med NH3 ofta inte resulterar i den önskade produkten, eftersom av aminer har en Cookie-Monster-liknande tendens att reagera flera gånger med alkylhalogenider: eftersom aminprodukterna tenderar att vara mer nukleofila än reaktanterna är det svårt att få aminer att stanna upp vid att mumsa bara en alkylhalogenid.
Exploderar på startfältet
Om N3 är en ”kvävetippad missil”, som vi kommenterade ovan, är det värt att påminna om vad som händer när en missil inte hanteras med försiktighet: den är i princip en bomb.
NaN3 och KN3 är vita pulver som kan förvaras på obestämd tid vid rumstemperatur och skopas upp vid bänken utan problem.
Men när de värms upp eller utsätts för stötar – då är det kört. Detsamma gäller om dessa azidsalter utsätts för syra, vilket bildar potentiellt explosiva HN3.
Och NaN3 och KN3 är de fina aziderna! Om de blandas med metallsalter av bly, kvicksilver, kadmium, zink eller silver kan ännu mer explosiva azidföreningar uppstå. Dessa metallazider är kontaktsprängämnen, varav vissa är så känsliga att de detonerar om någon pruttar sex meter längre ner i korridoren. Vissa galna kemister tillverkar till och med dessa saker med flit, men vi kommer inte att resa i närheten av den sprängningsradien för det ämnet på den här bloggen någon gång, någonsin.
NaN3 och KN3 bör användas i rimligt utspädda koncentrationer, bakom en sprängningsskärm i preparativ skala, och förresten aldrig användas tillsammans med lösningsmedlet CH2Cl2, vilket kan resultera i högexplosivt diazidometan.
Nu finns det tillfällen när en plötslig explosion av kvävgas är användbar – och potentiellt livräddande. Du kan redan ha tillbringat en del av din dag i närheten av natriumazid utan att ens inse det. Det beror på att NaN3 är ett av flera drivmedel som används i krockkuddar. När detonationen av NaN3 utlöses av en accelerometer, sprutar den ut N2-gas med en hastighet på över 200 mph och blåser upp krockkudden på 1/25 av en sekund.
Hej för azidsalter!
via GIPHY
(Men var inte den här killen):
via GIPHY
Bottom line: SN2-reaktioner mellan alkylhalogenider eller sulfonater med azider är förmodligen det enskilt bästa sättet att syntetisera primära aminer från alkylhalogenider. Det slår definitivt Gabriel-syntesen.
4. Nukleofil acylsubstitution med azidsalter ger acylazider
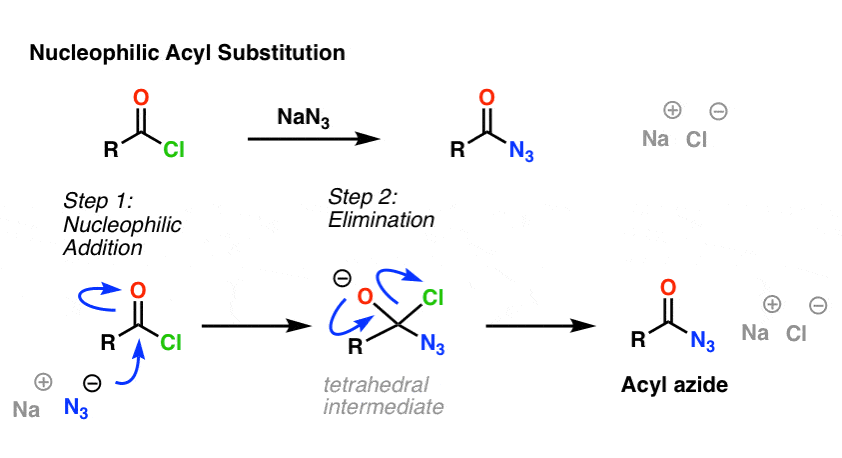
SN2-reaktionen är inte den enda typen av substitutionsreaktion som vi har utforskat. Det finns också nukleofil acylsubstitution. En karbonyl som är knuten till en bra avgångsgrupp (t.ex. en syraklorid eller anhydrid) genomgår substitution när en lämplig nukleofil tillsätts.
I mekanismens första steg angriper nukleofilen (Nu) karbonylkolet, bildar C-Nu och bryter C-O (pi). Detta ger upphov till en tetraedrisk intermediär. I det andra steget återbildas C-O pi-bindningen och kol-(avgångsgrupp)-bindningen bryts, vilket resulterar i den nukleofila acylsubstitutionsprodukten.
Här är ett exempel på en nukleofil acylsubstitutionsreaktion mellan en syraklorid och N3-jonen för att ge en acylazid:
5. Omgruppering av acylazider: Curtius-omarrangemanget
Den vanligaste användningen av acylazider är att de vid upphettning omarrangeras för att ge isocyanater i en reaktion som kallas Curtius-omarrangemanget.
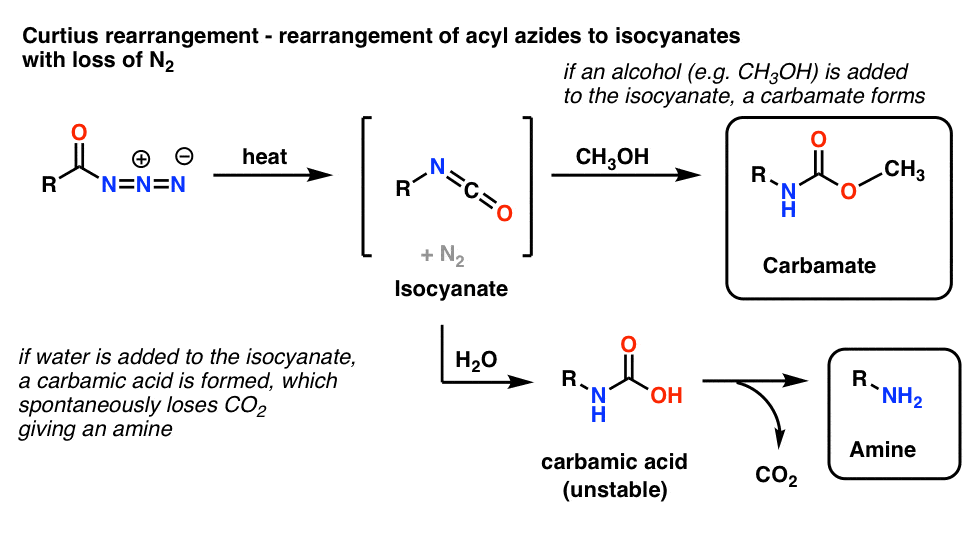
- Om Curtius-rearrangemanget utförs i närvaro av en alkohol som metanol bildas en karbamat.
- Om vatten i stället tillsätts bildas kortvarigt en instabil karbaminsyra, som sedan förlorar koldioxid för att ge en primär amin.
Varför kan detta vara användbart? Här är ett sätt.
Det finns många metoder för att göra aromatiska karboxylsyror, men inte så många bra sätt att bilda C-N-bindningar på aromatiska ringar. Säg att du har en bensoesyra (t.ex. p-metylbensoesyra) men behöver bilda en (skyddad) aromatisk amin. Curtius-protokollet utgör ett bra sätt att bilda en ny C-N-bindning på ringen utan att behöva tillgripa nitrering + reduktion.
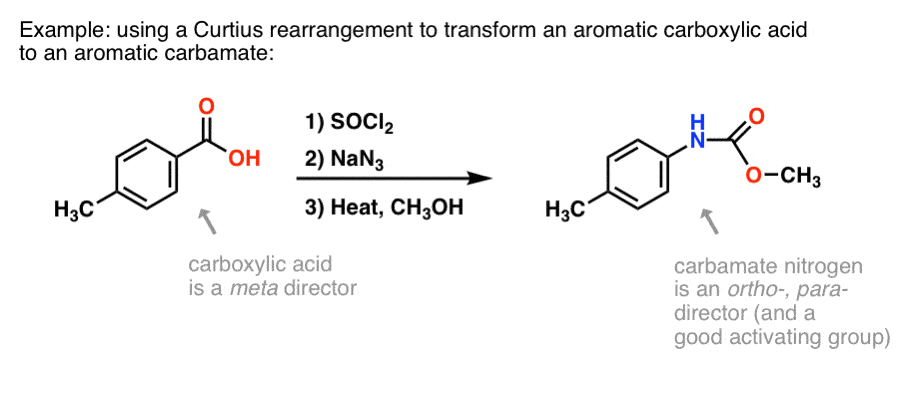
(På detta sätt är det något analogt med en kväveekvivalent till Baeyer-Villiger-oxidationen. )
Mer exempel på azidkyleofiler: Epoxidöppning och konjugerad addition
Två ytterligare tillämpningar av azidjonen som nukleofil inkluderar öppning av epoxider (i vad som i huvudsak är en SN2-process – notera konfigurationsinversionen) och även konjugerad addition på alfa- och beta-omättade ketoner:
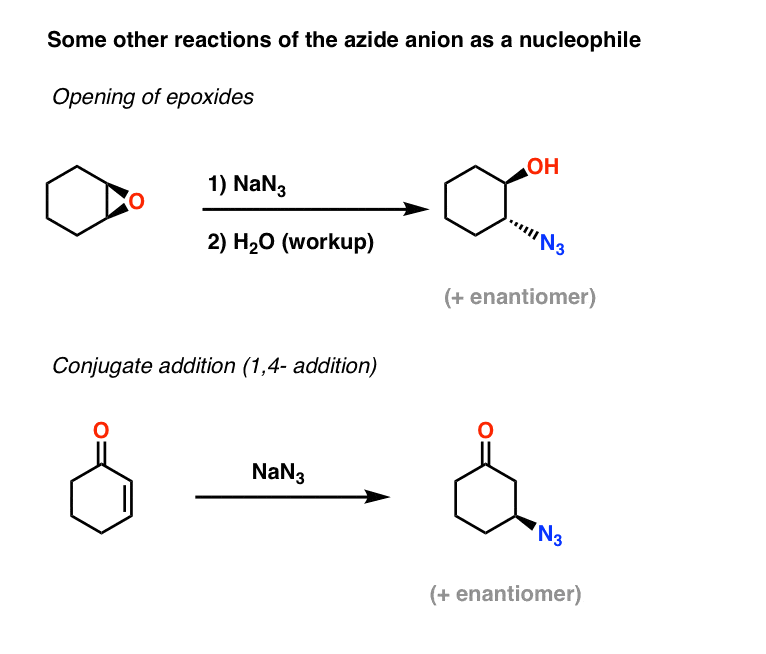
De resulterande alkylaziderna kan sedan reduceras till primära aminer med hjälp av de metoder som behandlas ovan.
Noter
Fotnot: Azid-Alkyne Cycloadditions, a.k.a. ”Click”-kemi
En intressant och användbar tillämpning av organiska azider som ännu inte har kommit med i inledande läroböcker i organisk kemi (men som troligen kommer att göra det inom en snar framtid) är en process som tekniskt kallas ”koppar-katalyserad azid-alkyne-cykloaddition”, men som vanligen bara kallas för ”alkyne-azid-klickreaktion”.
När en terminal alkan behandlas med en kopparkatalysator i närvaro av en organisk azid uppstår snabbt en cycloaddition som leder till bildandet av en 1,2,3-triazol.
Vi kommer inte att gå djupt in i detaljerna, men denna ringbildande reaktion involverar 6 pi-elektroner och är en kusin till Diels-Alder-reaktionen (nitpckers kommer med rätta att notera att den koppar-katalyserade versionen tekniskt sett inte är en samverkande process, men att den icke-katalyserade versionen är det)
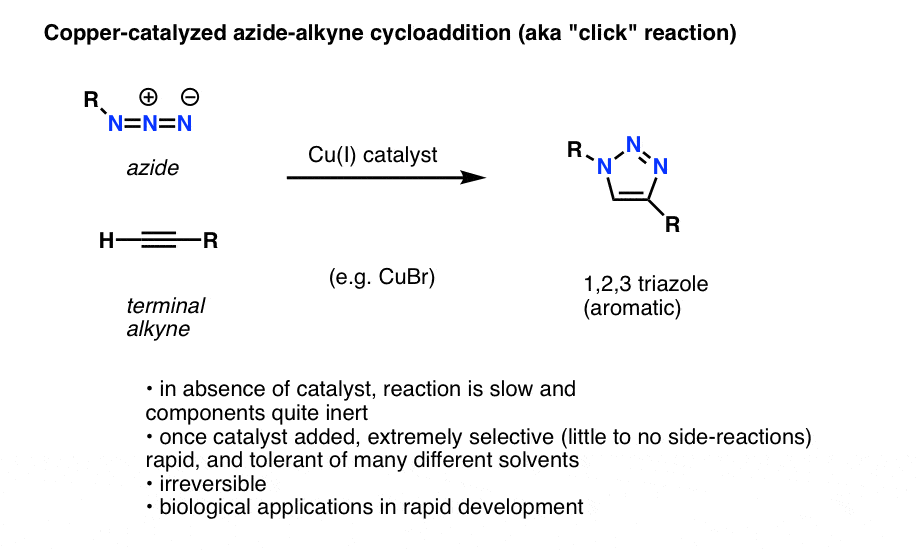
Reaktionen är anmärkningsvärd av ett par skäl:
- De reaktiva partnerna (terminal alkan och organisk azid) är relativt inerta i avsaknad av en katalysator under de flesta förhållanden.
- När koppar tillsätts sker reaktionen extremt snabbt under milda förhållanden och i en mängd olika lösningsmedel (inklusive vatten).
- Det är extremt selektivt under dessa förhållanden,alkanen och azidpartnerna reagerar endast med varandra, irreversibelt.
- Produkten, en triazolring, är aromatisk och stabil
Den har kallats för en ”klick”-reaktion av en av upphovsmännen, Barry Sharpless, eftersom den är något av det närmaste kemisterna kommer en reaktion som liknar ett smidigt ”klickande” av två kompletterande legobitar.
Vad som har gjort denna reaktion särskilt användbar på senare tid är att azid- och alkylpartners kan installeras i molekyler av biologiskt intresse och ”klickas” ihop när så önskas.
Till exempel:
- Att sätta en acetylen i 5′-positionen av ett socker och en azid i 3′-positionen har använts för att göra ”klickat” DNA, där triazolen ersätter organofosfatet.
- Otroligt nog har en grupp tillverkat ”klickat” DNA, placerat det i mänskliga celler och lyckats få det transkriberat av budbärar-RNA.
- Azidinnehållande AZT (ovan) fungerar genom att sätta stopp för transkriberingsmaskineriet. Några smarta människor hittade ett sätt att tillämpa azid-alkyneklickreaktionen för snabb sekvensering av arvsmassan, en teknik som kallas ClickSeq.
Takata använde natriumazid i början av 1990-talet och övergick sedan till tetrazol och därefter ammoniumnitrat.
Från ”Sixty Million Car Bombs: Enligt Upham, som också granskade industrins patent, var ammoniumnitrat ungefär en tiondel så dyrt som tetrazol. Men ammoniumnitratet hade en kritisk brist som enligt honom fick andra tillverkare av krockkuddar att ge upp: Ammoniumnitratet har fem faser med varierande densitet som gör det svårt att hålla det stabilt över tiden. Ett drivmedel tillverkat av ammoniumnitrat skulle svälla och krympa vid temperaturförändringar, och så småningom skulle tabletten brytas ner till pulver. Vatten och fukt skulle påskynda processen. Pulver brinner snabbare än en tablett, så en krockkudde vars drivmedel hade smulats sönder skulle sannolikt utlösas för aggressivt. Den kontrollerade explosionen skulle bara bli en explosion. ”Alla gick en viss väg och bara Takata gick en annan väg”, säger Jochen Siebert, som har följt krockkuddebranschen sedan 1990-talet och nu är verkställande direktör för JSC Automotive Consulting. ”Om man läser konferenshandlingarna från den tiden kan man faktiskt se att folk sa: ’Nej, det borde ni inte göra’. Det är farligt. ”
Spill från de felaktiga krockkuddarna har dödat 13 personer världen över och skadat fler än 100.
Den 25 juni 2017 ansökte Takata om konkurs, med skulder på över 11 miljarder dollar.
Primär aminsyntes ”Do’s and Don’ts” :
(Avancerat) Referenser och vidare läsning
Azider är användbara i organisk syntes, och en höjdpunkt på azidkemi ges i referenserna nedan.
- Azidjonens nukleofila reaktivitet i olika lösningsmedel
Thanh Binh Phan, Herbert Mayr
Phys. Org. Chem. 2006, 19 (11), 706-713
DOI: 10.1002/poc.1063- SN2-förskjutningar vid 2-norbornylbrosylater
Klaus Banert och Wolfgang Kirmse
Journal of the American Chemical Society 1982, 104 (13), 3766-3767
DOI: 1021/ja00377a057- An Improved Synthesis of Azidothymidine
I. Balagopala, A. P. Ollapally, & H. J. Lee
Nucleosides, Nucleotides & Nucleic Acids 1996, 4, 899-906
DOI: 10.1080/07328319608002136
Azider kan användas som nukleofiler i SN2-reaktioner. Ref. #3 visar användningen av azidjoner vid syntesen av AZT (azidothymidin). Omvandlingen av 1 till 5 via 3 i ref. #3 använder Mitsunobu-reaktionen, som tillåter förskjutning av en -OH-grupp med en nukleofil med inversion av konfigurationen.- Reduktion av organiska azider till primära aminer med litiumaluminiumhydrid
H. Boyer
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
DOI: 10.1021/ja01156a507
Reduktionen av organiska azider till primära aminer är en bekväm metod för att syntetisera primära aminer, som annars är svåra att syntetisera selektivt med standardmetoder.- Metallazidernas explosiva känslighet för slag
P. G. Fox
J. Solid State Chem. 1970, 2 (4), 491-502
DOI: 10.1016/0022-4596(70)90043-5
En undersökning av stötkänsligheten hos NaN3, TlN3 och Pb(N3)2.- The Curtius Reaction
Smith, P. A. S. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
En gammal men omfattande genomgång av Curtius-reaktionen, som omfattar historien om upptäckten av denna omarrangemang, substratets räckvidd, begränsningar, jämförelser med andra liknande reaktioner och experimentella förfaranden.- Syntetiska metoder och reaktioner. 121. Zinkjodidkatalyserad framställning av aroylazider från aroylklorider och trimetylsilylazid
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi och George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051b
En bekväm procedur för framställning av aromatiska arylazider från nobelpristagaren professor George A. Olah. Dessa kan sedan användas för Curtius omarrangemang. - SN2-förskjutningar vid 2-norbornylbrosylater
Epoxidöppning och konjugerad addition:
- CYCLOHEXEN IMINE (7-AZA-BICYCLOHEPTANE)
Iain D. G. Watson, Nicholas Afagh och Andrei K. Yudin
Org. Synth. 2010, 87, 161-169
DOI: 10.15227/orgsyn.087.0161
Detta är ett särskilt användbart förfarande, eftersom det är en Staudingerreaktion för att omvandla epoxider till NH-aziridiner (kväveanalog till epoxider). Syntesen kan vara knepig, men många detaljer har tillhandahållits här så att detta kan reproduceras, som passande en procedur i Organic Syntheses. - Amin-katalyserad addition av azidjon till α,β-omättade karbonylföreningar
David J. Guerin, Thomas E. Horstmann och Scott J. Miller
Organic Letters 1999, 1 (7), 1107-1109
DOI: 10.1021/ol9909076
Denna artikel är intressant eftersom den representerar en tidig form av organokatalys och troligen sker genom en imin- eller iminiumjonintermediat. Tyvärr används termen inte någonstans i artikeln – dessa författare kunde ha slagit professor MacMillan på fingrarna! - Click Chemistry: Diverse Chemical Function from a Few Good Reactions
Hartmuth C. Kolb Dr. M. G. Finn Prof. K. Barry Sharpless Prof.
Angew Chem. Int. Ed. 2001, 40 (11), 2004-2021
DOI: 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5
Den Cu-katalyserade cykladditionen av azider med alkyner har av Nobelpristagaren prof. K. Barry Sharpless (The Scripps Research Institute, La Jolla, CA) på grund av dess enkelhet, höga utbyte, snabba kinetik och kompatibilitet med ett stort antal förhållanden och substrat. Cu-fria reaktioner är också möjliga om ansträngda alkyner används (t.ex. cyklooktyner).