Los espasmos de los párpados y la cara pueden afectar significativamente a la calidad de vida del paciente, pero llegar a la causa raíz del espasmo -puede ser mioquimia, blefaroespasmo esencial benigno o espasmo hemifacial- puede ser un reto para el clínico. En este artículo, proporcionaremos consejos que pueden ayudarle a diagnosticar y manejar estas condiciones a veces desafiantes.
Una visión general
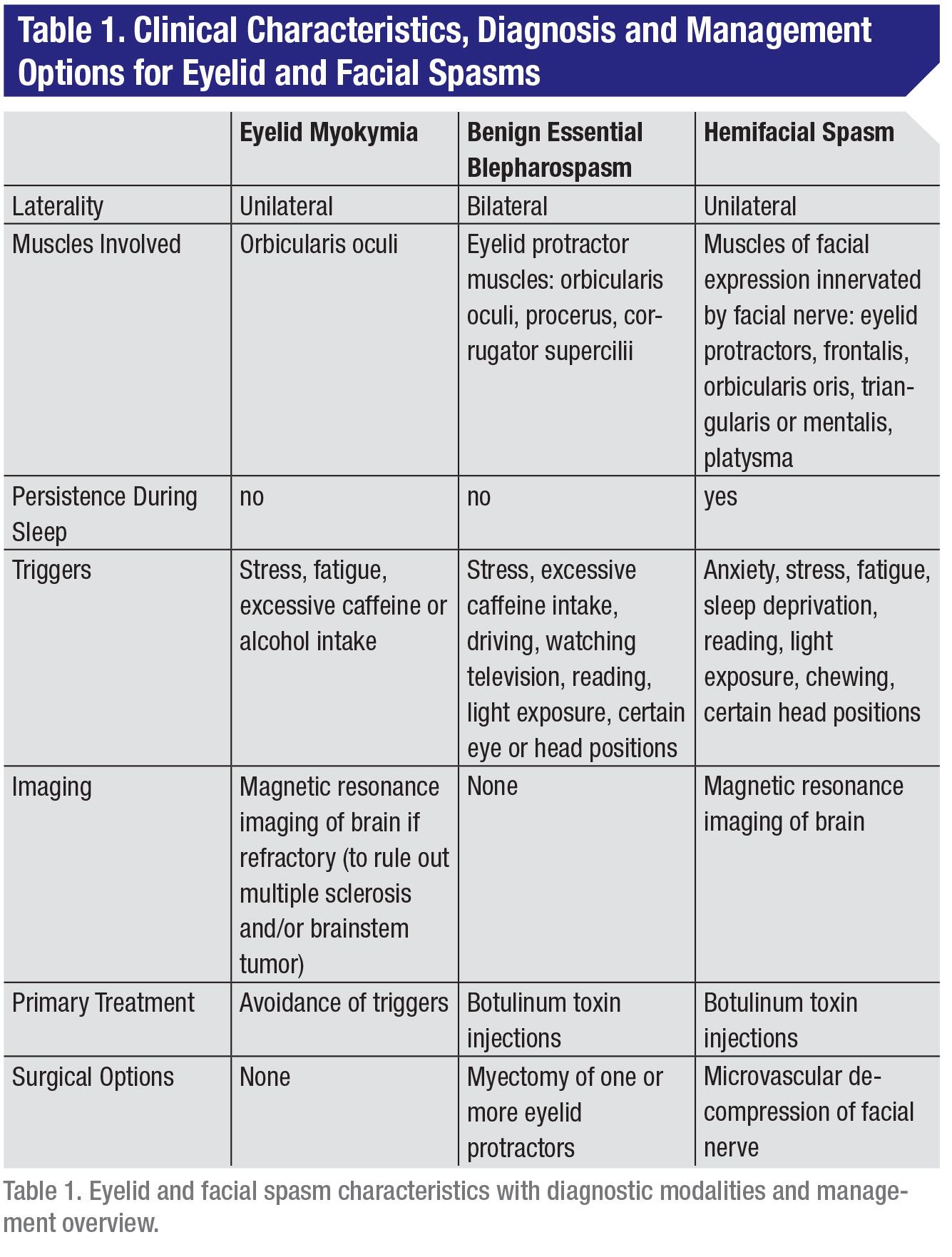
Dentro de la práctica neurológica y oftalmológica, clasificados de menor a mayor gravedad, el espectro de los espasmos palpebrales y faciales incluye la mioquimia palpebral (pequeñas contracciones involuntarias del párpado), el blefaroespasmo esencial benigno (espasmos involuntarios que hacen que el ojo se cierre parcial o totalmente) y el espasmo hemifacial (espasmos en los músculos que controlan las expresiones faciales) (Tabla 1). Todos estos trastornos consisten en movimientos faciales involuntarios que pueden ser difíciles de manejar en la vida diaria para los pacientes.
Mioquimia de los párpados
El trastorno de movimientos faciales involuntarios más común es la mioquimia de los párpados. La mioquimia de los párpados consiste en contracciones involuntarias, finas, continuas, ondulantes y no sincronizadas de las fibras musculares estriadas de los protractores de los párpados. En electrofisiología, se caracteriza por la descarga asíncrona espontánea de unidades motoras adyacentes en dobletes o tripletes a una frecuencia de 30 a 70 hercios con intervalos de 100 a 200 ms que separan las descargas individuales.2,3 La mioquimia de los párpados se considera un proceso benigno y autolimitado que es unilateral e intermitente, y que afecta más al párpado inferior que al superior. Los episodios son transitorios, y pueden durar desde unos pocos días hasta unas pocas semanas o meses, y los espasmos se producen de forma intermitente a lo largo del día durante varias horas.4
Los factores desencadenantes son el estrés, el agotamiento, la ingesta excesiva de cafeína o el consumo de alcohol, y el esfuerzo físico.5 Se recomienda la eliminación de estos factores desencadenantes como parte del tratamiento. La mioquimia de los párpados suele estar aislada en el músculo orbicular de los ojos, pero puede extenderse a otros músculos de uno o ambos lados de la cara, en cuyo caso se denomina mioquimia facial.2
La mioquimia facial está causada por el daño del núcleo del nervio facial en el puente de Varolio a causa de enfermedades desmielinizantes como la esclerosis múltiple o la compresión de tumores del tronco cerebral. En raras ocasiones, se ha descrito la mioquimia persistente de los párpados como signo de presentación de la esclerosis múltiple o de un tumor del tronco cerebral.3 Si la afección es crónica, refractaria a la eliminación de los factores desencadenantes y afecta a la calidad de vida del paciente, las inyecciones de toxina botulínica pueden tener éxito en el tratamiento. El mecanismo y la eficacia de las inyecciones de toxina botulínica se discuten ampliamente en la siguiente sección. La mioquimia persistente de los párpados refractaria a los tratamientos anteriores debe hacer sospechar de una lesión del tronco cerebral como la descrita anteriormente y justifica el análisis con resonancia magnética.
Blefaroespasmo esencial benigno
El BEB se describió por primera vez en 1857 como un trastorno de espasmos involuntarios de los músculos protractores de los párpados que provoca el cierre parcial o completo de los mismos. La BEB tiene una incidencia de 1,4 a 13,3 casos por cada 100.000, afecta tres veces más a las mujeres que a los hombres y se presenta con mayor frecuencia entre la quinta y la séptima décadas de la vida.7,8 La BEB es, en la mayoría de los casos, un trastorno esporádico, pero se ha informado de que el 27 por ciento de los pacientes tienen un familiar con distonía, lo que sugiere un posible componente genético.1
La fisiopatología de la BEB no se conoce bien. Los estudios de tomografía por emisión de positrones y de resonancia magnética funcional han mostrado la activación de las regiones cerebrales implicadas en el control y la regulación de los músculos responsables del parpadeo, incluyendo el tálamo, el cuerpo estriado, la corteza visual anterior, la corteza motora primaria y el cerebelo superior.7,9Los estudios en animales han demostrado que el agotamiento de la dopamina en la sustancia negra disminuye la inhibición del reflejo del parpadeo del trigémino, lo que conduce a una hipersensibilidad de este reflejo en respuesta a la luz y a la sequedad.10 Entre los factores desencadenantes de la BEB se encuentran el estrés, la ingesta excesiva de cafeína, conducir, ver la televisión, leer, las luces brillantes, el aire contaminado, el viento, el ruido y determinados movimientos de los ojos y la cabeza.11,12
La presentación clínica de la BEB consiste en espasmos involuntarios bilaterales de uno o más de los músculos protractores de los párpados, incluidos los músculos orbicular, procerus y corrugador, con síntomas que van desde un leve aumento de la frecuencia de parpadeo hasta un cierre forzado de los párpados que puede provocar ceguera funcional.1 Los síntomas de la BEB no persisten durante el sueño y es una enfermedad progresiva en la que se involucran músculos adicionales con el tiempo.7 Un subgrupo de pacientes puede experimentar espasmos en la parte media o inferior de la cara, una condición denominada síndrome de Meige.1 Un subgrupo adicional de pacientes puede desarrollar apraxia de la apertura de los párpados en la que hay una pérdida de co-inhibición entre los protractores y retractores de los párpados que resulta en una incapacidad no paralítica para abrir los párpados en ausencia de espasmo muscular.1
Los pacientes también se quejan a menudo del síntoma sensorial de fotofobia. Los mecanismos propuestos para la fotofobia incluyen un trastorno de dolor mantenido simpáticamente, para el que los bloqueos del ganglio cervical superior han proporcionado alivio en informes anteriores.11 Otras opciones de tratamiento para controlar la fotofobia incluyen la modulación fotocromática con lentes tintadas FL-41 o lentes de contacto esclerales con fluoresceína en el depósito de fluido, que aumentan la intensidad de la luz tolerada por los pacientes con BEB.13
El tratamiento de elección para la BEB son las inyecciones de toxina botulínica en los músculos protractores del párpado afectados. La toxina botulínica inhibe la liberación de acetilcolina de la terminal presináptica de la unión neuromuscular, bloqueando la capacidad de contracción del músculo inyectado. Hay siete serotipos de toxina botulínica (de la A a la G). Los tipos A y B están aprobados por la Administración de Alimentos y Medicamentos de EE.UU. para su uso clínico en el país. La OnabotulinumtoxinA (Botox) fue aprobada por la FDA para el tratamiento de la BEB en 1989 y es la formulación más utilizada, aunque la incobotulinumtoxinA, la abobotulinumtoxinA y la rimabotulinumtoxinB también están autorizadas para su uso.14 Las inyecciones son necesarias aproximadamente cada tres o cuatro meses.11 La FDA recomienda una dosis inicial de 1,25 a 2,5 unidades inyectadas en cada zona afectada con una dosis máxima de 15 unidades y tres puntos de inyección por lado.14 Sin embargo, las encuestas han demostrado que los cirujanos oculoplásticos tienden a tratar la BEB con una dosis inicial media de 22,5 ±9,5 unidades.14
Típicamente, se inyectan de cinco a ocho sitios alrededor de cada ojo, con no más de 0,1 ml de toxina botulínica inyectada en cada sitio para evitar la difusión del fármaco en los músculos adyacentes.12 Los clínicos deben tener cuidado de inyectar medial y lateralmente cuando traten la porción pretarsal del músculo orbicular del ojo en los párpados superiores, para evitar la inyección en el músculo levator palpebrae superioris, que puede provocar ptosis. Del mismo modo, en el párpado inferior, las inyecciones se realizan de forma central y lateral para evitar la inyección en el oblicuo inferior, que provocaría diplopía. Se ha informado de que la incidencia de efectos adversos de las inyecciones de toxina botulínica en pacientes con BEB es de alrededor del 20 por ciento, incluyendo equimosis en el lugar de la inyección, ojo seco, lagrimeo, sensación de cuerpo extraño, lagoftalmos, diplopía y ptosis.7
Otros medicamentos que se han utilizado en el tratamiento de la BEB incluyen antipsicóticos, antiepilépticos, ansiolíticos, antidepresivos, antihistamínicos, sedantes y estimulantes, aunque ninguno ha demostrado tener eficacia a largo plazo.15 En particular, los agonistas de la dopamina y los inhibidores de la captación de dopamina han demostrado ser eficaces para reducir los espasmos de los párpados, dado que la deficiencia de dopamina se ha implicado en la patogénesis de la BEB.11 El metilfenidato, que bloquea la recaptación presináptica de dopamina y norepinefrina, ha demostrado disminuir los espasmos de los párpados y la puntuación de la discapacidad.11 Los pacientes con BEB han mostrado una respuesta parcial a los agonistas del ácido gamma-aminobutírico, como las benzodiacepinas, pero su uso está limitado por el efecto secundario de la somnolencia.11
Cuando la BEB es refractaria al tratamiento médico o un paciente no puede tolerar las inyecciones de toxina botulínica, puede considerarse la intervención quirúrgica con miectomía. Los objetivos principales de este procedimiento son reducir la gravedad del espasmo y aumentar el intervalo de tiempo necesario entre las inyecciones de botulina.11 En la miectomía quirúrgica, se resecan uno o más de los músculos protractores. Una miectomía limitada implica la resección de sólo una parte del músculo orbicular del párpado superior, frente a una miectomía ampliada en la que se extirpan además el corrugador superciliar y el transportador.15
Los efectos adversos de la cirugía incluyen una mala cosmética y la necesidad de cirugías adicionales. Se ha informado de que la recurrencia de los síntomas después de la miectomía quirúrgica oscila entre el 30 y el 50 por ciento de los casos después de seis meses.12 Un procedimiento alternativo consiste en la sección del nervio facial, que denerva eficazmente los protractores de los párpados, pero provoca secundariamente una parálisis del nervio facial, por lo que rara vez se utiliza.15

Espasmo hemifacial
Por último, el HFS es un trastorno del movimiento facial involuntario unilateral que implica espasmos de los músculos de la expresión facial inervados por el nervio facial. La incidencia estimada es de aproximadamente 10 casos por cada 100.000, según estudios realizados en Minnesota y Noruega.16,17 El HFS tiende a producirse en la cuarta o quinta década de la vida, afectando a las mujeres entre dos y tres veces más que a los hombres, y a las poblaciones asiáticas con mayor frecuencia que a las caucásicas.18 Hasta un tercio de los pacientes señalan factores agravantes del HFS, como la ansiedad, el estrés, la fatiga, la privación del sueño, la lectura, la exposición a la luz, la masticación o determinadas posiciones de la cabeza.18 El HFS suele diagnosticarse erróneamente como funcional o psicógeno (en el 38 por ciento de los casos), tics (en el 29 por ciento) y parálisis del nervio facial (en el 9 por ciento).19 La presentación clínica consiste en espasmos iniciales del orbicular de los ojos que progresan gradualmente o se extienden con el tiempo para implicar a otros músculos de una mitad de la cara, como el frontal, el orbicular de los ojos, el triangular o el mental, e incluso el músculo platisma.7,18 Los síntomas del HFS pueden persistir durante el sueño, mientras que los de la BEB no lo hacen.
La fisiopatología del HFS implica la compresión del nervio facial en su zona de salida de la raíz (REZ) del tronco cerebral, que se describió por primera vez en 1947.20 La compresión puede estar causada por vasos aberrantes, incluyendo la arteria cerebelosa inferior anterior, la arteria cerebelosa inferior posterior, la arteria basilar, la arteria vertebral; malformaciones arteriovenosas; y muy raramente por tumores como schwannomas acústicos, meningiomas, tumores de la glándula parótida y astrocitomas pilocíticos.7 Aunque el diagnóstico del HFS es principalmente clínico, siempre debe obtenerse una resonancia magnética para descartar la compresión del nervio facial, como se ha descrito anteriormente. También pueden realizarse pruebas de electromiografía para demostrar una respuesta patognomónica de propagación lateral de los impulsos entre las fibras vecinas del nervio facial («transmisión efáptica»).20
La base del tratamiento del HFS son las inyecciones de toxina botulínica, como se ha descrito anteriormente para la BEB. Para el HFS, se inyectan de cinco a diez sitios en el lado afectado de la cara con dosis totales de onabotulinumtoxinA que oscilan entre 10 y 34 unidades por tratamiento.20 El tratamiento definitivo para el HFS es la descompresión microvascular neuroquirúrgica (MVD) para aliviar la compresión del nervio facial en su REZ. En estudios anteriores, aproximadamente el 95% de los pacientes sometidos a MVD para el HFS obtuvieron resultados buenos o incluso excelentes, con efectos adversos como parálisis del nervio facial en el 19%, déficits auditivos en el 7% y parálisis de los nervios craneales inferiores en el 2,8%.21 Dada la invasividad y los riesgos asociados a someterse a una intervención neuroquirúrgica, es de suma importancia mantener una conversación franca con los pacientes sobre los riesgos y beneficios de la MVD frente a las inyecciones de toxina botulínica, o una combinación de ambas, para el tratamiento del HFS.
El tratamiento definitivo del espasmo hemifacial es la descompresión microvascular neuroquirúrgica (MVD) para aliviar la compresión del nervio facial en su zona de salida de la raíz.
En conclusión, los espasmos palpebrales y faciales representan un espectro de trastornos de los movimientos faciales involuntarios que pueden tener un grave impacto en la calidad de vida y el bienestar psicológico de los pacientes. Aunque se recomienda evitar los factores desencadenantes en el tratamiento, las inyecciones de toxina botulínica han surgido como tratamiento de primera línea, especialmente para la BEB y la HFS. Sin embargo, la terapia quirúrgica para la BEB y el HFS puede llevarse a cabo en casos refractarios o en pacientes que no toleran las inyecciones de toxina botulínica. Dado el frecuente diagnóstico erróneo de estos trastornos, es importante que los médicos estén familiarizados con los signos y síntomas de presentación más comunes para poner a estos pacientes en contacto con neurólogos u oftalmólogos para su posterior evaluación y manejo. REVISIÓN
El Dr. Gervasio es residente de oftalmología en el Wills Eye Hospital. El Dr. Moster es médico adjunto en el Servicio de Neuro-Oftalmología de Wills y profesor de neurología y oftalmología en la Universidad Thomas Jefferson de Filadelfia. Es presidente de neurooftalmología en el Einstein Medical Center de Filadelfia.
1. Hwang CJ, Eftekhari K. Benign essential blepharospasm: Lo que sabemos y lo que no. Int Ophthalmol Clin 2018;58:1:11-24.
2. Miller NR. Mioquimia de los párpados. Surv Ophthalmol 2011;56:3:277-8.
3. Barmettler A, Dinkin MJ, Lelli GJ. Mioquimia de los párpados: No siempre benigna. Orbit 2011;30:6:289-90.
4. Jordan DR, Anderson RL, Thiese SM. Mioquimia orbicular intratable: Alternativas de tratamiento. Ophthalmic Surg 1989;20:4:280-3.
5. Horowitz SH. Espasmo hemifacial y mioquimia facial: Hallazgos electrofisiológicos. Muscle Nerve 1987;10:422-427.
6. Mackenzie W. Case of intense and long-continued photophobia and blepharospasm, relieved by the inhalation of chloroform. Med Chir Trans 1857;40:175-178.
7. Ozzello DJ, Giacometti JN. Toxinas botulínicas para el tratamiento del blefaroespasmo esencial y el espasmo hemifacial. Int Ophthalmol Clin 2018;58:1:49-61.
8. Bradley EA, Hodge DO, Bartley GB. Blefaroespasmo esencial benigno entre los residentes del condado de Olmsted, Minnesota, 1976-1995: Un estudio epidemiológico. Ophthal Plast Reconstr Surg 2003;19:177-181.
9. Baker RS, Andersen AH, Morecraft RJ, et al. A functional magnetic resonance imaging study in patients with benign essential blepharospasm. J Neuroophthalmol 2003;23:11-15.
10. Schicatano EJ, Basso MA, Evinger C. Animal model explains the origins of the cranial dystonia benign essential blepharospasm. J Neurophysiol 1997;77:2842-2846.
11. Yen MT. Avances en el tratamiento del blefaroespasmo esencial benigno. Curr Opin Ophthalmol 2018;29:440-44.
12. Coscarelli JM. Blefaroespasmo esencial. Semin Ophthalmol 2010;25:3:104-8.
13. Herz NL, Yen MT. Modulación de la fotofobia sensorial en el blefaroespasmo esencial con lentes cromáticas. Ophthalmology 2005;112:2208-2211.
14. Broadbent TJ, Wesley RE, Mawn LA. A survey of current blepharospasm treatment patterns among oculoplastic surgeons. Ophthalmic Plast Reconstr Surg 2016;32:1:24-7.
15. Ben Simon GJ, McCann JD. Blefaroespasmo esencial benigno. Int Ophthalmol Clin 2005;45:49-75.
16. Auger RG, Whisnant JP. Hemifacial spasm in Rochester and Olmsted County, Minnesota, 1960 to 1984. Arch Neurol 1990;47:1233-34.
17. Nilsen B, Le KD, Dietrichs E. Prevalencia del espasmo hemifacial en Oslo, Noruega. Neurology 2004;63:1532-33.
18. Lefaucheur JP, Daamer NB, Sangla S, Guerinel CL. Diagnóstico del espasmo hemifacial primario. Neurochiurgie 2018;64:2:82-86.
19. Martínez AR, Nunes MD, Immich ND, et al. El diagnóstico erróneo del espasmo hemifacial es un evento frecuente en el ámbito de la atención primaria. Arq Neuropsiquiatr 2014;72:119-22.
20. Campbell E, Keedy C. Hemifacial spasm: Una nota sobre la etiología en dos casos. J Neurosurg 1947;4:342-47.
21. Huh R, Han IB, Moon JY, et al. Descompresión microvascular para el espasmo hemifacial: Análisis de las complicaciones operatorias en 1582 pacientes consecutivos. Surg Neurol 2008;69:153-57.