Karbokationivälituotteiden stabiilisuus
Tiedämme, että SN1-reaktion nopeutta rajoittava vaihe on ensimmäinen vaihe – tämän karbokationivälituotteen muodostuminen. Tämän vaiheen nopeus – ja siten koko substituutioreaktion nopeus – riippuu sen prosessin aktivoitumisenergiasta, jossa hiilen ja poistuvan ryhmän välinen sidos katkeaa ja karbokationi muodostuu. Hammondin postulaatin (kohta 6.2B) mukaan mitä stabiilimpi karbokationin välivaihe on, sitä nopeammin tämä ensimmäinen sidoksen murtumisvaihe tapahtuu. Toisin sanoen todennäköisyys, että nukleofiilinen substituutioreaktio etenee dissosiatiivisella (SN1) mekanismilla, riippuu suurelta osin muodostuvan karbokationivälituotteen stabiilisuudesta.
Kriittiseksi kysymykseksi tulee nyt, mikä vakauttaa karbokationin?
Jos siis negatiivisen varauksen vakauttamiseen tarvitaan elektronia vetävä ryhmä, mikä vakauttaa positiivisen varauksen? Elektronia luovuttava ryhmä!
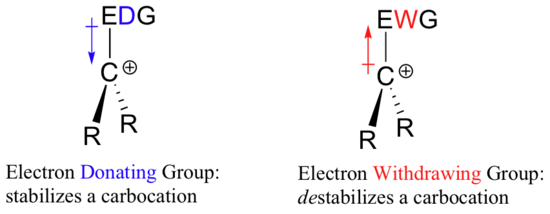
Positiivisesti varautunut laji, kuten karbokationi, on hyvin elektroniköyhä, ja näin ollen mikä tahansa, mikä luovuttaa elektronitiheyttä elektroniköyhän keskukseen, auttaa vakauttamaan sitä. Kääntäen, karbokationia epävakauttaa elektronia vetävä ryhmä.
Alkyyliryhmät – metyyli, etyyli ja vastaavat – ovat heikkoja elektronia luovuttavia ryhmiä, ja näin ollen ne stabiloivat lähellä olevia karbokationeja. Tämä tarkoittaa sitä, että yleensä enemmän substituoidut karbokationit ovat vakaampia: esimerkiksi tert-butyylikarbokationi on vakaampi kuin isopropyylikarbokationi. Primaariset karbokationit ovat erittäin epästabiileja, eikä niitä usein havaita reaktion välituotteina; metyylikarbokationit ovat vielä vähemmän stabiileja.
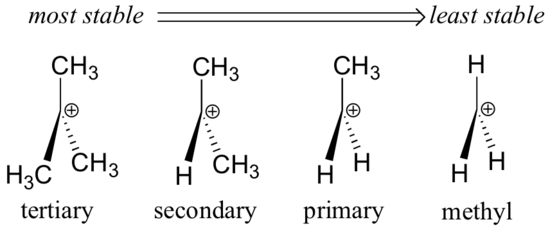
Alkyyliryhmät ovat elektroninluovuttajia ja karbokationeja stabiloivia, koska viereisten hiilien ympärillä olevat elektronit vetäytyvät kohti läheistä positiivista varausta, jolloin positiivisesti varautuneen hiilen elektroniköyhyys hieman vähenee.
Ei kuitenkaan ole oikein sanoa, että karbokationit, joilla on suurempi substituutio, ovat aina vakaampia kuin ne, joilla on vähemmän substituutiota. Aivan kuten elektronia luovuttavat ryhmät voivat vakauttaa karbokationia, elektronia vetävät ryhmät toimivat karbokationien destabiloimiseksi. Karbonyyliryhmät vetävät elektroneja pois induktiivisen vaikutuksen vuoksi, mikä johtuu C=O-kaksoissidoksen napaisuudesta. On mahdollista osoittaa laboratoriossa (ks. kohta 16.1D), että alla oleva karbokationi A on vakaampi kuin karbokationi B, vaikka A on primaarinen karbokationi ja B on sekundaarinen.
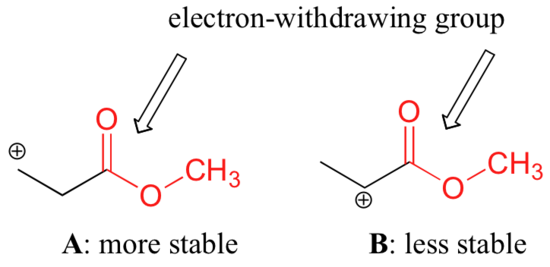
Stabiilisuusero voidaan selittää tarkastelemalla esterikarbonyylin elektronia vetävää induktiivista vaikutusta. Muistutetaan, että induktiiviset vaikutukset – riippumatta siitä, ovatko ne elektronia vetäviä vai luovuttavia – välittyvät kovalenttisten sidosten kautta ja että vaikutuksen voimakkuus vähenee nopeasti, kun välillisten sidosten määrä kasvaa. Toisin sanoen vaikutus pienenee etäisyyden kasvaessa. Lajissa B positiivinen varaus on lähempänä karbonyyliryhmää, joten destabiloiva elektronia vetävä vaikutus on voimakkaampi kuin lajissa A.
Seuraavassa luvussa näemme, miten elektronia vetävien fluorisubstituenttien karbokationia destabiloivaa vaikutusta voidaan käyttää kokeissa, joiden tarkoituksena on selvittää, onko biokemiallinen nukleofiilinen substituutioreaktio SN1- vai SN2-koe.
Karbokationin stabilointi voi tapahtua myös resonanssivaikutusten kautta, ja kuten happo-emäs -luvussa jo käsiteltiin, resonanssivaikutukset ovat pääsääntöisesti voimakkaampia kuin induktiiviset vaikutukset. Tarkastellaan yksinkertaista tapausta bentsyylikarbokationista:
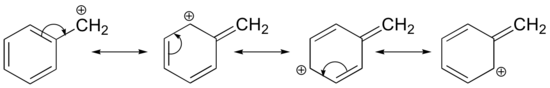
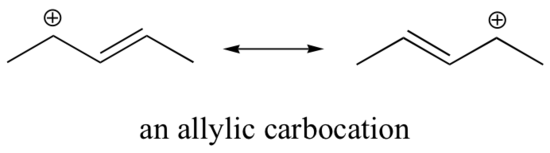
Tämä karbokationi on verrattain stabiili. Tässä tapauksessa elektroninluovutus on resonanssivaikutus. Tälle karbokationille voidaan piirtää kolme muuta resonanssirakennetta, joissa positiivinen varaus sijaitsee yhdellä kolmesta aromaattisesta hiilestä. Positiivinen varaus ei ole eristetty bentsyylihiileen, vaan se on delokalisoitunut aromaattisen rakenteen ympärille: tämä varauksen delokalisaatio johtaa merkittävään stabiloitumiseen. Tämän seurauksena bentsyyli- ja allyylikarbokationit (joissa positiivisesti varautunut hiili on konjugoitunut yhteen tai useampaan ei-aromaattiseen kaksoissidokseen) ovat huomattavasti vakaampia kuin jopa tertiääriset alkyylikarbokationit.
Koska heteroatomit, kuten happi ja typpi, ovat hiiltä elektroninegatiivisempia, voisit ehkä olettaa, että ne olisivat määritelmällisesti elektroneja vetäviä ryhmiä, jotka horjuttavat karbokationeja. Itse asiassa asia on usein päinvastoin: jos happi- tai typpiatomi on oikeassa asennossa, kokonaisvaikutus on karbokationin vakauttaminen. Tämä johtuu siitä, että vaikka nämä heteroatomit ovat induktiolla elektroneja vetäviä ryhmiä, ne ovat resonanssilla elektroneja luovuttavia ryhmiä, ja tämä resonanssivaikutus on voimakkaampi. (Törmäsimme aiemmin tähän samaan ajatukseen tarkastellessamme fenolien ja aromaattisten amiinien suhteellista happamuutta ja emäksisyyttä kohdassa 7.4). Tarkastellaan kahta alla olevaa karbokationilajiparia:
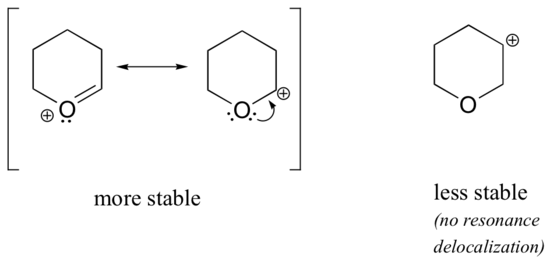
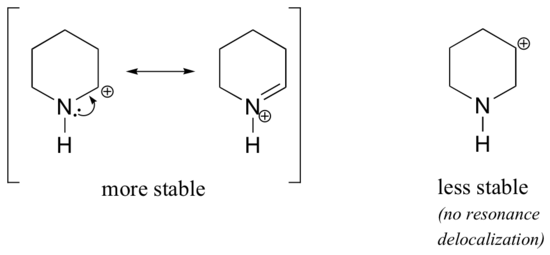
Vakaammissa karbokationeissa heteroatomi toimii resonanssin avulla elektroninluovuttajaryhmänä: käytännössä heteroatomin yksinäinen pari on käytettävissä delokalisoimaan positiivista varausta. Vähemmän stabiileissa karbokationeissa positiivisesti varautunut hiili on useamman kuin yhden sidoksen päässä heteroatomista, joten resonanssivaikutukset eivät ole mahdollisia. Itse asiassa näissä karbokationilajeissa heteroatomit itse asiassa horjuttavat positiivista varausta, koska ne induktiolla vetävät elektroneja pois.
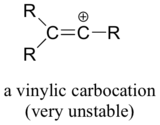
Loppujen lopuksi vinyylikarbokationit, joissa positiivinen varaus sijaitsee kaksoissidoksisessa hiilestä, ovat hyvin epästabiileja ja siten epätodennäköisiä muodostumaan välituotteiksi missään reaktiossa.
Esimerkki 7.9.1
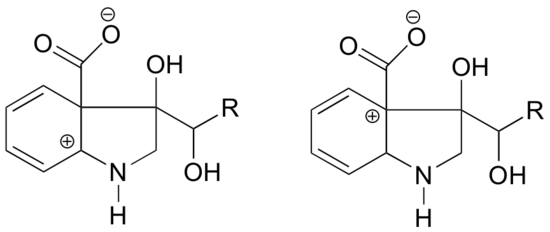
Kummassa alla olevissa rakenteissa karbokationin odotetaan olevan vakaampi? Selitä.
Vastaus
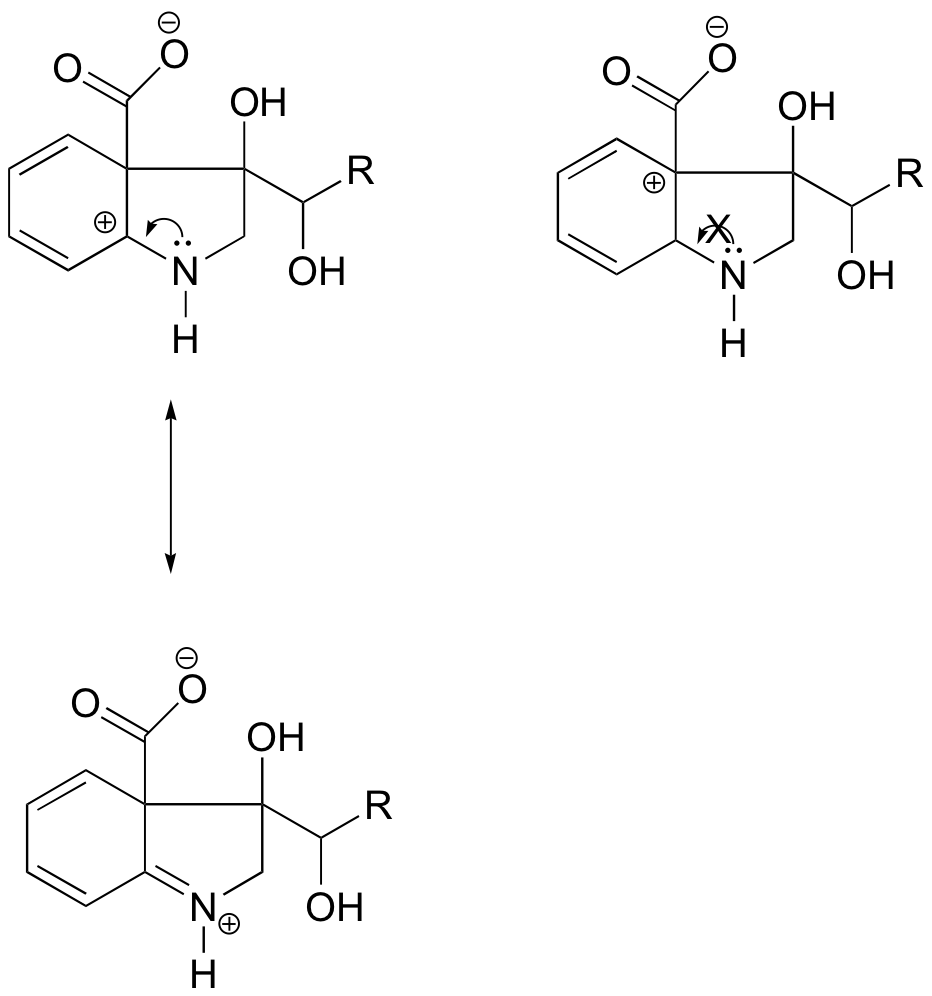
Vasemmalla olevassa karbokokaatiossa positiivinen varaus sijaitsee typpeen nähden sellaisessa asennossa, että typen yksinäinen elektronipari voidaan luovuttaa täyttämään tyhjä orbitaali. Tämä ei ole mahdollista oikeanpuoleisessa karbokationilajissa.
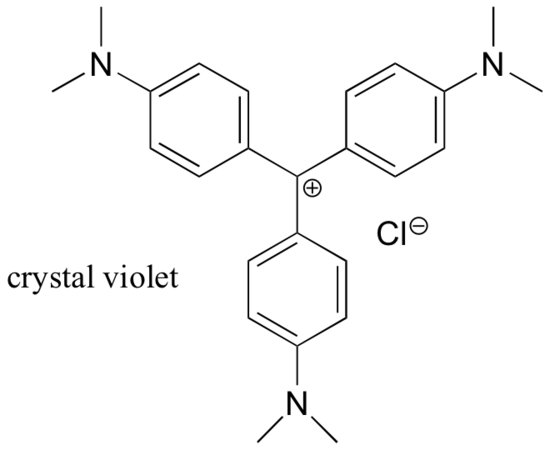
Karbokationit ovat suurimmaksi osaksi hyvin korkeaenergisiä, ohimeneviä välilajeja orgaanisissa reaktioissa. On kuitenkin joitakin epätavallisia esimerkkejä hyvin stabiileista karbokationeista, jotka ovat orgaanisten suolojen muodossa. Kristallivioletti on yleinen nimi karbokationin kloridisuolalle, jonka rakenne on esitetty alla. Huomaa rakenteelliset mahdollisuudet positiivisen varauksen laajaan resonanssidelokalisaatioon ja kolmen elektronia luovuttavan amiiniryhmän läsnäoloon.
Esimerkki 7.9.2
Piirrä resonanssirakenne kristalliviolettikationista, jossa positiivinen varaus on delokalisoitunut yhdelle typpiatomeista.
Vastaus 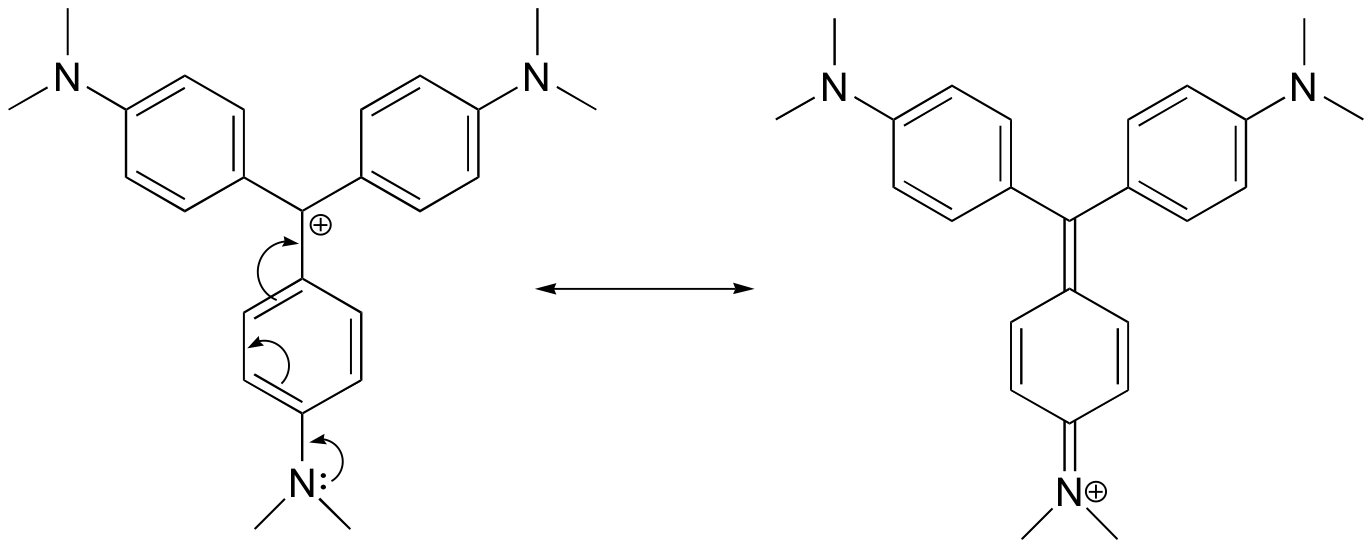
Harkittaessa mahdollisuutta, että nukleofiilinen substituutioreaktio etenee SN1-reitin kautta, on ratkaisevaa arvioida hypoteettisen karbokationivälituotteen stabiilisuus. Jos tämä välitila ei ole riittävän stabiili, SN1-mekanismia on pidettävä epätodennäköisenä, ja reaktio etenee todennäköisesti SN2-mekanismin kautta. Seuraavassa luvussa näemme useita esimerkkejä biologisesti tärkeistä SN1-reaktioista, joissa positiivisesti varautunutta välituotetta stabiloivat sen omalle molekyylirakenteelle ominaiset induktiiviset ja resonanssi-ilmiöt.
Esimerkki 7.9.3
Määritä, kumpi karbokationi kussakin allaolevassa parissa on stabiilimpi, tai jos niiden odotetaan olevan suunnilleen yhtä stabiileja. Selitä perustelut.
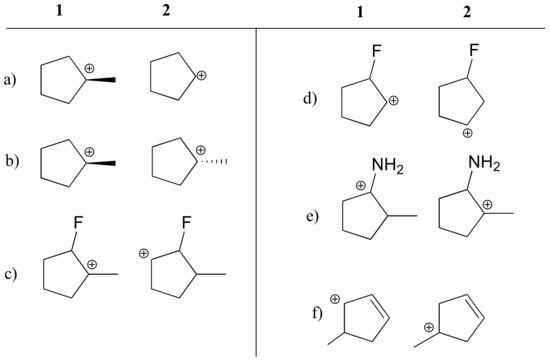
Vastaus
a) 1 (tertiäärinen vs. sekundäärinen karbokationi)
b) yhtä stabiili
c) 1 (tertiäärinen vs. sekundäärinen karbokationi)
b) yhtä stabiili
c) 1 (tertiäärinen vs. sekundäärinen karbokationi). sekundaarikarbokationi)
d) 2 (positiivinen varaus on kauempana elektronia vetävästä fluorista)
e) 1 (typen yksinäinen pari voi luovuttaa elektroneja resonanssin avulla)
f) 1 (allyylikarbokationi – positiivinen varaus voi delokalisoitua toiseen hiileen)