Azidi-ioni: Structure, Properties, and Substitution Reactions
Azidi-ioni (N3- ) on yksi niistä kemiallisista kokonaisuuksista, jotka vain yksinkertaisesti näyttävät oudoilta.

- Kolme nitrogeeniä peräkkäin? check
- Kaksi negatiivista varausta ja yksi positiivinen varaus, jolloin nettovarauksen arvo on -1 ? check
- Vakaa? check (kunhan siihen suhtaudutaan varovasti).
Kuten käy ilmi, atsidi-ioni voi olla erittäin hyödyllinen C-N-sidosten muodostamisessa nukleofiilisissä substituutioreaktioissa.
Sisällysluettelo
- Atsidi-ioni on loistava nukleofiili
- Organiset asidit ”naamioituneina” amineina
- Räjähdyskäytössä
- Nukleofiilinen asyylisubstituutio asidisuoloilla: Acyl Azides
- Asyyliatsidien uudelleenjärjestely: The Curtius Rearrangement
- More Examples of Azide Nucleophiles: Epoksidin avautuminen ja konjugaattiadditio
- Huomautuksia
- (Edistyneempiä) Viitteet ja lisälukemisto
- 1. Azidi-ioni on loistava nukleofiili SN2-reaktioissa
- 2. Orgaaniset atsidit eivät ole niin hyödyllisiä. Orgaaniset atsidit ”naamioituina amiineina”
- Räjähdys laukaisualustalla
- 4. Nukleofiilinen asyylisubstituutio asidisuoloilla tekee asyyliasideja
- 5. Hapon kloridin ja N3-ionin välillä syntyy asyyliasidi. Rearrangement of Acyl Azides: Curtius-uudelleenjärjestäytyminen
- Lisäesimerkkejä asidien nukleofiileistä: Kaksi muuta sovellusta atsidi-ionista nukleofiilinä ovat epoksidien avaaminen (mikä on pohjimmiltaan SN2-prosessi – huomaa konfiguraation inversio) ja myös konjugaattiadditio alfa,beeta-tyydyttymättömillä ketoneilla:
- Huomautuksia
- (Edistyneempi) Viitteet ja lisälukemisto
1. Azidi-ioni on loistava nukleofiili SN2-reaktioissa
Azidi-ioni on hydratsoiinihapon konjugaattiemäksinen emäksinen aine, HN3. Vaikka N3 on vain heikosti emäksinen (HN3:n pKa on vain 4,6), se on äärimmäisen hyvä nukleofiili – erään mittarin mukaan nukleofiilisempi kuin yksikään amiini (ks. viesti: Amiinien nukleofiilisyys). Ei ole vaikea järkeistää, miksi näin voi olla, kun pysähtyy miettimään asiaa. Kun neljä nukleofiilistä yksinäistä paria on rajoitettu hyvin pieneen tilavuuteen, reaktioon johtavan törmäyksen todennäköisyys elektrofiilin kanssa on paljon suurempi kuin esimerkiksi amiinilla, jossa on tilaa vieviä alkyyliryhmiä.
Voi ajatella N3-:a laihana, ilkeänä, typen kärjellä varustettuna ohjuksena, joka toimittaa hyötykuormansa hiileen nopeasti, tehokkaasti ja ilman merkittäviä sivureaktioita.
SN2-reaktioissa primääriset ja sekundääriset alkyylihalogenidit ja sulfonaatit syrjäytyvät helposti N3-:n avulla, jolloin syntyy alkyyliasideja:
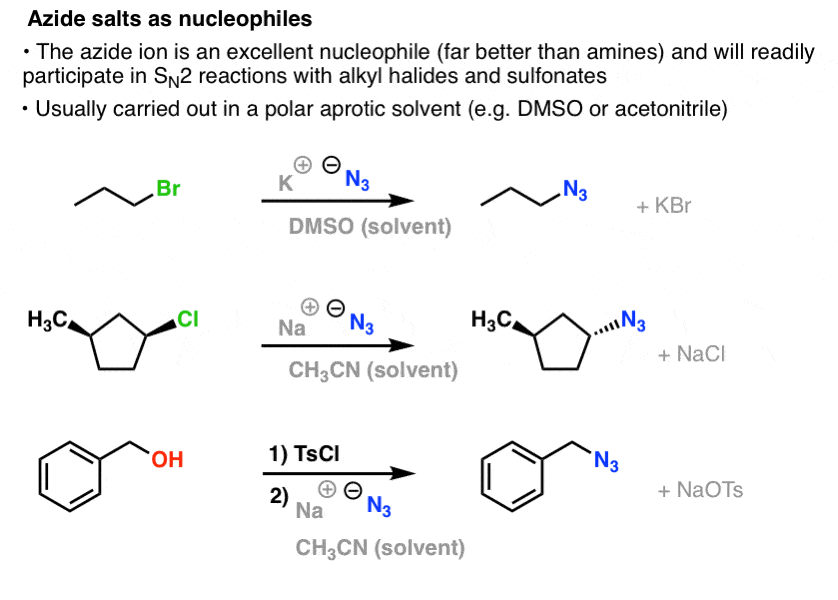
Tavanomaista on käyttää atsidisuolaa, kuten NaN3:a tai KN3:a, yhdessä sopivan alkyylihalogenidin kanssa polaarisessa aprotisessa liuottimessa, kuten asetonitriilissä (CH3CN) tai dimetyylisulfoksidissa (DMSO).
Orgaaniset atsidituotteet ovat kohtuullisen stabiileja, vaikka ne näyttävätkin hieman oudoilta. Jotkut niistä ovat jopa löytäneet käyttöä lääkkeinä (esim. AZT, alla oikealla) tai hyödyllisinä koettimina kemiallista biologiaa tutkittaessa. .
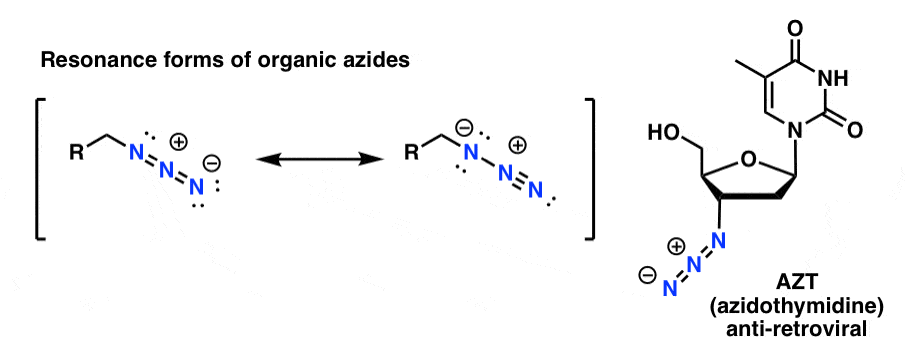
Tarkoituksissamme orgaanisten atsidien hyödyllisin ominaisuus on se, että ne toimivat ”naamioituneina” amiineina.
2. Orgaaniset atsidit eivät ole niin hyödyllisiä. Orgaaniset atsidit ”naamioituina amiineina”
Huomaa yllä oleva resonanssimuoto, jossa on typpi-typpi-kolmisidos. Jos orgaaniset atsidit käsitellään pelkistävällä aineella, kuten LiAlH4:llä tai jopa katalyyttisellä hydratoinnilla (Pd/C , H2), ne voidaan pelkistää primäärisiksi amiineiksi vapauttaen prosessissa N2:ta.
Tämä on erittäin käyttökelpoinen reitti primääristen amiinien valmistukseen alkyylihalogenideista!
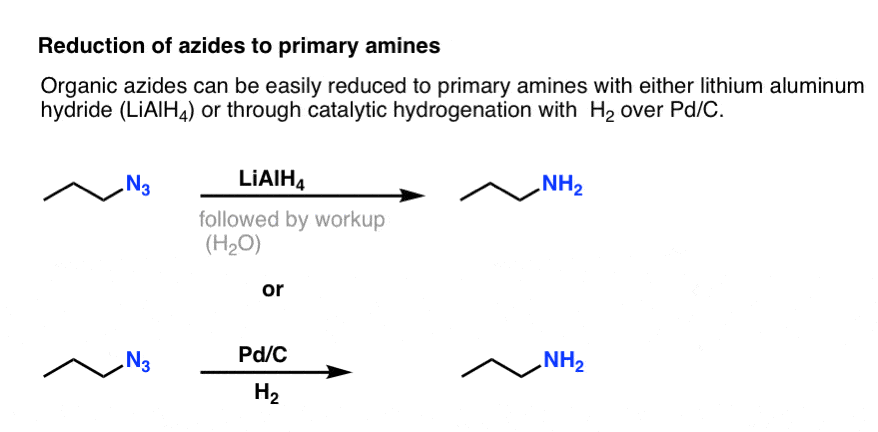
Olemme aiemmin tutkineet Gabrielin synteesiä reittinä primaarisiin amiineihin , mutta tämä reitti on ylivoimainen, koska atsidi voidaan pelkistää amiiniksi hellävaraisissa olosuhteissa (esim. hydratoimalla). Mitään korkeissa lämpötiloissa tapahtuvaa ftalimidin pilkkomista hydratsiinin kanssa ei tarvitse murehtia.
Havaitsimme myös, että primaaristen amiinien valmistaminen käsittelemällä alkyylihalogenideja suoraan NH3:lla ei useinkaan johda haluttuun tuotteeseen, koska amiineilla on Keksihirviön kaltainen taipumus reagoida useaan kertaan alkyylihalogenidien kanssa: koska amiinituotteilla on taipumus olla nukleofiilisempiä kuin reagoivilla aineilla, amiineja on hankala saada pysähtymään mässäilemään vain yhtä alkyylihalogenidia.
Räjähdys laukaisualustalla
Jos N3 on ”typpikärkinen ohjus”, kuten edellä kommentoimme, kannattaa palauttaa mieleen, mitä tapahtuu, kun ohjusta ei käsitellä huolella: se on pohjimmiltaan pommi.
NaN3 ja KN3 ovat valkoisia jauheita, joita voidaan säilyttää loputtomiin huoneenlämmössä ja kauhoa penkissä ilman ongelmia.
Mutta kun niitä kuumennetaan tai altistetaan iskuille – kaikki vedot ovat poissa. Sama koskee näiden atsidisuolojen altistamista hapolle, joka muodostaa räjähdysvaarallista HN3:a.
Ja NaN3 ja KN3 ovat kivoja atsideja! Jos niitä sekoitetaan lyijyn, elohopean, kadmiumin, sinkin tai hopean metallisuolojen kanssa, voi syntyä vielä räjähdysalttiimpia atsidiyhdisteitä. Nämä metalliatsidit ovat kontaktiräjähteitä, joista jotkut ovat niin herkkiä, että ne räjähtävät, jos joku piereskelee parinkymmenen metrin päässä käytävällä. Jotkut hullut kemistit jopa valmistavat näitä tarkoituksella, mutta emme matkusta lähellekään tämän aiheen räjähdyssädettä tässä blogissa milloin tahansa, koskaan.
NaN3:a ja KN3:a tulisi käyttää kohtuullisen laimeina pitoisuuksina, räjähdyssuojan takana preparatiivisessa mittakaavassa, eikä niitä muutenkaan tulisi koskaan käyttää CH2Cl2-liuottimen kanssa, jolloin tuloksena voi olla erittäin räjähdysherkkää diatsidometaania.
Nyt on aikoja, jolloin yhtäkkinen typpikaasun räjähdyspanoksen aiheuttama räjähdyspanoksen aiheuttama räjähdyspanoksen aiheuttama räjähdyspanoksen aiheuttama räjähdyspanoksen aiheuttama räjähdyspanoksen aiheuttama räjähdyspanoksen aiheuttama räjähdyspanoksen aiheuttama räjähdys panoksena on joskus käyttökelpoinen – ja jopa mahdollisesti jopa ihmishenkiä pelastus. Olet ehkä jo viettänyt osan päivästäsi natriumatsidin läheisyydessä huomaamattasi. Tämä johtuu siitä, että NaN3 on yksi monista ponnekaasuista, joita käytetään turvatyynyissä; kun kiihtyvyysanturi laukaisee NaN3:n räjähtämisen, se vapauttaa N2-kaasua yli 200 mailin tuntinopeudella ja puhaltaa pussin täyteen 1/25 sekunnissa.
Yay for azide salts!
via GIPHY
(But don’t be this guy):
via GIPHY
Bottom line: SN2-reaktiot alkyylihalogenidien tai sulfonaattien ja atsidien välillä ovat luultavasti paras yksittäinen tapa syntetisoida primaarisia amiineja alkyylihalogenideista. Se päihittää varmasti Gabrielin synteesin.
4. Nukleofiilinen asyylisubstituutio asidisuoloilla tekee asyyliasideja
SN2-reaktio ei ole ainoa tutkimamme substituutioreaktiotyyppi. On myös nukleofiilinen asyylisubstituutio. Hyvään poistuvaan ryhmään (kuten happokloridiin tai -hydridiin) kiinnittynyt karbonyyli substituoituu, kun siihen lisätään sopiva nukleofiili.
Mekanismin ensimmäisessä vaiheessa nukleofiili (Nu) hyökkää karbonyylihiilen kimppuun muodostaen C-Nu:n ja rikkoen C-O:n (pi). Tällöin syntyy tetraedrinen välituote. Toisessa vaiheessa C-O pi-sidos muodostuu uudelleen ja hiili(poistuva ryhmä)sidos katkeaa, jolloin syntyy nukleofiilinen asyylisubstituutiotuote.
Tässä on esimerkki nukleofiilisestä asyylisubstituutioreaktiosta happokloridin ja N3-ionin välillä, jolloin syntyy asyyliasidi:
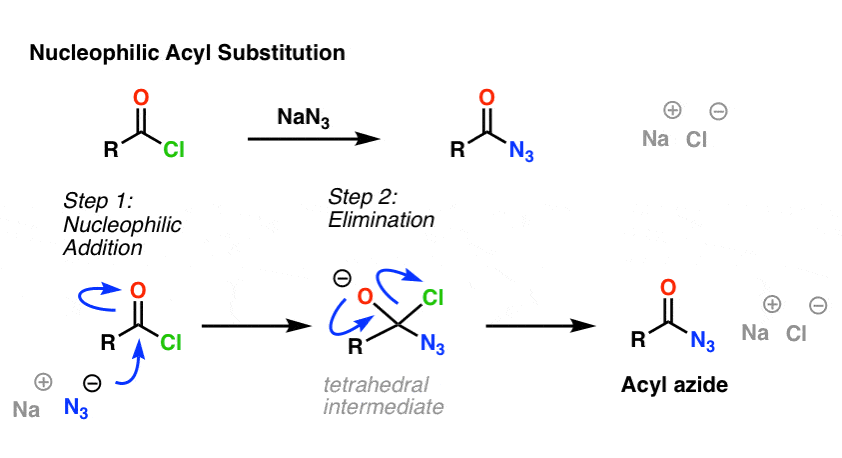
5. Hapon kloridin ja N3-ionin välillä syntyy asyyliasidi. Rearrangement of Acyl Azides: Curtius-uudelleenjärjestäytyminen
Acyyliatsidien yleisin käyttötapa on se, että kuumennettaessa ne järjestäytyvät uudelleen muodostaen isosyanaatteja reaktiossa, joka tunnetaan Curtius-uudelleenjärjestäytymisenä.
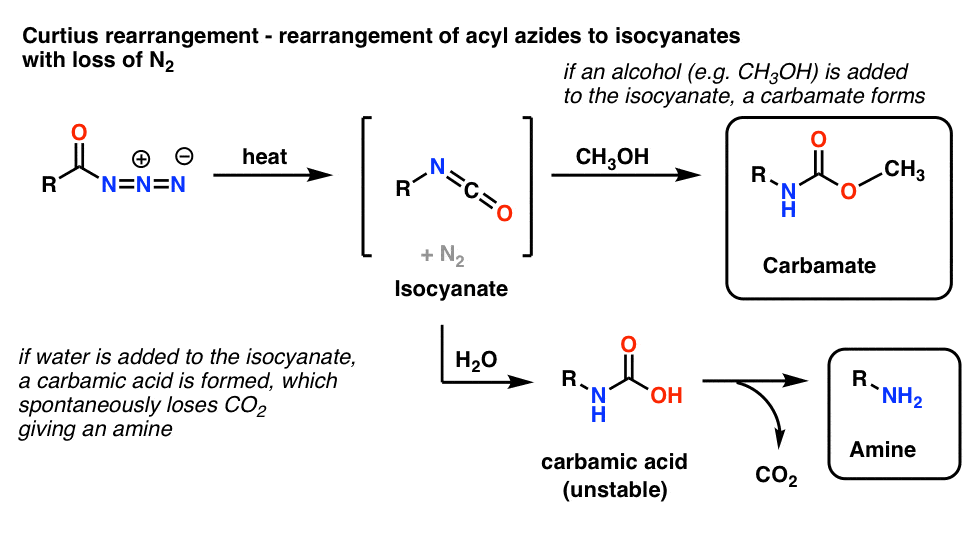
- Jos Curtius-reaktio suoritetaan alkoholin, kuten metanolin, läsnäollessa, muodostuu karbamaatti.
- Jos sen sijaan lisätään vettä, muodostuu lyhytaikaisesti epästabiili karbamiinihappo, joka sitten menettää hiilidioksidia antaen primaarisen amiinin.
Miksi tämä voisi olla hyödyllistä? Tässä on yksi tapa.
On olemassa paljon menetelmiä aromaattisten karboksyylihappojen valmistamiseksi, mutta ei niin paljon hyviä tapoja muodostaa C-N-sidoksia aromaattisiin renkaisiin. Sanotaan, että sinulla on bentsoehappo (kuten p-metyylibentsoehappo), mutta haluat muodostaa (suojatun) aromaattisen amiinin. Curtius-protokolla edustaa mukavaa tapaa muodostaa uusi C-N-sidos renkaaseen ilman, että tarvitsee turvautua nitraatioon + pelkistykseen.
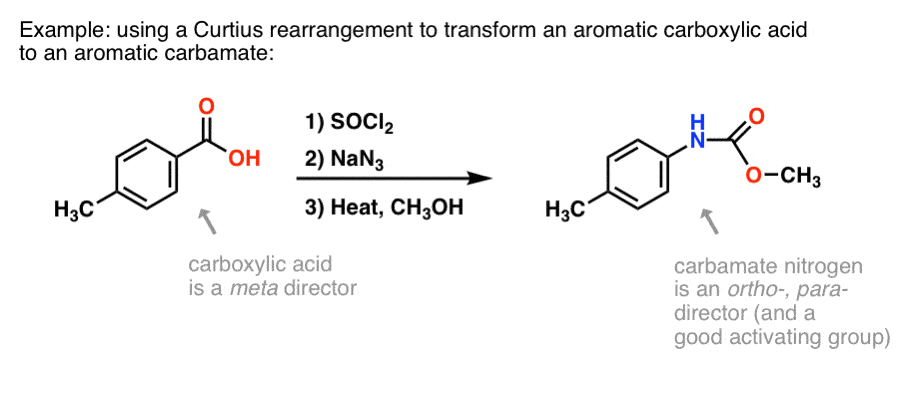
(Tällä tavoin se on jokseenkin analoginen typpiekvivalentti Baeyer-Villiger-hapetukselle. )
Lisäesimerkkejä asidien nukleofiileistä: Kaksi muuta sovellusta atsidi-ionista nukleofiilinä ovat epoksidien avaaminen (mikä on pohjimmiltaan SN2-prosessi – huomaa konfiguraation inversio) ja myös konjugaattiadditio alfa,beeta-tyydyttymättömillä ketoneilla:
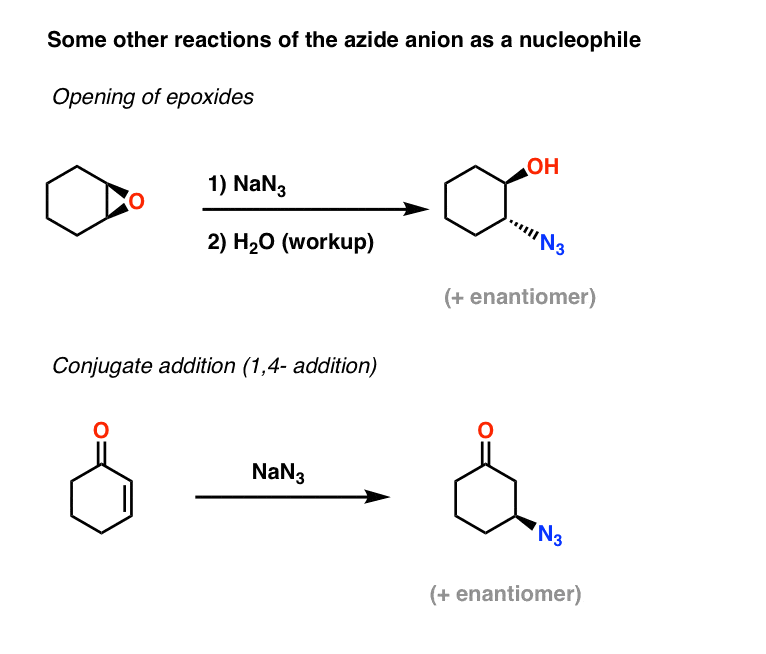

Tuloksena syntyvät alkyyliatsidit voidaan sitten pelkistää primaarisiksi amiineiksi edellä käsiteltyjä menetelmiä käyttäen.
Huomautuksia
Alaviite: Azidi-alkyni-sykloadditiot, ns. ”Click”-kemia
Eräs mielenkiintoinen ja hyödyllinen orgaanisten atsidien sovellus, joka ei ole vielä päässyt orgaanisen kemian johdantokirjoihin (mutta todennäköisesti pääsee lähitulevaisuudessa), on prosessi, jota kutsutaan teknisesti ”kuparikatalysoiduksi atsidi-alkyyni-sykloadditioksi”, mutta yleisemmin vain ”alkyni-atsidi-click-reaktioksi”.
Kun terminaalista alkydia käsitellään kuparikatalysaattorilla orgaanisen atsidin läsnä ollessa, syntyy nopeasti sykloaddition, joka johtaa 1,2,3-triatsolin muodostumiseen.
Emmekä mene syvälle yksityiskohtiin, mutta tähän renkaanmuodostusreaktioon osallistuu 6 pii-elektronia ja se on Diels-Alderin reaktion serkku (nirsoilijat huomauttavat oikeutetusti, että kuparikatalysoitu versio ei ole teknisesti koordinoitu prosessi, mutta ei-katalysoitu versio on)
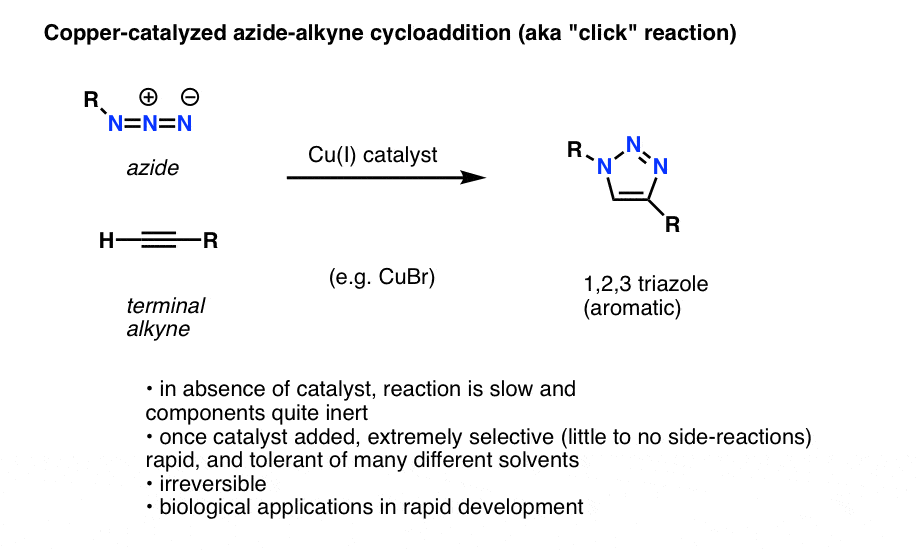
Reaktio on huomionarvoinen muutamasta syystä:
- reaktiiviset partnerit (terminaalinen alkiini ja orgaaninen atsidi) ovat suhteellisen inerttejä ilman katalyyttiä useimmissa olosuhteissa.
- Kun kupari lisätään, reaktio tapahtuu erittäin nopeasti miedoissa olosuhteissa ja useissa liuottimissa (myös vedessä).
- Se on erittäin selektiivinen näissä olosuhteissa,alkyni- ja atsidikumppanit reagoivat vain toistensa kanssa, palautumattomasti.
- Tuote, triatsolirengas, on aromaattinen ja stabiili
Sitä on kutsuttu ”klikki”-reaktioksi yhden sen alullepanijan, Barry Sharplessin, mukaan, koska se on yksi lähimpänä kemistien reaktiota, joka on kuin kahden toisiaan täydentävän legopalikan sujuva ”napsahdus yhteen”.
Tästä reaktiosta on viime aikoina tehnyt erityisen hyödyllisen se, että atsidi- ja alkyynipartnerit voidaan asentaa biologisesti kiinnostaviin molekyyleihin ja ”klikata” yhteen haluttaessa.
Esimerkiksi:
- Asetyleenin asettamista sokerin 5′-asemaan ja atsidin asettamista 3′-asemaan on käytetty ”napsautetun” DNA:n valmistamiseen, jossa triatsoli korvaa organofosfaatin.
- Hämmästyttävää kyllä, eräs ryhmä on tehnyt ”klikattua” DNA:ta, laittanut sen ihmissoluihin ja onnistunut saamaan sen transkriboitua lähetti-rna:n avulla.
- Atsidipitoinen AZT (yllä) toimii tukkimalla transkriptiokoneiston. Jotkut fiksut ihmiset löysivät keinon soveltaa atsidi-alkyyni-klikkausreaktiota nopeaan genomin sekvensointiin, tekniikka tunnetaan nimellä ClickSeq.
Takata käytti natriumatsidia 1990-luvun alussa ja siirtyi sitten tetratsoliin ja sitten ammoniumnitraattiin.
Kirjasta ”Sixty Million Car Bombs: Inside Takata’s Air Bag Crisis”.
Ammoniumnitraatti oli Uphamin mukaan noin kymmenesosa tetratsolin hinnasta, ja hän tarkasteli myös alan patentteja. Ammoniumnitraatissa oli kuitenkin kriittinen virhe, joka hänen mukaansa sai muut turvatyynyjen valmistajat luopumaan siitä: Ammoniumnitraatissa on viisi tiheydeltään vaihtelevaa faasia, joiden vuoksi sitä on vaikea pitää vakaana ajan mittaan. Ammoniumnitraatista valmistettu ponnekaasu turpoaisi ja kutistuisi lämpötilan muuttuessa, ja lopulta tabletti hajoaisi jauheeksi. Vesi ja kosteus nopeuttaisivat prosessia. Jauhe palaa nopeammin kuin tabletti, joten turvatyyny, jonka ponnekaasu on hajonnut, avautuisi todennäköisesti liian aggressiivisesti. Hallittu räjähdys olisi vain räjähdys. ”Kaikki kulkivat tiettyä tietä, ja vain Takata kulki toista tietä”, sanoo Jochen Siebert, joka on seurannut turvatyynyalaa 1990-luvulta lähtien ja on nykyään JSC Automotive Consultingin toimitusjohtaja. ”Jos lukee konferenssiasiakirjoja tuolta ajalta, näkee, että ihmiset sanoivat: ’Ei, teidän ei pitäisi. Se on vaarallista. ”
Viallisten turvatyynyjen sirpaleet ovat tappaneet 13 ihmistä maailmanlaajuisesti ja haavoittaneet yli 100:aa.
Kesäkuun 25. päivänä 2017 Takata jätti konkurssihakemuksen yli 11 miljardin dollarin vastuiden vuoksi.
Primäärinen amiinisynteesi ”Do’s and Don’ts” :
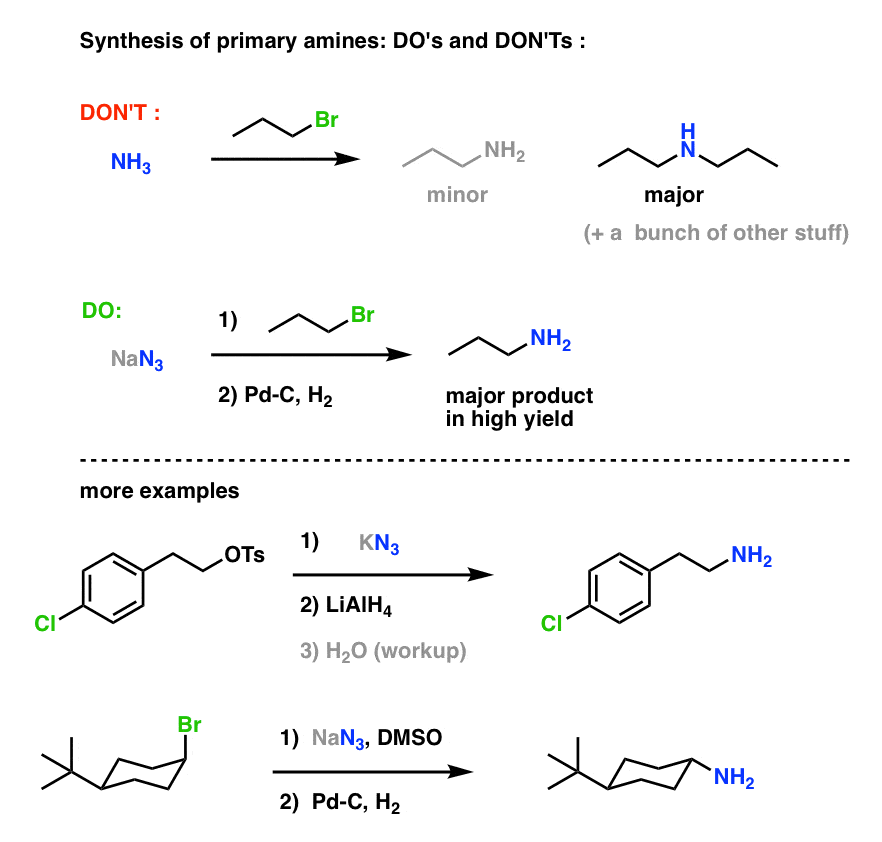
(Edistyneempi) Viitteet ja lisälukemisto
Atsidit ovat käyttökelpoisia orgaanisessa synteesissä, ja alla olevissa viitteissä esitellään atsidien kemiaa.
- Azidi-ionin nukleofiilinen reaktiivisuus eri liuottimissa
Thanh Binh Phan, Herbert Mayr
Phys. Org. Chem. 2006, 19 (11), 706-713
DOI: 10.1002/poc.1063
Prof. Herbert Mayr (LMU, München, Saksa) on uransa aikana edistänyt fysikaalisen orgaanisen kemian perustutkimusta kvantifioimalla elektrofiilisyyttä ja nukleofiilisyyttä sekä kehittämällä asteikkoja erilaisten nukleofiilien ja elektrofiilien reaktiivisuuden vertailuun. - SN2-siirtymät 2-norbornyylibrosylaateissa
Klaus Banert ja Wolfgang Kirmse
Journal of the American Chemical Society 1982, 104 (13), 3766-3767
DOI: 1021/ja00377a057 - An Improved Synthesis of Azidothymidine
I. Balagopala, A. P. Ollapally, & H. J. Lee
Nukleosidit, nukleotidit & Nucleic Acids 1996, 4, 899-906
DOI: 10.1080/07328319608002136
Azideja voidaan käyttää nukleofiileinä SN2-reaktioissa. Ref. #3 osoittaa atsidi-ionin käyttöä AZT:n (atsidotymidiini) synteesissä. Viitteessä 3 esitetty 1:n muuntaminen 5:ksi 3:n kautta. #3 käyttää Mitsunobu-reaktiota, joka mahdollistaa -OH-ryhmän syrjäyttämisen nukleofiilillä konfiguraation kääntäen. - Organic Azides to Primary Amines with Lithium Aluminum Hydride
H. Boyer
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
DOI: 10.1021/ja01156a507
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
DOI: 10.1021/ja01156a507
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
P. H. Boyer
P. Boyer
Journal of the American Chemical Society 1951, 73 (12), 5865-5866
P. G. Fox
J. Solid State Chem. 1970, 2 (4), 491-502
DOI: 10.1016/0022-4596(70)90043-5
Tutkimus NaN3:n, TlN3:n ja Pb(N3)2:n iskuherkkyydestä. - The Curtius Reaction
Smith, P. A. S. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
Vanha, mutta kattava katsaus Curtiusin reaktioon, joka sisältää tämän uudelleenjärjestelyn löytöhistorian, substraatin laajuuden, rajoitukset, vertailun muihin samankaltaisiin reaktioihin ja kokeelliset menettelyt. - Synteettiset menetelmät ja reaktiot. 121. Sinkkijodidin katalysoima aroyyliatsidien valmistus aroyyliklorideista ja trimetyylisilyyliatsidista
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi ja George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051b
Käytännöllinen menetelmä aromaattisten aryyliatsidien valmistamiseksi Nobel-palkinnon saajalta prof. George A. Olahilta. Näitä voidaan sitten käyttää Curtius-uudelleenjärjestelyihin.
Epoksidin avautuminen ja konjugaattiadditio:
- SYKLOHEKSENIMIINI (7-AZA-BIKYKLOHEPTANI)
Iain D. G. Watson, Nicholas Afagh ja Andrei K. Yudin
Org. Synth. 2010, 87, 161-169
DOI: 10.15227/orgsyn.087.0161
Tämä on erityisen käyttökelpoinen menetelmä, sillä se on Staudingerin reaktio, jolla epoksidit muunnetaan NH-atsiridiineiksi (epoksidien typpianalogit). Synteesi voi olla hankala, mutta tässä on annettu paljon yksityiskohtia, jotta tämä voidaan toistaa, kuten sopiva menettely Organic Syntheses -lehdessä. - Amine-Catalyzed Addition of Azide Ion to α,β-Unsaturated Carbonyl Compounds
David J. Guerin, Thomas E. Horstmann ja Scott J. Miller
Organic Letters 1999, 1 (7), 1107-1109
DOI: 10.1021/ol9909076
Tämä artikkeli on mielenkiintoinen, koska se edustaa varhaista orgaanisen katalyysin muotoa ja etenee todennäköisesti imiini- tai iminiumionin välituotteen kautta. Valitettavasti termiä ei käytetä missään paperissa – nämä kirjoittajat olisivat voineet päihittää professori MacMillanin! - Click Chemistry: Diverse Chemical Function from a Few Good Reactions
Hartmuth C. Kolb Dr. M. G. Finn Prof. K. Barry Sharpless Prof.
Angew Chem. Int. Ed. 2001, 40 (11), 2004-2021
DOI: 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5
Azidien ja alkyynien Cu-katalysoitua sykliliitosta alkyynien kanssa on kutsuttu ”klikkausreaktioksi” Nobel-palkitun prof. K. Barry Sharpless (The Scripps Research Institute, La Jolla, CA) sen yksinkertaisuuden, korkeiden saantojen, nopean kinetiikan ja yhteensopivuuden monenlaisten olosuhteiden ja substraattien kanssa vuoksi. Cu-vapaat reaktiot ovat myös mahdollisia, jos käytetään rasitettuja alkyinejä (esim. syklooktyinejä).