Generaattinen nimi: fendimetratsiinitartraatti
annostusmuoto: tabletti
Lääketieteellisesti tarkistanut Drugs.com. Viimeksi päivitetty 22. kesäkuuta 2020.
- Yleiskatsaus
- Haittavaikutukset
- Adostus
- Erikoislääke
- Vuorovaikutukset
- Lisätiedot
Ainoastaan reseptilääke
Merkinimitys ”Bontril Slow Release” (Bontril hitaasti vapauttava) valmiste on poistunut käytöstä U.S.A:ssa.S. Jos FDA on hyväksynyt tämän valmisteen geneeriset versiot, saatavilla voi olla geneerisiä vastineita.
- Bontrilin kuvaus
- Bontril – Kliininen farmakologia
- Bontrilin käyttöaiheet ja käyttö
- Vasta-aiheet
- Varoitukset
- Varoitukset
- Lääkkeiden yhteisvaikutukset
- Karsinogeneesi, mutageenisuus, hedelmällisyyden heikentyminen
- Raskausalttius
- Käyttö raskauden aikana
- Imettävät äidit
- Pediatrinen käyttö
- Haittavaikutukset
- Lääkkeiden väärinkäyttö ja riippuvuus
- Valvottava aine
- Riippuvuus
- Yliannostus
- Bontrilin annostus ja antotapa
- Tavanomainen annostus aikuisille
- Miten Bontrilia toimitetaan
- ESIMERKKIPANEELI – 35 mg:n tablettipullon etiketti
- Lisätietoa Bontril Hidas Vapauttaminen (fendimetratsiini)
- Kuluttajan resurssit
- Professional resources
- Hoito-oppaat
Bontrilin kuvaus
Fendimetratsiinitartraatin kemiallinen nimi dextroisomeerinä on (2S,3S)-3,4-dimetyyli-2-fenyylimorfoliini L-(+)-tartraatti (1:1).
Rakennekaava on:
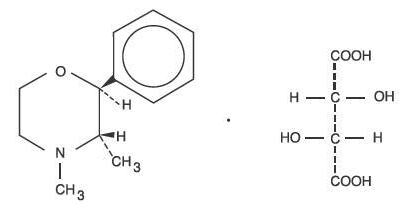
C12H17NO-C4H6O6 M.W. 341,36
Fendimetratsiinitartraatti on valkoista, hajutonta kiteistä jauhetta. Se liukenee vapaasti veteen; liukenee niukasti lämpimään alkoholiin, ei liukene kloroformiin, asetoniin, eetteriin ja bentseeniin.
Se sisältää lisäksi seuraavia inaktiivisia aineosia: Puristettava sokeri, makeissokeri, D&C Keltainen #10, FD&C Sininen #1, FD&C Keltainen #6, isopropyylialkoholi, vedetön laktoosi, magnesiumstearaatti, mikrokiteinen selluloosa, povidoni, puhdistettu vesi, natriumtärkkelysglykolaatti.
Bontril – Kliininen farmakologia
Fendimetratsiinitartraatti on sympatomimeettinen amiini, jolla on samanlainen farmakologinen aktiivisuus kuin tämän luokan liikalihavuuteen käytetyillä prototyyppilääkkeillä, amfetamiineilla. Vaikutuksiin kuuluvat keskushermoston stimulaatio ja verenpaineen kohoaminen. Takyfylaksiaa ja toleranssia on osoitettu kaikilla tämän luokan lääkkeillä, joilla näitä ilmiöitä on etsitty.
Tämän luokan lääkkeitä, joita käytetään lihavuuteen, kutsutaan yleisesti ”anorektikoiksi” tai ”anoreksigeeneiksi”. Ei ole kuitenkaan osoitettu, että näiden lääkkeiden vaikutus lihavuuden hoidossa olisi ensisijaisesti ruokahalun tukahduttamista. Muihin keskushermostoon kohdistuviin vaikutuksiin tai aineenvaihdunnallisiin vaikutuksiin voi liittyä esimerkiksi muita keskushermostovaikutuksia.
Aikuiset liikalihavat henkilöt, joita ohjataan ruokavaliohoitoon ja joita hoidetaan anorektisilla lääkkeillä, laihtuvat keskimäärin enemmän kuin lumelääkkeellä ja ruokavaliohoidossa hoidetut, mikä on todettu suhteellisen lyhytaikaisissa kliinisissä tutkimuksissa.
Lääkkeellä hoidettujen potilaiden lisääntyneen laihtumisen suuruus lumelääkkeellä hoidettuihin potilaisiin nähden on vain murto-osa punnasta viikossa. Painonpudotus on suurinta ensimmäisinä hoitoviikkoina sekä lääke- että lumelääkehoitoa saavilla henkilöillä, ja sillä on taipumus pienentyä seuraavina viikkoina. Lääkkeen eri vaikutuksista johtuvan lisääntyneen painonpudotuksen mahdollista alkuperää ei ole selvitetty. Anorektisen lääkkeen käyttöön liittyvän painonpudotuksen määrä vaihtelee tutkimuksesta toiseen, ja lisääntynyt painonpudotus näyttää liittyvän osittain muihin muuttujiin kuin määrättyyn lääkkeeseen, kuten tutkijalääkäriin, hoidettavaan väestöön ja määrättyyn ruokavalioon. Tutkimusten perusteella ei voida tehdä johtopäätöksiä lääkkeen ja muiden tekijöiden suhteellisesta merkityksestä painonpudotukseen.
Ylipainon luonnollinen kulku mitataan vuosina, kun taas mainitut tutkimukset rajoittuvat muutamien viikkojen kestoon; näin ollen lääkkeen aiheuttaman painonpudotuksen kokonaisvaikutusta pelkän ruokavalion vaikutukseen verrattuna on pidettävä kliinisesti rajallisena.
Pääasiallinen eliminaatioreitti kulkee munuaisten kautta, jonne suurin osa lääkeaineesta ja sen metaboliiteista erittyy. Osa lääkkeestä metaboloituu fenmetratsiiniksi ja myös fenmetratsiini-N-oksidiksi. Keskimääräinen eliminaation puoliintumisaika, kun sitä tutkitaan kontrolloiduissa olosuhteissa, on noin 3,7 tuntia sekä depot- että välittömästi vapautuvan muodon osalta. Lääkeaineen imeytymisen puoliintumisaika välittömästi vapauttavista 35 mg:n fendimetratsiinitableteista on huomattavasti nopeampi kuin lääkeaineen imeytymisnopeus pitkävaikutteisesta formulaatiosta.
Bontrilin käyttöaiheet ja käyttö
Bontril®PDM (fentimetratsiinitartraatti) on tarkoitettu eksogeenisen lihavuuden hoitoon lyhytaikaisena lisänä (muutama viikko) kalorien rajoittamiseen perustuvassa painonpudotushoidossa potilailla, joiden lähtötilanteen painoindeksi (BMI) on 30 kg/m2 tai korkeampi ja jotka eivät ole vastanneet pelkkään soveltuvaan painonpudotushoitoon (ruokavalio ja/tai liikunta). Alla on taulukko painoindeksistä (BMI), joka perustuu eri pituuksiin ja painoihin. BMI lasketaan jakamalla potilaan paino kilogrammoina (kg) potilaan pituuden neliöllä metreinä (m). Metriset muunnokset ovat seuraavat: kiloa ÷ 2,2 = kg; tuumaa x 0,0254 = metriä.
| BODY MASS INDEX (BMI), kg/m2 Pituus (jalkaa, tuumaa) |
||||||
|---|---|---|---|---|---|---|
| Paino (kiloa) |
5’0″ | 5’3″ | 5’6″ | 5’9″ | 6’0″ | 6’3″ |
| 140 | 27 | 25 | 23 | 21 | 19 | 18 |
| 150 | 29 | 27 | 24 | 22 | 20 | 19 |
| 160 | 31 | 28 | 26 | 24 | 22 | 20 |
| 170 | 33 | 30 | 28 | 25 | 23 | 21 |
| 180 | 35 | 32 | 29 | 27 | 25 | 23 |
| 190 | 37 | 34 | 31 | 28 | 26 | 24 |
| 200 | 39 | 36 | 32 | 30 | 27 | 25 |
| 210 | 41 | 37 | 34 | 31 | 29 | 26 |
| 220 | 43 | 39 | 36 | 33 | 30 | 28 |
| 230 | 45 | 41 | 37 | 34 | 31 | 29 |
| 240 | 47 | 43 | 39 | 36 | 33 | 30 |
| 250 | 49 | 44 | 40 | 37 | 34 | 31 |
Fendimetratsiinitartraatti on tarkoitettu käytettäväksi vain monoterapiana.
Vasta-aiheet
Tunnettu yliherkkyys tai idiosynkraattiset reaktiot sympatomimeetikoille.
Pitkälle edennyt valtimonkovettumatauti, oireinen sydän- ja verisuonisairaus, keskivaikea ja vaikea verenpainetauti, kilpirauhasen liikatoiminta ja glaukooma.
Potilaat, jotka ovat erittäin hermostuneita tai levottomia.
Potilaat, joilla on aiemmin ollut huumeiden väärinkäyttöä.
Potilaat, jotka käyttävät muita keskushermostoa stimuloivia aineita, mukaan lukien monoamiinioksidaasin estäjät.
Varoitukset
Fendimetratsiinitartraattia ei saa käyttää yhdessä muiden anorektisten aineiden kanssa, mukaan lukien reseptilääkkeet, reseptivapaat valmisteet ja kasviperäiset valmisteet.
Epidemiologisessa tapaus-verrokkitutkimuksessa anorektisten aineiden, mukaan lukien fentimetratsiinitartraatin, käyttöön liittyi suurentunut riski sairastua keuhkoverenpainetautiin, harvinaiseen mutta usein kuolemaan johtavaan sairauteen. Jos anorektisia aineita käytettiin yli kolmen kuukauden ajan, riski sairastua keuhkoverenpainetautiin kasvoi 23-kertaiseksi. Keuhkoverenpainetaudin lisääntynyttä riskiä toistuvien hoitojaksojen yhteydessä ei voida sulkea pois.
Kuormitushengenahdistuksen alkaminen tai paheneminen tai selittämättömät angina pectoriksen, pyörtymisen tai alaraajojen turvotuksen oireet viittaavat keuhkoverenpainetaudin esiintymisen mahdollisuuteen. Näissä olosuhteissa fendimetratsiinitartraatti on lopetettava välittömästi, ja potilas on arvioitava keuhkoverenpainetaudin mahdollisen esiintymisen varalta.
Joidenkin anorektisten aineiden, kuten fenfluramiinin ja deksfenfluramiinin, käyttöön liittyvää läppävaltimotautia on raportoitu. Mahdollisia vaikuttavia tekijöitä ovat pitkäaikainen käyttö, suositeltua suurempi annos ja/tai käyttö yhdessä muiden anorektisten lääkkeiden kanssa. Tällaista läppäviatapausta ei kuitenkaan ole raportoitu, kun fendimetratsiinitartraattia on käytetty yksinään.
Mahdollisten vakavien haittavaikutusten, kuten sydämen läppäviatapauksen ja keuhkoverenpainetaudin, mahdollista riskiä on arvioitava huolellisesti painonpudotuksesta mahdollisesti saatavaan hyötyyn nähden. Sydämen perustutkimusta on harkittava jo olemassa olevien läppävikaisten sydänsairauksien tai keuhkoverenpainetaudin havaitsemiseksi ennen fendimetratsiinihoidon aloittamista. Fendimetratsiinitartraattia ei suositella potilaille, joilla on tunnettu sydämen sivuääni tai läppävika. Sydämen kaikukuvaus hoidon aikana ja sen jälkeen voi olla hyödyllinen mahdollisten läppähäiriöiden havaitsemiseksi. Aiheettoman altistumisen ja riskien rajoittamiseksi fendimetratsiinitartraattihoitoa on jatkettava vain, jos potilas on laihtunut tyydyttävästi ensimmäisten 4 hoitoviikon aikana (ts. laihtuminen vähintään 4 kiloa tai lääkärin ja potilaan määrittelemällä tavalla).
Toleranssi fendimetratsiinin anorektiselle vaikutukselle kehittyy muutamassa viikossa. Kun näin tapahtuu, sen käyttö on lopetettava; suurinta suositeltua annosta ei saa ylittää.
Fendimetratsiinitartraatin käyttö 14 päivän kuluessa monoamiinioksidaasin estäjien antamisesta voi johtaa hypertensiiviseen kriisiin.
Annon äkillinen lopettaminen pitkäaikaisen suuren annoksen jälkeen johtaa äärimmäiseen väsymykseen ja masennukseen. Keskushermostoon kohdistuvan vaikutuksen vuoksi fendimetratsiinitartraatti saattaa heikentää potilaan kykyä osallistua mahdollisesti vaarallisiin toimintoihin, kuten koneiden käyttämiseen tai moottoriajoneuvon kuljettamiseen; potilasta on siksi varoitettava vastaavasti.
Fendimetratsiinitartraattia ei suositella potilaille, jotka ovat käyttäneet mitään anorektisia aineita edellisen vuoden aikana.
Varoitukset
Varovaisuutta on noudatettava määrättäessä fendimetratsiinia potilaille, joilla on jopa lievä verenpainetauti.
Insuliinin tarve diabetes mellituksessa saattaa muuttua fendimetratsiinitartraatin ja samanaikaisen ruokavaliohoidon käytön yhteydessä.
Fendimetratsiinitartraatti saattaa vähentää guanetidiinin verenpainetta alentavaa vaikutusta. Pienin mahdollinen määrä on määrättävä tai annosteltava kerralla, jotta minimoidaan yliannostuksen mahdollisuus.
Lääkkeiden yhteisvaikutukset
Fendimetratsiinitartraatin tehoa muiden anorektisten aineiden kanssa ei ole tutkittu, ja yhdistelmäkäyttö saattaa aiheuttaa vakavia sydänongelmia.
Karsinogeneesi, mutageenisuus, hedelmällisyyden heikentyminen
Fendimetratsiinitartraatilla ei ole tehty tutkimuksia karsinogeenisen potentiaalin, mutageenisen potentiaalin tai hedelmällisyyteen kohdistuvien vaikutusten arvioimiseksi.
Raskausalttius
Raskausalttiusluokka C
Fendimetratsiinitartraatilla ei ole tehty eläinten lisääntymistutkimuksia. Ei myöskään tiedetä, voiko fendimetratsiinitartraatti aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle, tai voiko se vaikuttaa lisääntymiskykyyn.
Käyttö raskauden aikana
Turvallista käyttöä raskauden aikana ei ole osoitettu. Kunnes lisätietoa on saatavilla, fendimetratsiinitartraattia ei pidä antaa naisille, jotka ovat tai saattavat tulla raskaaksi, ellei mahdollinen hyöty lääkärin mielestä ole suurempi kuin mahdolliset vaarat.
Imettävät äidit
Ei tiedetä, erittyykö tämä lääke ihmismaitoon. Koska monet lääkkeet erittyvät ihmismaitoon, fendimetratsiinitartraattia ei pidä antaa imettäville naisille, elleivät mahdolliset hyödyt lääkärin mielestä ole mahdollisia vaaroja suuremmat.
Pediatrinen käyttö
Turvallisuutta ja tehoa lapsipotilailla ei ole varmistettu.
Haittavaikutukset
Kardiovaskulaariset: Palpitaatio, takykardia, kohonnut verenpaine, iskeemiset tapahtumat.
Valvulaarista sydänsairautta, joka liittyy joidenkin anorektisten aineiden, kuten fenfluramiinin ja deksfenfluramiinin, käyttöön, on raportoitu sekä itsenäisesti että erityisesti käytettäessä yhdessä muiden anorektisten lääkkeiden kanssa. Tällaista läppävaltimotautitapausta ei kuitenkaan ole raportoitu, kun fendimetratsiinitartraattia on käytetty yksinään.
Keskushermosto: Yleistimulaatio, levottomuus, unettomuus, kiihtymys, punoitus, vapina, hikoilu, huimaus, päänsärky, psykoottinen tila, näön hämärtyminen.
Ruokatorvi: Suun kuivuminen, pahoinvointi, ripuli, ummetus, vatsakipu.
Virtsaneritys: Virtsaamistiheys, dysuria, libidon muutokset.
Lääkkeiden väärinkäyttö ja riippuvuus
Valvottava aine
Bontril® PDM (fendimetratsiinitartraatti) kuuluu valvottaviin aineisiin (Schedule lll).
Riippuvuus
Fendimetratsiinitartraatti on kemiallisesti ja farmakologisesti sukua amfetamiineille. Amfetamiineja ja niihin liittyviä stimuloivia lääkeaineita on käytetty laajalti väärin, ja fendimetratsiinin väärinkäytön mahdollisuus on pidettävä mielessä arvioitaessa, onko lääkkeen sisällyttäminen osaksi painonpudotusohjelmaa suotavaa. Amfetamiinien ja niihin liittyvien lääkkeiden väärinkäyttöön voi liittyä voimakasta psykologista riippuvuutta ja vakavia sosiaalisia toimintahäiriöitä. On raportoitu potilaista, jotka ovat nostaneet annoksen moninkertaiseksi suositeltuun verrattuna. Suurten annosten pitkäaikaisen annostelun jälkeinen äkillinen lopettaminen johtaa äärimmäiseen väsymykseen ja psyykkiseen masennukseen; muutoksia havaitaan myös unen EEG:ssä. Anorektisten lääkkeiden kroonisen myrkytyksen ilmenemismuotoja ovat vakavat ihottumat, voimakas unettomuus, ärtyneisyys, hyperaktiivisuus ja persoonallisuuden muutokset. Kroonisten myrkytysten vakavin ilmenemismuoto on psykoosi, joka on usein kliinisesti erottamaton skitsofreniasta.
Yliannostus
Fendimetratsiinitartraatin akuutti yliannostus voi ilmetä seuraavina merkkeinä ja oireina: epätavallista levottomuutta, sekavuutta, riitaisuutta, hallusinaatioita ja paniikkitiloja. Väsymys ja masennus seuraavat yleensä keskeistä stimulaatiota. Sydän- ja verisuonivaikutuksia ovat rytmihäiriöt, hypertensio tai hypotensio ja verenkiertokollapsi. Ruoansulatuskanavan oireita ovat pahoinvointi, oksentelu, ripuli ja vatsakrampit. Myrkytys voi johtaa kouristuksiin, koomaan ja kuolemaan.
Yliannostuksen hoito on suurelta osin oireenmukaista. Siihen kuuluu rauhoittaminen barbituraatilla. Jos verenpainetauti on merkittävä, nitraatin tai nopeavaikutteisen alfareseptorin salpaajan käyttöä on harkittava. Kokemukset hemodialyysistä tai peritoneaalidialyysistä ovat riittämättömät, jotta niiden käytöstä voitaisiin antaa suosituksia.
Bontrilin annostus ja antotapa
Tavanomainen annostus aikuisille
1 tabletti (35 mg) kahdesti vuorokaudessa tai kolme kertaa vuorokaudessa tuntia ennen aterioita.
Annostus on yksilöitävä, jotta saadaan riittävä vaste pienimmällä tehokkaalla annoksella. Joissakin tapauksissa ½ tabletti (17,5 mg) annosta kohti voi olla riittävä. Annostus ei saisi ylittää 2 tablettia kolme kertaa päivässä.
Miten Bontrilia toimitetaan
Kolmekerroksinen vihreä, valkoinen ja keltainen tabletti, jonka jakouurteella on ”B 35” ja toisella puolella kirjain ”V”. Bontril® PDM -tabletteja, jotka sisältävät 35 mg fendimetratsiinitartraattia, on saatavana 100 (NDC 0187-0497-01) ja 1000 (NDC 0187-0497-02) pullossa.
Varastoidaan 25°C:ssa (77°F); poikkeamat sallittu 15°C-30°C:ssa (59°F-86°F).
DEA-tilauslomake vaaditaan.
Jälleenmyyjä:
Valeant Pharmaceuticals North America
One Enterprise
Aliso Viejo, CA 92656 USA
Valmistaja:
Mallinckrodt, Inc.
Hobart, NY 13788
Painettu elintarvikelaatuisella musteella.
MG #20886
Rev. 10/07
Part No. L2BB01
ESIMERKKIPANEELI – 35 mg:n tablettipullon etiketti
NDC 0187-0497-02
RX Only
CIII
Bontril® PDM
(phendimetratsiinitartraattitabletit, USP)
35 mg
Jokainen kolmikerroksinen
vihreä, valkoinen ja keltainen
tabletti sisältää 35 mg
fendimetratsiini
tartraattia
1000
tablettia
VALEANT™
| Bontril PDM fendimetratsiinia . tartraattitabletti |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
Labeler – Valeant Pharmaceuticals International (042230623)
| Toimipaikka | |||
| Nimi | Address | ID/FEI | Operations |
| MALLINCKRODT INC | 957414238 | MANUFACTURE(0187-0497) | |
Lisätietoa Bontril Hidas Vapauttaminen (fendimetratsiini)
- Sivut Effects
- During Pregnancy
- Dosage Information
- Drug Images
- Drug Interactions
- 35 Reviews
- Drug class:
Kuluttajan resurssit
- Potilastiedot
- Bontril (Tarkennettuun käsittelyyn)
- Bontril Slow-Release (Advanced Reading)
Professional resources
- Prescribing Information
- Phendimetrazine (AHFS Monografia)
Muut tuotemerkit Fendique ER
Hoito-oppaat
- Obesiteetti
Lääketieteellinen VASTUUVAPAUTUSLAUSEKKEEN MYÖNTÄMISEN EHDOT