Elektrokemiallinen kenno koostuu yksinkertaisimmillaan kahdesta elektronijohtimesta, jotka on erotettu toisistaan ionijohtimella ja jotka on yhdistetty elektronijohtimella.
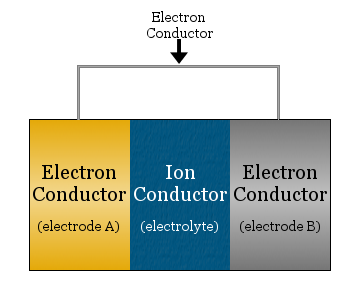
- ionijohdinta kutsutaan elektrolyytiksi
- elektrolyytin erottamia elektronijohtimia kutsutaan elektrodeiksi
- elektrodien yhdistämiseen käytetty elektronijohdin on usein metallilanka, kuten kuparijohto
Kahta kennotyyppiä
Elektrokemiallisessa kennossa on periaatteessa kahta eri tyyppiä: galvaaninen kenno ja sähkökemiallinen kenno.
Energiamuunnos tapahtuu spontaaneilla (ΔG < 0) redox-reaktioilla, jotka tuottavat elektronivirran.
Elektronivirta saa aikaan ei-spontaaneja (ΔG ≥ 0) redox-reaktioita.
Esimerkkejä
- Paristo, joka antaa virtaa jollekin, on esimerkki galvaanisesta kennosta.
- Lataavat akut ovat esimerkkejä molemmista kennotyypeistä: ne toimivat galvaanisina kennoina, kun ne syöttävät virtaa johonkin laitteeseen, ja elektrolyyttisinä kennoina, kun niitä ladataan.
- Esimerkkejä elektrolyyttisistä kennoista ovat myös kennot, joita käytetään veden jakamiseen vedyksi ja hapeksi, ja kennot, jotka muuttavat alumiinimalmin alumiinimetalliksi.
Termodynaamisten tietojen lähde
Elektrokemialliset kennot tarjoavat edellä kuvattujen kaltaisten käytännöllisten käyttötarkoitusten lisäksi erinomaisen tavan kerätä termodynaamisia tietoja.Ne mahdollistavat esimerkiksi vakioredox-potentiaalien määrittämisen, josta saadaan kätevästi reaktioiden vakioentalpia-, vakioentropia- ja vakio-Gibbsin vapaata energiaa koskevat tiedot.
Reaktioiden erottaminen
Elektrokemiallisilla kennoilla voidaan:
- toimittaa sähköä, tai
- muunntaa metallimalmit metalleiksi, tai
- antaa termodynaamisia tietoja,
koska redox-reaktiot tapahtuvat erikseen.
Esimerkki: Daniellin kenno
Elektrokemiallisissa kennoissa reaktiot tapahtuvat erillisillä elektrodeilla – ja itse elektrodit voidaan sijoittaa eri astioihin.Tarkastellaan yhtä varhaisista galvaanisista kennoista, Daniellin kennoa.
Daniellin kennon energianlähteenä on sinkkimetallin spontaani reaktio kuparisulfaatin kanssa, jolloin syntyy sinkkisulfaattia ja kuparimetallia.
ΔG° = -212.6 kJ mol-1
Kun aineet tuodaan yhteen:
- suorassa kosketuksessa yhdessä astiassa kemiallinen potentiaalienergia muuttuu lämpöenergiaksi ja reaktioastia lämpenee
- elektrokemiallisessa kennossa kemiallinen potentiaalienergia muuttuu sähköenergiaksi
Daniellin kenno
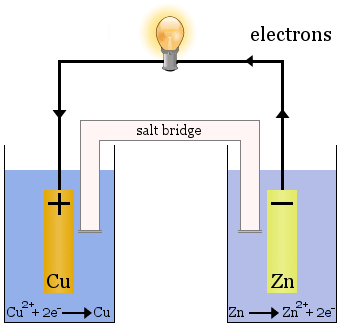
Daniellin kenno koostuu kahdesta puolikkaasta kennosta: Kupari-ionit pelkistyvät toisessa ja sinkki hapettuu toisessa.
Kun kenno toimii, toisesta kennosta poistuu Cu2+ ja toisessa kennossa syntyy Zn2+.Kuparielektrodi alkaa kasvaa, kun se pinnoitetaan tuoreella kuparimetallilla, ja sinkkielektrodi alkaa pienentyä, koska sinkkiä häviää ioneina liuokseen.
Suolasilta yllä olevassa tapauksessa on lasiputki, joka on täytetty kylläisellä KNO3-liuoksella.Sen päissä on friittejä, jotka estävät liuosten sekoittumisen kussakin puolikennossa, mutta se päästää ionit läpi täydentääkseen sähköpiirin ja pitääkseen jokaisen puolikennon sähköisesti neutraalina.
Ajovoima on sama ΔG° = -212.6 kJ mol-1, joka saadaan, kun reaktantit yksinkertaisesti sekoitetaan yhdessä astiassa;erottamalla kaksi puolireaktiota, elektronien on kuljettava johdon läpi ja voimme käyttää sähköenergiaa.

