- Katsausartikkeli
- Enterokutaaninen fisteli: Evidence-based Management
- Abstract
- Esittely
- Taulukko 1
- Taulukko 1: Luokittelu.
- Taulukko 2
- Kaavio 2: ECF:n ennustemuuttujat.
- Luokitus
- Ekf:n ennustetekijät
- Diagnoosi
- Kuva 1
- Hallinta
- elvytys
- Lähteiden hallinta
- Virtsan hallinta
- Haavanhoito
- Taulukko 3
- Taulukko 3: Ajoitus lopulliseen hoitoon.
- Ravitsemus
- Johtopäätös
Katsausartikkeli
Enterokutaaninen fisteli: Evidence-based Management
Ryan P Dumas1*, Sarah A Moore1 ja Carrie A Sims2
1Department of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at University of Pennsylvania, Philadelphia, PA, USA
2Department of Surgery, Division of Traumatology, Surgical Critical Care & Emergency Surgery, Perelman School of Medicine at the University of Pennsylvania, Philadelphia, PA, USA
*Corresponding author: Ryan P Dumas, Department ofTraumatology, Surgical Critical Care& Emergency Surgery, PerelmanSchool of Medicine at the University ofPennsylvania, 51 N. 39th Street, MOBSuite 120, Philadelphia, PA 19104,USA
Abstract
Sisäelinkirurgisen fistelin (ECF, Enterocutaneous fistula) hoitaminen on kliininen taito, jonka pitäisi kuulua jokaisen yleiskirurgian erikoislääkäreiden varustukseen. Vaikka lopullinen hoito perustuu usein kirurgiseen sulkemiseen, leikkausta edeltävä hoito ja huolellisuus ovat ensiarvoisen tärkeitä onnistuneen lopputuloksen varmistamiseksi. Näiden potilaiden hoidossa olisi keskityttävä neljään keskeiseen vaiheeseen. Ensimmäiselle vaiheelle on ominaista asianmukainen tunnistaminen ja elvytys. Toisessa vaiheessa tehdään täydellinen ravitsemusarviointi ja -suunnitelma. Kolmannessa vaiheessa tehtävä röntgenkuvaus auttaa määrittelemään ECF:n anatomian. Neljännelle vaiheelle on ominaista lopullinen sulkeminen, jos fisteli ei parane spontaanisti.Tässä katsauksessa keskitytään keskeisiin näkökohtiin, jotka määrittelevät kunkin vaiheen ja auttavat yleiskirurgia maksimoimaan mahdollisuudet myönteiseen lopputulokseen.
Esittely
Suolikanavan luumenin ja ulkoisen ihon väliseksi poikkeavaksi yhteydeksi määritellyn enterokutaanisen fistelin (ECF) kehittyminen on merkittävä sairastuvuus- ja kuolinkulkutekijä kirurgisen ja lääketieteellisen hoidon edistymisestä huolimatta. ECF:n yleinen esiintyvyys on kuitenkin tuntematon, ja suurin osa ECF:ää koskevista tiedoista on peräisin suurten laitosten retrospektiivisistä tai kirurgikohtaisista sarjoista. Huomionarvoista on, että vain 25 prosenttia kaikista ECF-tapauksista on seurausta tulehduksellisesta suolistosairaudesta, divertikkelipatologiasta, traumasta, säteilystä ja pahanlaatuisista kasvaimista. Sitä vastoin lähes 75 % kaikista ECF:istä on suoraa seurausta joko laparoskooppisesta tai avoleikkauksesta, ja yli 50 %:ssa näistä fistelistä on syynä senterektomian jälkeinen astomoosivuoto. Loput fistelistä johtuvat tahattomista iatrogeenisista vammoista, kuten enterotomioista tai tunnistamattomista lämpövammoista leikkauksen aikana. Koska ECF on useimmiten kirurgin aiheuttama ongelma, ennaltaehkäisyn sekä asianmukaisen hoidon, suunnittelun ja lopullisen hoidon vastuu lankeaa oikeutetusti kirurgille.
Morbiditeetti ja mortaliteetti ECF:n jälkeen on erittäin korkea. Arviolta 90 % potilaista kärsii ECF:ään liittyvästä sairastuvuudesta, joka vaihtelee ihoärsytyksestä kuivumiseen ja sepsikseen.Lisäksi ECF:n aiheuttama kuolleisuus vaihtelee 5-20 %:n välillä ja on riippuvainen useista tekijöistä, kuten perusinfektiosta ja fistelin sijainnista. Koska ECF-potilaiden tärkein kuolinsyy on sepsis, lähteen hallinta on edelleen yksi hoidon kulmakivistä. Takautuvissa sarjoissa kuolleisuuden todettiin lisääntyvän 16-kertaiseksi sepsiksen yhteydessä ja 22-kertaiseksi hallitsemattoman infektion yhteydessä. Näin ollen tyhjentymättömien kerääntymien varhaisella ja lopullisella hoidolla yhdessä lyhytaikaisten mikrobilääkkeiden kanssa voidaan parantaa tuloksia merkittävästi. Useimmissa sarjoissa kuolleisuus näyttää myös korreloivan fistelin ulostulon ja sijainnin kanssa. Kuolleisuus nousee 26 prosentista pienen tuotoksen fisteleissä 50 prosenttiin suuren tuotoksen fisteleissä, kun otetaan huomioon ECF:n hoitoon liittyvät neste-, elektrolyytti- ja ravitsemushaasteet. Kuolleisuus korreloi myös sijainnin kanssa ja vähenee distaalisemmissa fisteleissä. Kuolleisuus on korkein (29 %) ja huomattavasti haastavampi hoitaa, kun taas kolonifistelin kuolleisuus on alhaisin (6 %).
Potilaaseen kohdistuvien vaikutusten lisäksi, jotka vaihtelevat sekä fysiologisista että psykologisiin vaikutuksiin, ECF:n hoito rasittaa terveydenhuollon resursseja suunnattomasti. On arvioitu, että ECF:n hoidon kustannukset ovat reilusti yli 500 000 dollaria, ja se edellyttää ravitsemusterapeuttien, haavahoitajien ja kirurgien muodostamaa moniammatillista tiimiä hyvän lopputuloksen varmistamiseksi. Korkean asiantuntemuksen hoitokeskusten merkitystä ei pidä aliarvioida, ja niiden on osoitettu vähentävän kuolleisuutta merkittävästi 42 prosentista 20 prosenttiin.
Taulukko 1

| Anatomiset | Proksimaalinen tai distaalinen | Mahalaukun, pohjukaissuolikanavan, pohjukaissuolikanavan, jenunaalisen, ileaalisen , Colonic |
| Fysiologinen | Korkea, kohtalainen, matala ulostulo | Korkea ulostulo >500 cc/vrk Maltillinen 200-500 cc/vrk Matalan ulostulon < 200 cc/vrk |
| Etiologia | Iatrogeeninen vs. Spontaani Traumaattinen |
Maligni Säteily Tulehduksellinen suolistosairaus Divertikulaarinen |
Taulukko 1: Luokittelu.
Taulukko 1
Taulukko 1
Luokittelu.
Taulukko 2

| SUOSITUKSELLINEN | Epäsuotuisa |
|---|---|
| Ravitsemuksellisesti täysipainoinen | Ravitsemuksellisesti köyhä |
| – Albumiini >3.0 | -Matala albumiini, matala transferriini |
| Pitkä fistelireitti (>2cm) | Lyhyt fisteli, moninkertainen, monimutkainen fisteli |
| Divertikulaarinen fisteli | Suuri enteraalinen vikaantuminen (>1cm), näkyvä limakalvo |
| Matalan ulostulon | Korkean ulostulon (>500cc/vrk) |
| Yksittäinen fisteli | Säteilyä edeltävä |
| Suoliston jatkuvuus | Moninkertaiset aiemmat leikkaukset |
| Esimerkkileikkaus suoritettu samassa keskuksessa | Lähetteet korkeaanvolyymikeskukseen |
Kaavio 2: ECF:n ennustemuuttujat.
Taulukko 2
ECF:n ennustemuuttujat.
Luokitus
ECF:n luokittelussa ei ole yleispätevää tai vakiintunutta luokitusjärjestelmää. Fistelit luokitellaan yleensä anatomisesti, fysiologisestitai tautiprosessin mukaan . Fisteleitä voidaan lisäksi luokitella päivittäisen ulostulon määrän mukaan. On ehdottoman tärkeää, että fistelin ulostulo dokumentoidaan tarkasti, koska sen määrä voi sanella muutoksia hoidossa. Taulukossa 1 esitetään yksityiskohtaisesti kolme erilaista luokitteluparadigmaa.
Ekf:n ennustetekijät
Ekf:n ennustetekijät on kuvattu hyvin ja ne ovat yhdenmukaisia tavanomaisen kirurgisen dogman kanssa. Potilaat, joilla on proksimaalinen, suuren ulostulon fisteli, johon liittyy alhainen albumiinipitoisuus(. Sitä vastoin potilaat, joilla ei ole liitännäissairauksia ja joilla on kirurgisen toimenpiteen tuloksena syntynyt fisteli ja alhainen ulostuloteho, voivat suotuisammin, ja heidän spontaanit sulkeutumisnopeutensa ovat korkeammat. Taulukossa 2 esitetään yksityiskohtaisesti monia muuttujia, jotka voivat ennustaa onnistunutta lopputulosta.
Organisaation tuen ja monialaisen asiantuntemuksen merkitystä positiivisena ennustetekijänä ei voi korostaa liikaa.Useat tutkimukset ovat vahvistaneet, että laitoksen kokemus ja volyymi ovat ratkaisevia tekijöitä sairastuvuuden vähentämisessä ja kuolleisuuden parantamisessa. Canadian Association for EnterostomalTherapy (Canadian Association for EnterostomalTherapy) kodifioi hiljattain monialaisen hoidon merkityksen määrittelemällä yhdeksän keskeistä tiimin jäsentä ECF:n parhaita käytäntöjä koskevissa suosituksissaan. Tämä integroitu tiimilähestymistapa tunnustaa kunkin erikoisalan asiantuntemuksen, jota kukin erikoisala tuo näiden monimutkaisten potilaiden hoitoon.
Diagnoosi
Elleuksen hankaloittama kytevä postoperatiivinen kulku ja leikkauksenjälkeisen haavainfektion kehittyminen ovat ECF:n esiaste. Kun fisteliä epäillään tai se on todettu fyysisessä tutkimuksessa, radiologiset tutkimukset ovat välttämättömiä, ja 97 prosentille kaikista potilaista tehdään jonkinlainen radiologinen arviointi. KontrastipainotteinenCT-kuvaus on välttämätön, koska sillä arvioidaan, onko siihen liittyvä paise tai tyhjentymätön keräys. Kun lähteen hallinta on optimoitu, läpivalaisufistulografialla on tärkeä rooli fistelin anatomian määrittelyssä. Fistulografia auttaa paikantamaan alkuperän, määrittämään pituuden, arvioimaan distaalisen tukoksen olemassaolon ja määrittämään, onko fisteli jatkuvuus muun suolen kanssa. Kun ECF-diagnoosi on varmistettu, on keskityttävä hoitoon.
Kuva 1
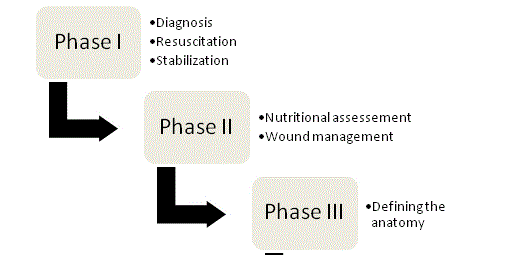
Kuva 1
ECF:n hallinnan neljä vaihetta.
Hallinta
Ekf:n hallinnan periaatteet esittivät ensimmäisen kerranChapman ja kollegat vuonna 1964, ja ne ovat edelleen hoidon kulmakiviä. Alkuperäisessä artikkelissaan Chapman ja muut määrittelivät neljä avaintekijää: nesteen elvytys, lähteiden hallinta, jätevesien hallinta ja ihon suojaaminen. Ravitsemuksen merkitys on hiljattain noussut esiin viidentenä avaintekijänä. Jokaisen fistelipotilaan kohdalla olisi noudatettava järjestelmällistä ja järjestelmällistä lähestymistapaa, jotta onnistuneen lopputuloksen mahdollisuudet olisivat mahdollisimman hyvät, ja hoito voidaan jakaa neljään vaiheeseen (kuva 1).
elvytys
Potilaan, jolla on vastikään diagnosoitu EKF, elvyttäminen noudattaa monia samoja periaatteita kuin septisten potilaiden elvyttäminen, ja Surviving Sepsis -kampanjan (Surviving Sepsis -kampanja) periaatteiden olisi toimittava kehyksenä. Alkuhoidossa olisi keskityttävä aggressiiviseen nesteiden elvytykseen, elektrolyyttitasapainon nopeaan arviointiin ja korjaamiseen sekä maitohappoasidoosin normalisointiin. Potilaat, joilla on ECF, ovat yleisestihyponatremisia, hypokalemisia ja asidoottisia jatkuvien GI-häviöiden vuoksi.Potilaille, joilla on suurituotantoiset fistelit, neste-, elektrolyytti- ja bikarbonaattitappiot on korvattava suonensisäisesti nestehukan ja syvän metabolisen epävakauden välttämiseksi alkuvaiheen vakauttamisjakson aikana. Virtsanerityksen huolellinen seuranta ja fistelin poistoveden kohdennettu korvaaminen 4-8 tunnin välein estävät jatkuvan dehydraation.
Lähteiden hallinta
Kun potilas on elvytetty, huomio on siirrettävä lähteiden hallintaan. Kuten aiemmin mainittiin, kontrastainetehosteinenCT-kuvaus auttaa tunnistamaan tyhjentymättömät keräymät ja paiseet. Leikkauksen jälkeisillä potilailla lähteen hallintaon todennäköisimmin toteutettu toimenpideradiologian avulla. Jos kammiot ovat kuitenkin saavuttamattomissa tai vatsaontelon sisäinen sektio on hallitsematon, leikkaus voi olla väistämätön. Laajakirjoisia empiirisiä suonensisäisiä antibiootteja ei pitäisi käyttää rutiininomaisesti EKF:n hoitoon, ellei ole näyttöä vatsaontelon sisäisistä keräytymistä tai haavainfektiosta ja siihen liittyvästä selluliitista. Aina kun se on mahdollista, antibiootit olisi kohdennettava tiettyihin viljelytietoihin, ja niiden käyttöaika olisi rajoitettava alle kahteen viikkoon.
Virtsan hallinta
Virtsan hallinnalla voi olla merkittävä vaikutus tilavuustilanteeseen, elektrolyyttitasapainoon, ravitsemukseen ja ihon koskemattomuuteen.ECF-eritteen lisälääkehoidossa on perinteisesti keskitytty kahteen pääalueeseen: happojen neutralointiin ja tilavuuden pienentämiseen.Protonipumpun estäjien käytöllä voidaan saavuttaa molemmat tavoitteet, ja annos on titrattava, kunnes eritteen pH on yli 6 ja ulostulon tilavuus on alle 1 l/vrk. Vaikka psyllium voi olla erittäin hyödyllinen ulosteen täyteaineena ja läpikulkuajan pidentämisessä, volyymin pienentämisen tärkeimpiä keinoja ovat antimotiliteetti- ja sekretoriset aineet, kuten loperamidi, atropiinidifenoksylaatti, kodeiini, oopiumin tinktuura ja jopa metadoni. Koska somatostatiini on yleinen ruoansulatuskanavan hormonien estäjä, on tutkittu paljon eksogeenisen somatostatiinin vaikutuksia ECF-potilailla. Huolimatta merkittävästä määrästä satunnaistettuja kontrolloituja tutkimuksia, merkittäviä johtopäätöksiä on vaikea saada selville pienen otoskoon ja epäjohdonmukaisen tutkimusasetelman vuoksi. Octreotidia, pitkäkestoisempaa somatostatiinianalogia, on myös tutkittu ECF:n lisälääkkeenä lupaavin tuloksin. Octreotidi 100 mcg kolme kertaa päivässä voi vähentää poistovirtauksen määrää, ja sen on joissakin tutkimuksissa osoitettu lyhentävän spontaaniin sulkeutumiseen kuluvaa aikaa. Näin ollen voi olla perusteltua kokeilla oktreotidihoitoa 72 tunnin ajan ja seurata fistelin ulostulovolyymiä tiiviisti, erityisesti tapauksissa, joissa muut hoidot eivät ole onnistuneet vähentämään ulostulovolyymiä. Yleisiä haittavaikutuksia ovat mm. hyperglykemia, päänsärky ja sappikivitauti.
Vaikka on selvää, että pienen ulostulovolyymin fistelien spontaani sulkeutumisnopeus on suurempi, ei ole yhtä selvää, että ulostulovolyymin pienentäminen parantaisi fistelin sulkeutumista. Tuotantomäärän vähentäminen voi kuitenkin helpottaa merkittävästi fistelin hoidosta aiheutuvaa taakkaa ja vaikuttaa myönteisesti potilaan hyvinvointiin.
Haavanhoito
Ehkä yksi ECF:n hoidon ehkä haastavimmista ja resursseja vaativimmista näkökohdista on poistoveden paikallinen hallinta. Successenteric me voi nopeasti rikkoa ihon ja aiheuttaa ärsytystä, jota on vaikea hoitaa. Siksi asianmukainen ihonhoito sulkuvoiteilla, kosteussuluilla, pussituslaitteilla ja imulaitteilla on ensiarvoisen tärkeää. Erityisesti suuritehoiset fistelit edellyttävät usein monimutkaista viemäri-, pussi- ja imuverkostoa, jotta nestettä voidaan hallita asianmukaisesti. Erikoistuneet haavanhoitoryhmät ja enterostomal terapeutit ovat korvaamattomia sekä haavanhoidon että potilaan viihtyvyyden kannalta.
Koska alipainehoidon (NPT) käyttö on yleistynyt haavojen ja avoimen vatsan hoidossa, ei ole yllättävää, että NPT:stä on tullut osa kirurgista aseistusta ECF:n hoidossa. Tähän mennessä suurimmassa sarjassa Wainstein ym. raportoivat kokemuksistaan 91 potilaasta, joilla oli suuren ulostulovirtauksen fisteleitä ja joita hoidettiin alipaineella, joka vaihteli -350 ja -600 mmHg välillä. Sen lisäksi, että ulostulovirtaus väheni merkittävästi keskimäärin 1400 kuutiosenttimetristä päivässä 138 kuutiosenttimetriin päivässä, 46 prosentilla potilaista saavutettiin spontaani sulkeutuminen.Vuonna 2016 Misky ym. julkaisivat meta-analyysin, jossa tutkittiin NPT:n käyttöä ECF:ssä. Käyttämällä kymmentä retrospektiivistä tutkimusta, joissa oli yhteensä 151potilasta, nämä kirjoittajat havaitsivat, että spontaanin sulkeutumisen mediaani oli 65 % (vaihteluväli 7-100 %) ja sulkeutumisen mediaaniaika oli 58 päivää. Nämä tutkijat raportoivat myös, että uusien fisteleiden osuus oli 4,4 % – tunnettu komplikaatio, joka on antanut joillekin lääkäreille aihetta huoleen.Vaikka lisätutkimuksia tarvitaan selvästi sen selvittämiseksi, voiko NPT parantaa lopullisesti ECF:n sulkeutumisprosenttia tai lyhentää spontaaniin sulkeutumiseen kuluvaa aikaa, näiden sidosten myönteisiä hyötyjä ei pidä jättää huomiotta. Ainakin tämä tekniikka voi helpottaa ECF:n hoitoa valvomalla vuotoa, suojaamalla ihoa ja vähentämällä sidosten vaihtotiheyttä.
Taulukko 3

| Tutkijat | Institutionaalinen käytäntö |
|---|---|
| Hollington | 8 kk |
| Evenson | 4 kk |
| Rahbour | 12 kk |
| Datta | 6 kk |
| Lynch | 6 kk |
| Li | 6 kuukautta |
| Mcintyre | 6 kuukautta |
Taulukko 3: Ajoitus lopulliseen hoitoon.
Taulukko 3
Ajoitus lopulliseen hoitoon.
Ravitsemus
ArvioINTIEkf-potilaan ravitsemustila on ensiarvoisen tärkeä. Ennen peptidipohjaisten enteraalisten kaavojen ja totaalisen parenteraalisen ravitsemuksen (TPN) tuloa retrospektiiviset historialliset sarjat korostavat ECF-potilaiden aliravitsemusta. Eräässä 1950- ja 1960-luvuilla tehdyssä 157 potilaan sarjassa lähes 75 prosenttia potilaista, joilla oli proksimaalinen fisteli, oli aliravittuja. Samankaltaisia tuloksia raportoivat Chapman ja muut, jotka havaitsivat, että vain pienellä vähemmistöllä potilaista oli optimaalinen ravitsemus ja että kun ravitsemusta oli parannettu, ECF:ään liittyvä kuolleisuus laski 55 prosentista 12-16 prosenttiin.
Kaikki potilaat, joilla on ECF, olisi arvioitava täydellisesti ravitsemuksellisesti. Vaikka Harris-Benedictin yhtälö tarjoaa hyvän lähtökohdan ravitsemustarpeen laskemiselle, on yleisesti hyväksytty, että EKF-potilaat ovat katabolisia ja hypermetabolisia.Yleensä nämä potilaat tarvitsevat enemmän kaloritukea, joka sisältää hiilihydraatteja ja rasvaa vähintään 25-30 kcal/kg/vrk ja 1,5-2 grammaa proteiinia/kg/vrk.
Ravitsemustilaa ja sen edistymistä on arvioitava säännöllisesti uudelleen. Päivittäisen painon lisäksi on seurattava säännöllisiä ravitsemuslaboratoriotutkimuksia, kuten albumiini-, prealbumiini-, siirto- ja CRP-arvoja.Erityisesti preoperatiivisen albumiinipitoisuuden on osoitettu olevan voimakkain kuolleisuuden ja sairastuvuuden ennustaja yleiskirurgian jälkeen, ja hypoalbuminemia on edelleen merkittävä huonon lopputuloksen ennustaja ECF-potilailla . Kenties eniten tutkittu proteiini ECF:ssä on kuitenkin transferriini, ja yli 140:n pitoisuudet ovat liittyneet lisääntyneeseen spontaaniin sulkeutumisprosenttiin ja vähentyneeseen kuolleisuuteen. Vaikka typpitasapaino voi olla hyödyllinen apuväline, tämä standardimittaus voi olla vaikeaa potilailla, joilla on suuritehoinen fisteli. Lisätestejä, kuten epäsuoraa kalorimetriaa, voidaan harkita monimutkaisemmissa tapauksissa, jotka eivät reagoi standardihoitoon.
Parenteraalinen vs. enteraalinen ravitsemus
Parenteraalisella ravitsemuksella on ollut kriittinen rooli ECF:n hoidossa, ja sen käytön on vakiinnuttanut Dudrick vuonna 1969.Dudrick totesi TPN:n optimaalista hoitoa kuvaavassa artikkelissaan, että: ”parenteraalisen hyperalimentaation yksinomaisella käytöllä saavutetaan säännöllisesti painonnousu, positiivinen typpitasapaino, kasvu ja kehitys”. Vaikka TPN vähentää GI-eritteitä 30-50 prosenttia ja vähentää siten nestehukan ja elektrolyyttitasapainon epätasapainon esiintymistä, ei ole olemassa satunnaistettuja tutkimuksia, joissa olisi selvitetty TPN:n vaikutusta anabolisten aineiden muuntumiseen, spontaanien sulkeutumisten määrään tai kuolleisuuteen. TPN on kuitenkin edelleen suosittu pitkäaikainen hoitomuoto huolimatta vakavista komplikaatioista, kuten infektioista ja maksan toimintahäiriöistä.
Viime aikoina enteraalisen ravitsemuksen käyttö EKF:ssä on kuitenkin yleistynyt. Enteraalisella ravitsemuksella on useita etuja, kuten pienemmät kustannukset, vähemmän infektioita ja parempi immunologinen toiminta verrattuna TPN:ään. Lisäksi jopa vain 20 %:n kalorimäärän antaminen enteraalisesti voi auttaa ylläpitämään suolistoflooraa ja vähentämään bakteerien siirtymistä.
Monissa sarjoissa on raportoitu yllättävää menestystä enteraalisella ravitsemuksella ECF-potilailla. Li ym. retrospektiivisessä sarjassa 86,4 %:a 1168 potilaasta hoidettiin tehokkaasti enteraalisella tuella.Enteraalista ravitsemusta voidaan käyttää menestyksekkäästi jopa suuren ulostulovirtauksen fistelin yhteydessä, kun siihen yhdistetään alkuainemuotoisia kaavoja, antimotiliteettilääkkeitä ja kuitujen täyteaineita. Levy et al. pystyivät 335 potilaan sarjassa, joilla oli suuren ulostulovirtauksen fisteli, saavuttamaan onnistuneesti TPN-riippumattomuuden 85 prosentilla heidän kohortistaan käyttämällä enteraalista ravintoa. Mielenkiintoista on, että enteraalisesta ravitsemuksesta ja ”suolen levon” puuttumisesta huolimatta kuolleisuus ja spontaanin sulkeutumisen asteet olivat samankaltaisia kuin aiemmissa sarjoissa.
Korkeatehoisessa ECF:ssä, jossa on distaalinen limakalvon raaja, fistuloklyysi voi olla tärkeä lisä tavanomaisen enteraalisen ravitsemuksen rinnalla. Fistuloklyysin käytäntö on peräisin vastasyntyneiden vastasyntyneiden sivelyvalmisteiden uudelleensyöttökäytännöstä, ja sillä voidaan viitata joko uudelleensyöttöön tai ylimääräisen enteraalisen letkuruokinnan täydentämiseen ECF:n distaaliseen raajaan asetetun katetrin kautta. Teubner ym. kuvasivat ensimmäisen kerran fistuloklyysin ECF:n hoitomuotona vuonna 2004 kahdentoista potilaan tapaussarjassa, joilla oli proksimaalinen fisteli. Sittemmin useat tapausraportit ja pienet sarjat ovat osoittaneet tämän tekniikan ravitsemuksellisen tehokkuuden. Verrattaessa TEN-potilaiden vastaavaan potilaskohorttiin, jolle ei tehty fistuloklyysiä, fistuloklyysillä hoidetuilla potilailla, joilla oli suuritehoinen fisteli, maksan toiminta ja ravitsemusparametrit paranivat merkittävästi. Fistuloklyysi voi olla erityisen hyödyllinen potilaille, joille kehittyy TPN:ään liittyviä komplikaatioita, kuten infektioita, laskimoon pääsyyn liittyviä ongelmia tai maksan vajaatoimintaa. Komplikaatioita voi kuitenkin esiintyä, ja niihin voi kuulua tukkeutuminen, jos ohutsuolen peristalttinen aktiivisuus vie fistelikatetrin distaalisesti ohutsuoleen.
Vitamiinit ja kivennäisaineet ovat usein puutteellisia ECF-potilailla.Rasvaliukoisten vitamiinien puutokset ovat yleisiä, kun taas vesiliukoisten vitamiinien puutokset ovat harvinaisia, ellei fisteli sijaitse proksimaalisessa jejunumissa. Koska B12-vitamiini imeytyy vain ileumin loppupään 50-60 senttimetrissä, monet ECF-potilaat saattavat tarvita injektoitavaa B12-vitamiinia. Magnesiumia menee usein hukkaan suuritehoisissa fistelissä, ja sitä olisi täydennettävä joko suonensisäisellä magnesiumsulfaatilla tai suun kautta otettavalla magnesiumkloridilla enteraalisen imeytymisen parantamiseksi. Lopuksi on suositeltu sekä sinkin että C-vitamiinin antamista suurina annoksina. Omega-3- ja kalaöljyä on tutkittu tehohoidossa, ja niistä on saatu jonkin verran hyötyä, mutta näitä lisäravinteita ei ole koskaan arvioitu ECF-potilailla, eikä niitä käytetä rutiininomaisesti.
Operatiiviset näkökohdat
Spontaanin ECF:n sulkeutumisprosentti vaihtelee kirjallisuudessa 15-75 %:n välillä. Tämä sulkeutumisprosenttien suuri vaihteluväli kuvastaa todennäköisesti eroja potilaspopulaatioissa ja laitosten käytännöissä. Fistelit sulkeutuvat huomattavasti epätodennäköisemmin spontaanisti yli 4 viikon kuluttua, ja vain 10 % fisteleistä sulkeutuu kahden kuukauden kuluttua. Koska spontaanin ECF:n sulkeutumisprosentti on alhainen, kirurginen toimenpide on usein ainoa lopullinen hoitostrategia.
Päätöstä ECF:n leikkaamisesta ei kuitenkaan pidä ottaa kevyesti, sillä ECF:n poiston jälkeiset uusiutumisprosentit vaihtelevat 13-34 %:n välillä. Vaikka ECF:n kirurgisen toimenpiteen periaatteet sisältävät monia yleiskirurgian keskeisiä periaatteita, leikkausajankohta on ehkä tärkein huomioon otettava tekijä. Fazio ja muut osoittivat odottavan hoidon merkityksen ECF-potilaiden hoidossa. Kun leikkaus tehtiin alle 6 viikon kuluttua ECF:n muodostumisesta, kuolleisuus oli yli 20 prosenttia. Kun leikkausta lykättiin yli 6 viikolla, kuolleisuus kuitenkin laski 11 prosenttiin.Lisäksi varhainen leikkaus lisää mahdollisesti uusiutumisriskiä. Lynchin ja muiden tekemässä sarjassa potilailla, jotka leikattiin 2-12 viikkoa ECF:n muodostumisen jälkeen, uusiutumisprosentti oli 28 %, kun taas yli 12 viikon viive vähensi uusiutumisprosentin 15 %:iin. Taulukosta 3 käy ilmi, kuinka kauan asiantuntijat suosittelevat odottamaan, ennen kuin harkitaan leikkaushoitoa parantumattoman ECF:n vuoksi.
Operatiivista hoitoa tulisi jatkaa vain, jos sekä potilas että kirurgi panostavat siihen täysimääräisesti ja ymmärtävät sen. EKF:n sulkeumat ovat pitkiä, teknisesti haastavia tapauksia, joihin liittyy merkittävien komplikaatioiden riski. Leikkaukset edellyttävät usein suolen täydellistä liikuntakyvyttömyyttä Treitzin ligamentista peräsuoleen.Kun otetaan huomioon, että 36 prosenttia toistuvista fisteleistä on seurausta ECF:n sulkemisleikkauksen aikana syntyneistä vammoista, on kiinnityskudosten lyysauksen aikana oltava erittäin varovainen, jotta vältetään tahattomat vammat terveelle suolistolle. Fistuloivan suolen hoidossa olisi aina tehtävä suolen resektio ja primäärinen astomoosi. Fistelin yliompelu tai reunaresektio johtaa poikkeuksetta suurempaan uusiutumiseen (36 % vs. 16 %).
Johtopäätös
Enterokutaaninen fisteli on yksi haastavimmista yleiskirurgin kohtaamista komplikaatioista. Huolellisen, järjestelmällisen ja potilaskeskeisen lähestymistavan käyttö auttaa maksimoimaan onnistuneet kliiniset tulokset. Vaikka ECF:n hoidon periaatteet ovat johdonmukaisia eri potilailla, jokainen fisteli on ainutlaatuinen, ja sen hoito määräytyy suurelta osin sen ulostulon, sijainnin ja potilaan liitännäissairauksien mukaan. Kirurgikohtainen ja laitoskohtainen kokemus korostaa viivästetyn toimenpiteen merkitystä. Vaikka sekä kirurgit että potilaat saattavat haluta kovasti jatkaa kirurgista sulkemista, potilaita palvelee parhaiten vähintään 6 kuukautta kestävä ei-operatiivinen hoito. Viime kädessä ECF-potilaiden pitkäaikaishoito vaatii monialaista hoitoa, jota kirurgi usein koordinoi.
- Hollington P, Mawdsley J, Lim W, Gabe SM, Forbes A, Windsor AJ. An 11-year experience of enterocutaneous fistula. Br J Surg. 2004; 91:1646-51.
- Li J, Ren J, Zhu W, Yin L, Han J. Enterokutaanisten fistuloiden hoito: 30 vuoden kliininen kokemus. Chin Med J (Engl). 2003;116:171-5.
- McIntyre PB, Ritchie JK, Hawley PR, Bartram CI, Lennard-Jones JE. Management of enterocutaneous fistulas: A review of 132 cases. Br J Surg. 1984;71:293-6.
- Soeters PB, Ebeid AM, Fischer JE. Katsaus 404 potilaaseen, joilla oli maha-suolikanavan fisteli. Parenteraalisen ravitsemuksen vaikutus. Ann Surg. 1979;190:189-202.
- Rahbour G, Gabe SM, Ullah MR, Thomas GP, Al-Hassi HO, Yassin NA, et al. Seven-year experience of enterocutaneous fistula with univariate and multivariate analysis of factors associated with healing: development of a validated scoring system. Colorectal Dis. 2013;15:1162-70.
- Gonzalez-Pinto I, Gonzalez EM. Ylemmän ruoansulatuskanavan fistelien hoidon optimointi. Gut. 2001;49 Suppl 4:iv22-31.
- Lloyd DA, Gabe SM, Windsor AC. Ravitsemus ja enterokutaanisen fistelin hoito. Br J Surg. 2006;93:1045-55.
- Berry SM, Fischer JE. Enterokutaanisten fistuloiden luokittelu ja patofysiologia. Surg Clin North Am. 1996;76:1009-18.
- Fischer JE. Enterokutaanisten fistuloiden patofysiologia. World J Surg. 1983;7:446-50.
- Draus JM, Jr., Huss SA, Harty NJ, Cheadle WG, Larson GM. Enterokutaaninen fisteli: paranevatko hoidot? Surgery. 2006;140:570-6.
- Martinez JL, Luque-de-Leon E, Mier J, Blanco-Benavides R, Robledo F. Systematic management of postoperative enterocutaneous fistulas: factors related to outcomes. World J Surg. 2008;3:436-43.
- Misky A, Hotouras A, Ribas Y, Ramar S, Bhan C. Systemaattinen kirjallisuuskatsaus tyhjiöavusteisen sulkemisen käytöstä enterokutaanisessa fistelissä. Colorectal Dis. 2016;18:846-51.
- Campos AC, Andrade DF, Campos GM, Matias JE, Coelho JC. Monimuuttujamalli ruoansulatuskanavan fistelien ennustetekijöiden määrittämiseksi. J Am Coll Surg. 1999;188:483-90.
- Levy E, Frileux P, Cugnenc PH, Honiger J, Ollivier JM, Parc R. High-output external fistulae of the small bowel: management with continuous enteral nutrition. Br J Surg. 1989;76:676-9.
- Lundy JB, Fischer JE. Historiallisia näkökulmia potilaiden hoitoon, joilla on enterokutaaninen fisteli. Clin Colon Rectal Surg. 2010;23:133-41.
- Bleier JI, Hedrick T. Metabolic support of the enterocutaneous fistula patient. Clin Colon Rectal Surg. 2010;23:142-8.
- Teixeira PGR, Inaba K, Dubose J, Salim A, Brown C, Rhee P, et al. Enterocutaneous fistula complicating trauma laparotomy: A major resource burden. Am Surg. 2009;75:30-2.
- Irving M, White R, Tresadern J. Kolmen vuoden kokemus suolen vajaatoimintayksiköstä. Ann R Coll Surg Engl. 1985;67:2-5.
- Schecter WP, Hirshberg A, Chang DS, Harris HW, Napolitano LM, Wexner SD, et al. Enteric fistulas: principles of management. J Am Coll Surg. 2009;209:484-91.
- Gribovskaja-Rupp I, Melton GB. Enterokutaaninen fisteli: Todistetut strategiat ja päivitykset. Clin Colon Rectal Surg. 2016;29:130-7.
- McNaughton V, Canadian Association for Enterostomal Therapy ECFBPRP, Brown J, Hoeflok J, Martins L, McNaughton V, et al. Summary of best practice recommendations for management of enterocutaneous fistulae from the Canadian Association for Enterostomal Therapy ECF Best Practice Recommendations Panel. J Wound Ostomy Continence Nurs. 2010;37:173-84.
- Evenson AR, Fischer JE. Enterokutaanisen fistelin nykyinen hoito. Journal of gastrointestinal surgery: Official journal of the Society for Surgery of the Alimentary Tract. 2006;10:455-64.
- Chapman R, Foran R, Dunphy JE. Management of Intestinal Fistulas. Am J Surg. 1964;108:157-64.
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, et al. Surviving sepsis -kampanja: Kansainväliset ohjeet vakavan sepsiksen ja septisen sokin hoitoon: 2012. Crit Care Med. 2013;41:580-637.
- Hesse U, Ysebaert D, de Hemptinne B. Role of somatostatin-14 and its analogues in the management of gastrointestinal fistulae: clinical data. Gut. 2001;49:iv11-21.
- Wainstein DE, Fernandez E, Gonzalez D, Chara O, Berkowski D. Suuritehoisten enterokutaanisten fistelien hoito tyhjiötiivistyslaitteella. Kymmenen vuoden kokemus. World J Surg. 2008;32:430-5.
- Edmunds LH, Jr., Williams GM, Welch CE. Ruoansulatuskanavasta syntyvät ulkoiset fistelit. Ann Surg. 1960;152:445-71.
- Polk TM, Schwab CW. Enterokutaanisen fistelipotilaan metabolinen ja ravitsemuksellinen tuki: kolmivaiheinen lähestymistapa. World J Surg. 2012;36:524-33.
- Gibbs J, Cull W, Henderson W, Daley J, Hur K, Khuri SF. Preoperatiivinen seerumin albumiinitaso operatiivisen kuolleisuuden ja sairastuvuuden ennustajana: tuloksia National VA Surgical Risk Study -tutkimuksesta. Arch Surg. 1999;134:36-42.
- Martinez JL, Luque-de-Leon E, Ballinas-Oseguera G, Mendez JD, Juarez-Oropeza MA, Roman-Ramos R. Tekijät, jotka ennustavat uusiutumista ja kuolleisuutta enterokutaanisen fistelin kirurgisen korjauksen jälkeen. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract. 2012;16:156-63; 63-4.
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE. Voiko suonensisäinen ruokinta ainoana ravitsemuskeinona tukea lapsen kasvua ja palauttaa aikuisen laihtumisen? Myönteinen vastaus. Ann Surg. 1969;169:974-84.
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. Enteral versus parenteraalinen ravitsemus kriittisesti sairailla potilailla: ajantasaistettu systemaattinen katsaus ja satunnaistettujen kontrolloitujen tutkimusten meta-analyysi. Crit Care. 2016;20:117.
- Teubner A, Morrison K, Ravishankar HR, Anderson ID, Scott NA, Carlson GL. Fistuloklyysi voi menestyksekkäästi korvata parenteraalisen ravitsemuksen potilaiden ravitsemuksellisessa tukemisessa, joilla on enterokutaaninen fisteli. British Journal of Surgery. 2004;91:625-31.
- Ham M, Horton K, Kaunitz J. Fistuloklyysi: tapausselostus ja kirjallisuuskatsaus. Nutr Clin Pract. 2007;22:553-7.
- Wu Y, Ren J, Wang G, Zhou B, Ding C, Gu G, et al. Fistuloklyysi parantaa maksan toimintaa ja ravitsemustilaa potilailla, joilla on suuritehoinen ylempi suolistofisteli. Gastroenterol Res Pract. 2014;2014.
- Schecter WP. Enterokutaanisten fistuloiden hoito. Surg Clin North Am. 2011;91:481-91.
- Haffejee AA. Suuren ulostulon enterokutaanisten fisteleiden kirurginen hoito: 24 vuoden kokemus. Curr Opin Clin Nutr Metab Care. 2004;7:309-16.
- Ross H. Enterokutaanisen fistelin operatiivinen leikkaus. Clin Colon Rectal Surg. 2010;23:190-4.
- Lynch AC, Delaney CP, Senagore AJ, Connor JT, Remzi FH, Fazio VW. Kliininen lopputulos ja uusiutumista ennustavat tekijät enterokutaanisen fistelileikkauksen jälkeen. Ann Surg. 2004;240:825-31.
- Runstrom B, Hallbook O, Nystrom PO, Sjodahl R, Olaison G. Outcome of 132 consecutive reconstructive operations for intestinal fistula–staged operation without primary anastomosis improved outcome in retrospective analysis. Scand J Surg. 2013;102:152-7.
- Reber HA, Roberts C, Way LW, Dunphy JE. Ulkoisten ruoansulatuskanavan fistelien hoito. Ann Surg. 1978;188:460-7.