Oppimistavoitteet
- Käyttää kennomerkintöjä galvaanisten kennojen kuvaamiseen
- Kuvailla galvaanisten kennojen peruskomponentit
Galvaaniset kennot, jotka tunnetaan myös nimellä volttikennot, ovat sähkökemiallisia kennoja, joissa spontaanit hapettumis-pelkistymisreaktiot tuottavat sähköenergiaa. Yhtälöitä kirjoitettaessa on usein kätevää erottaa hapettumis-pelkistymisreaktiot puolireaktioiksi kokonaisyhtälön tasapainottamisen helpottamiseksi ja varsinaisten kemiallisten muunnosten korostamiseksi.
Tarkastellaan, mitä tapahtuu, kun puhdas kuparimetallipala asetetaan hopeanitraattiliuokseen (kuva 1). Heti kun kuparimetalli lisätään, hopeametallia alkaa muodostua ja kupari-ioneja siirtyy liuokseen. Liuoksen sininen väri aivan oikealla osoittaa kupari-ionien läsnäoloa. Reaktio voidaan jakaa kahteen puolireaktioon. Puolireaktiot erottavat hapettumisen ja pelkistymisen toisistaan, joten kumpaakin voidaan tarkastella erikseen.
Pelkistymispuolireaktion yhtälö oli kaksinkertaistettava, jotta pelkistymispuolireaktiossa ”saatujen” elektronien määrä vastaisi hapettumispuolireaktiossa ”menetettyjen” elektronien määrää.

Galvaanisiin tai voltaisiin kennoihin liittyy spontaaneja sähkökemiallisia reaktioita, joissa puolireaktiot erotetaan toisistaan (kuva 2), jotta virta voi kulkea ulkoisen johtimen läpi. Kuvan vasemmalla puolella olevaa dekantterilasia kutsutaan puolikennoksi, ja se sisältää 1 M kupari(II)nitraattiliuosta, johon kuparimetallipala on osittain upotettu. Kuparimetalli on elektrodi. Kupari hapettuu, joten kuparielektrodi on anodi. Anodi on kytketty johdolla jännitemittariin ja jännitemittarin toinen pää on kytketty johdolla hopeaelektrodiin. Hopea pelkistyy, joten hopeaelektrodi on katodi. Kuvan oikealla puolella oleva puolikenno koostuu hopeaelektrodista 1 M:n hopeanitraattiliuoksessa (AgNO3). Tässä vaiheessa virtaa ei kulje – eli elektronit eivät liiku merkittävästi johtimen läpi, koska virtapiiri on avoin. Piiri suljetaan suolasillalla, joka siirtää virtaa liikkuvien ionien avulla. Suolasilta koostuu väkevästä, ei-reaktiivisesta elektrolyyttiliuoksesta, kuten tässä esimerkissä käytetystä natriumnitraattiliuoksesta (NaNO3). Kun elektronit virtaavat vasemmalta oikealle elektrodin ja johtimen läpi, nitraatti-ionit (anionit) kulkevat vasemmalla olevan huokoisen tulpan läpi kupari(II)nitraattiliuokseen. Tämä pitää vasemmalla olevan dekantterilasin sähköisesti neutraalina neutraloimalla kupari(II)ionien varauksen, joka syntyy liuoksessa kuparimetallin hapettuessa. Samalla kun nitraatti-ionit liikkuvat vasemmalle, natriumionit (kationit) liikkuvat oikealle, huokoisen tulpan läpi ja oikealla olevaan hopeanitraattiliuokseen. Nämä lisätyt kationit ”korvaavat” hopeaionit, jotka poistuvat liuoksesta sen pelkistyessä hopeametalliksi, jolloin oikeanpuoleinen dekantterilasi pysyy sähköisesti neutraalina. Ilman suolasiltaa lokerot eivät pysyisi sähköisesti neutraaleina, eikä merkittävä virta kulkisi. Jos nämä kaksi osastoa ovat kuitenkin suorassa kosketuksessa toisiinsa, suolasiltaa ei tarvita. Kun virtapiiri on valmis, jännitemittari näyttää +0,46 V, jota kutsutaan solupotentiaaliksi. Kennopotentiaali syntyy, kun kaksi erilaista metallia liitetään toisiinsa, ja se mittaa hapettumis-pelkistymisreaktiosta saatavaa energiaa varausyksikköä kohti. Voltti on sähköpotentiaalin johdettu SI-yksikkö
Tässä yhtälössä A on virta ampeereina ja C varaus coulombeina. Huomaa, että voltit on kerrottava varauksella coulombeina (C), jotta saadaan energia jouleina (J).
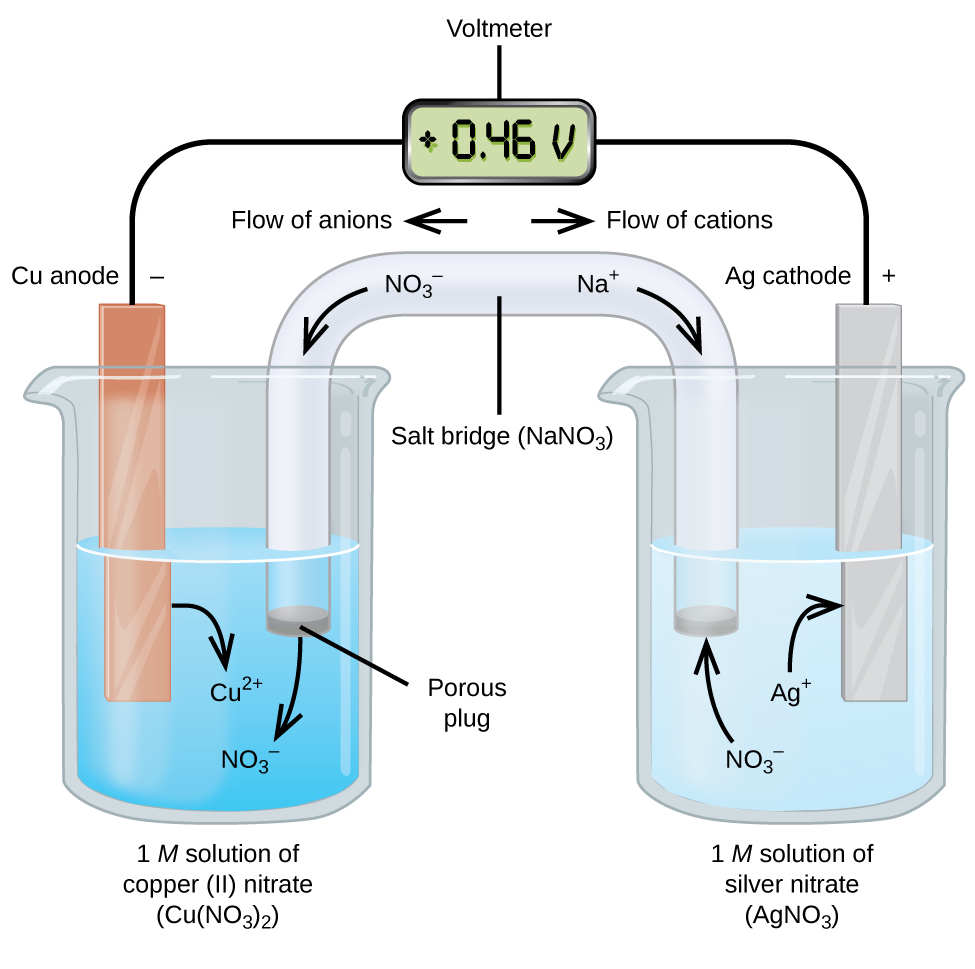
Kun sähkökemiallinen kenno on rakennettu tällä tavoin, positiivinen kennopotentiaali osoittaa, että kyseessä on spontaani reaktio ja että elektronit virtaavat vasemmalta oikealle. Kuvassa 2 tapahtuu paljon, joten on hyödyllistä tiivistää asiat tämän systeemin osalta:
- Elektronit virtaavat anodilta katodille: vasemmalta oikealle kuvan tavallisessa galvaanisessa kennossa.
- Vasemmanpuoleisen puolikennon elektrodi on anodi, koska täällä tapahtuu hapettumista. Nimi viittaa suolasillassa olevien anionien virtaukseen sitä kohti.
- Oikealla puolikennossa oleva elektrodi on katodi, koska täällä tapahtuu pelkistyminen. Nimi viittaa kationien virtaukseen suolasillassa sitä kohti.
- Oksidaatio tapahtuu anodilla (kuvassa vasen puolikenno).
- Reduktio tapahtuu katodilla (kuvassa oikea puolikenno).
- Kennon potentiaali, +0.46 V, johtuu tässä tapauksessa kahden puolikennon valmistuksessa käytettyjen materiaalien luonne-eroista.
- Suolasillan on oltava läsnä sulkeakseen (täydentääkseen) virtapiirin, ja sekä hapettumisen että pelkistymisen on tapahduttava, jotta virta kulkisi.
Mahdollisia galvaanisia kennoja on monia, joten niiden kuvaamiseen käytetään yleensä lyhennettyä merkintätapaa. Solumerkintä (jota joskus kutsutaan solukaavioksi) antaa tietoa reaktioon osallistuvista eri lajeista. Tämä merkintätapa toimii myös muuntyyppisille kennoille. Pystyviiva, │, tarkoittaa faasirajaa ja kaksoisviiva, ‖, suolasiltaa. Vasemmalle kirjoitetaan anodia koskevat tiedot, sitten anodiliuos, sitten suolasilta (jos sellainen on), sitten katodiliuos ja lopuksi oikealle katodia koskevat tiedot. Kuvan 2 galvaanisen kennon kennomerkintä on siis
Huomaa, että spektaattori-ioneja ei ole otettu mukaan ja että kunkin puolireaktion yksinkertaisinta muotoa on käytetty. Kun eri ionien alkupitoisuudet ovat tiedossa, ne ovat yleensä mukana.
Yksi yksinkertaisimmista kennoista on Daniellin kenno. Tämä paristo voidaan rakentaa asettamalla kuparielektrodi purkin pohjalle ja peittämällä metalli kuparisulfaattiliuoksella. Kuparisulfaattiliuoksen päälle kellutetaan sinkkisulfaattiliuosta; sitten sinkkielektrodi asetetaan sinkkisulfaattiliuokseen. Kun kuparielektrodi yhdistetään sinkkielektrodiin, sähkövirta pääsee kulkemaan. Tämä on esimerkki kennosta, jossa ei ole suolasiltaa, ja ionit voivat virrata kahden liuoksen välisen rajapinnan yli.
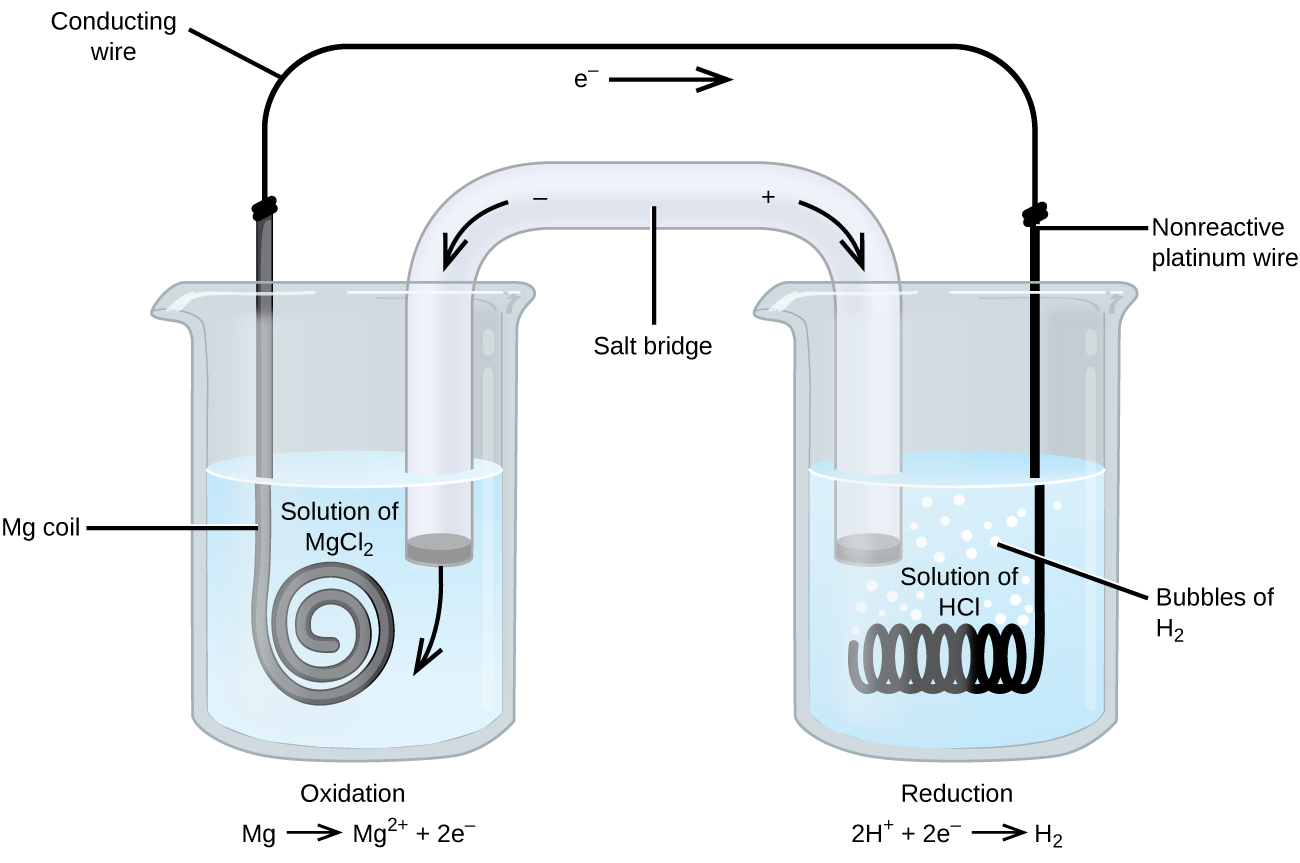
Joihinkin hapettumis-pelkistymisreaktioihin osallistuu lajeja, jotka johtavat huonosti sähköä, ja siksi käytetään elektrodia, joka ei osallistu reaktioihin. Usein elektrodi on platinaa, kultaa tai grafiittia, jotka kaikki ovat inerttejä monille kemiallisille reaktioille. Yksi tällainen järjestelmä on esitetty kuvassa 3. Magnesium hapettuu kuvassa vasemmalla olevalla anodilla ja vetyionit pelkistyvät oikealla olevalla katodilla. Reaktio voidaan tiivistää seuraavasti
Kennossa käytettiin katodina inerttiä platinalankaa, joten kennon merkintä on
Magnesiumelektrodi on aktiivinen elektrodi, koska se osallistuu hapetus-pelkistysreaktioon. Inertit elektrodit, kuten kuvan 3 platinaelektrodi, eivät osallistu hapettumis-pelkistymisreaktioon, ja ne ovat läsnä, jotta virta voi kulkea kennon läpi. Platina tai kulta ovat yleensä hyviä inerttejä elektrodeja, koska ne eivät reagoi kemiallisesti.
Esimerkki 1
Kennon merkintätavan käyttäminen
Tarkastellaan galvaanista kennoa, joka koostuu
Kirjoita hapettumis- ja pelkistymispuolireaktiot ja kirjoita reaktio käyttäen solumerkintää. Mikä reaktio tapahtuu anodilla? Katodilla?
Liuos
Tarkastelun perusteella Cr hapettuu, kun se menettää kolme elektronia muodostaen Cr3+, ja Cu2+ pelkistyy, kun se saa kaksi elektronia muodostaen Cu:n. Tasapainottamalla varaukset saadaan
Kennomerkinnöissä käytetään yksinkertaisinta muotoa kustakin yhtälöstä, ja ne alkavat reaktiosta anodilla. Mitään konsentraatioita ei siis määritetty: \text{Cr}(s){\mid}\text{Cr}^{3+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s). Hapettuminen tapahtuu anodilla ja pelkistyminen katodilla.
Kennon merkintätapojen käyttäminen
Tarkastellaan galvaanista kennoa, joka koostuu
Kirjoita hapettumis- ja pelkistymispuolireaktiot ja kirjoita reaktio käyttäen solumerkintää. Mikä reaktio tapahtuu anodilla? Katodilla?
Liuos
Tarkastelun perusteella Fe2+ hapettuu, kun se menettää yhden elektronin muodostaen Fe3+, ja MnO4- pelkistyy, kun se saa viisi elektronia muodostaen Mn2+. Tasapainottamalla varaus saadaan
Kennomerkinnöissä käytetään kunkin yhtälön yksinkertaisinta muotoa ja aloitetaan reaktio anodilla. On välttämätöntä käyttää inerttiä elektrodia, kuten platinaa, koska siinä ei ole metallia, joka johtaisi elektroneja anodilta katodille. Mitään konsentraatioita ei määritetty niin: \text{Pt}(s){\mid}\text{Fe}^{2+}(aq)\text{,}\;\text{Fe}^{3+}(aq){\parallel}\text{MnO}_4^{\;\;-}(aq)\text{,}\;\text{H}^{+}(aq)\text{,}\;\text{Mn}^{2+}(aq){\mid}\text{Pt}(s). Hapettuminen tapahtuu anodilla ja pelkistyminen katodilla.
Tarkista oppimisesi
Käytä solumerkintöjä kuvaamaan galvaaninen kenno, jossa kupari(II)-ionit pelkistyvät kuparimetalliksi ja sinkkimetalli hapettuu sinkki-ioneiksi.
Vastaus:
Tehtävässä annettujen tietojen perusteella:
\begin{array}{lr @{{}\longrightarrow{}} l}} \text{anode\;(hapetus):} & \text{Zn}(s) & \text{Zn}^{2+}(aq)\;+\;2\text{e}^{-} \\ \ \text{katodi\;(pelkistys):} & \text{Cu}^{2+}(aq)\;+\;2\text{e}^{-} & \text{Cu}(s) \\ \ \hline \\\ \text{overall:} & \text{Zn}(s)\;+\;\text{Cu}^{2+}(aq) & \text{Zn}^{2+}(aq)\;+\;\text{Cu}(s) \end{array}
Käyttämällä solunotaatiota:
\text{Zn}(s){\mid}\text{Zn}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s).
Elektrokemialliset kennot koostuvat tyypillisesti kahdesta puolikennosta. Puolikennot erottavat hapettumis- ja pelkistymispuolireaktion toisistaan ja mahdollistavat virran kulun ulkoisen johtimen läpi. Toinen puolikenno, joka on yleensä kuvassa vasemmalla puolella, sisältää anodin. Hapettuminen tapahtuu anodilla. Anodi on kytketty katodiin toisessa puolikammiossa, joka usein esitetään kuvassa oikealla puolella. Katodilla tapahtuu pelkistyminen. Suolasillan lisääminen täydentää virtapiirin, jolloin virta pääsee kulkemaan. Suolasillassa olevat anionit virtaavat anodia kohti ja suolasillassa olevat kationit katodia kohti. Näiden ionien liike sulkee virtapiirin ja pitää kummankin puolikennon sähköisesti neutraalina. Sähkökemialliset kennot voidaan kuvata käyttämällä kennomerkintää. Tässä merkintätavassa anodilla tapahtuvaa reaktiota koskevat tiedot näkyvät vasemmalla puolella ja katodilla tapahtuvaa reaktiota koskevat tiedot oikealla puolella. Suolasilta esitetään kaksoisviivalla ‖. Kiinteät, nestemäiset tai vesifaasit puolikennon sisällä erotetaan toisistaan yhdellä viivalla, │. Eri lajien vaihe ja konsentraatio on merkitty lajin nimen jälkeen. Hapetus-pelkistysreaktioon osallistuvia elektrodeja kutsutaan aktiivielektrodeiksi. Elektrodeja, jotka eivät osallistu hapettumis-pelkistymisreaktioon, mutta joiden tehtävänä on sallia virran kulku, kutsutaan inerteiksi elektrodeiksi. Inertit elektrodit valmistetaan usein platinasta tai kullasta, jotka eivät muutu monissa kemiallisissa reaktioissa.
Kemia Luvun lopun harjoitukset
- Kirjoita seuraavat tasapainoreaktiot käyttäen solumerkintää. Käytä tarvittaessa platinaa inertiksi elektrodiksi.
(a) \text{Mg}(s)\;+\;\text{Ni}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Ni}(s)
(b) 2\text{Ag}^{+}(aq)\;+\;\text{Cu}(s)\;{\longrightarrow}\;\text{Cu}^{2+}(aq)\;+\;2\text{Ag}(s)
(c) \text{Mn}(s)\;+\;\text{Sn(NO}_3)_2(aq)\;{\longrightarrow}\;\text{Mn(NO}_3)_2(aq)\;+\;\text{Au}(s)
(d) 3\text{CuNO}_3(aq)\;+\;\text{Au(NO}_3)_3(aq)\;{\longrightarrow}\;3\text{Cu(NO}_3)_2(aq)\;+\;\text{Au}(s)
- Määritä seuraavien solumerkintöjen avulla hapettuneet lajit, pelkistyneet lajit sekä hapettava aine ja pelkistävä aine kirjoittamatta tasapainoreaktioita.
(a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Cu}^{2+}(aq){\mid}\text{Cu}(s)
(b) \text{Ni}(s){\mid}\text{Ni}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s)
- Edellisen tehtävän solumerkintöjä varten, kirjoita vastaavat tasapainoreaktiot.
- Tasapainota seuraavat reaktiot ja kirjoita reaktiot käyttäen solumerkintöjä. Jätä huomiotta inertit elektrodit, sillä ne eivät koskaan ole osa puolireaktioita.
(a) \text{Al}(s)\;+\;\text{Zr}^{4+}(aq)\;{\longrightarrow}\;\text{Al}^{3+}(aq)\;+\;\text{Zr}(s)
(b) \text{Ag}^{+}(aq)\;+\;\text{NO}(g)\;{\longrightarrow}\;\text{Ag}(s)\;+\;\text{NO}_3^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(acidic\;solution)}
(c) \text{SiO}_3^{\;\;2-}(aq)\;+\;\text{Mg}(s)\;{\longrightarrow}\;\text{Si}(s)\;+\;\text{Mg(OH)}_2(s)\;\;\;\;\;\;\;\text{(basic\;solution)}
(d) \text{ClO}_3^{\;\;-}(aq)\;+\;\text{MnO}_2(s)\;{\longrightarrow}\;\text{Cl}^{\;\;-}(aq)\;+\;\text{MnO}_4^{\;\;-}(aq)\;\;\;\;\;\;\;\text{(emäksinen\;liuos)}
- Tunnista hapettunut laji, pelkistynyt laji sekä hapettava aine ja pelkistävä aine kaikista edellisen tehtävän reaktioista.
- Käytä annettujen tietojen perusteella kennomerkintää kuvaamaan seuraavat systeemit:
(a) Yhdessä puolikennossa Pt(NO3)2 -liuos muodostaa Pt-metallia, kun taas toisessa puolikennossa Cu-metalli menee Cu(NO3)2 -liuokseen, jossa kaikkien liuottimien konsentraatiot ovat 1 M.
(b) Katodina on kultaelektrodi 0,55 M Au(NO3)3 -liuoksessa ja anodina magnesium-elektrodi 0,55 M Au(NO3)3 -liuoksessa.75 M Mg(NO3)2 -liuoksessa.
(c) Toinen puolikenno koostuu hopeaelektrodista 1 M AgNO3-liuoksessa ja toisessa puolikennossa hapetetaan kuparielektrodi 1 M Cu(NO3)2 -liuoksessa.
- Miksi suolasilta on välttämätön kuvassa 2 esitetyn kaltaisissa galvaanisissa kennoissa?
- Aktiivisen (metalli-) elektrodin havaittiin menettävän massaa, kun hapettumis-pelkistymisreaktio päästetään etenemään. Oliko elektrodi osa anodia vai katodia? Selitä.
- Aktiiviset elektrodit osallistuvat hapetus-pelkistysreaktioon. Koska metallit muodostavat kationeja, elektrodi menettäisi massaa, jos elektrodissa olevat metalliatomit hapettuisivat ja menisivät liuokseen. Hapettuminen tapahtuu anodilla.
- Kolmen eri galvaanisesta kennosta peräisin olevan metallielektrodin massa määritettiin ennen ja jälkeen sen, kun kussakin kennossa hapettumis-pelkistymisreaktion tuottaman virran annettiin kulkea muutaman minuutin ajan. Ensimmäisen metallielektrodin, jolle annettiin merkintä A, massan todettiin kasvaneen; toisen metallielektrodin, jolle annettiin merkintä B, massa ei muuttunut; ja kolmannen metallielektrodin, jolle annettiin merkintä C, massan todettiin vähentyneen. Tee valistunut arvaus siitä, mitkä elektrodit olivat aktiivisia ja mitkä inerttejä elektrodeja ja mitkä olivat anodi(t) ja mitkä katodi(t).
Sanasto
aktiivinen elektrodi elektrodi, joka osallistuu sähkökemiallisen kennon hapettumis-pelkistymisreaktioon; aktiivisen elektrodin massa muuttuu hapettumis-pelkistymisreaktion aikana anodielektrodi sähkökemiallisen kennon elektrodi, jossa tapahtuu hapettumista; anodia koskevat tiedot merkitään suolasillan vasemmalle puolelle kennon merkintätavalla katodielektrodi sähkökemiallisessa kennossa, jossa tapahtuu pelkistyminen; katodia koskevat tiedot merkitään suolasillan oikealle puolelle kennon merkintätavalla kennon merkintätavalla kennon merkintätapa lyhennetty tapa esittää reaktiot sähkökemiallisessa kennossa kennopotentiaaliero sähköpotentiaalin ero, joka syntyy, kun erilaiset metallit liitetään toisiinsa; varauksen (virran) kulkua ohjaava voima hapettumis-pelkistymisreaktioissa galvaaninen kenno sähkökemiallinen kenno, jossa tapahtuu spontaani hapettumis-pelkistymisreaktio; sähkökemialliset kennot, joiden kennopotentiaali on positiivinen; kutsutaan myös volttikennoksi inertti elektrodi elektrodi, joka sallii virran kulkemisen mutta joka ei muuten osallistu hapettumis-pelkistymisreaktioon sähkökemiallisessa kennossa; inertin elektrodin massa ei muutu hapettumis-pelkistymisreaktion aikana; inerttielektrodit valmistetaan usein platinasta tai kullasta, koska nämä metallit eivät reagoi kemiallisesti. volttikenno toinen nimi galvaaniselle kennolle
Ratkaisut
Vastaukset kemian luvun lopun harjoituksiin
1. (a) \text{Mg}(s){\mid}\text{Mg}^{2+}(aq){\parallel}\text{Ni}^{2+}(aq){\mid}\text{Ni}(s); (b) \text{Cu}(s){\mid}\text{Cu}^{2+}(aq){\parallel}\text{Ag}^{+}(aq){\mid}\text{Ag}(s); (c) \text{Mn}(s){\mid}\text{Mn}^{2+}(aq){\parallel}\text{Sn}^{2+}(aq){\mid}\text{Sn}(s); (d) \text{Pt}(s){\mid}\text{Cu}^{+}(aq)\text{,\;Cu}^{2+}(aq){\parallel}\text{Au}^{3+}(aq){\mid}\text{Au}(s)
3. (a) \text{Mg}(s)\;+\;\text{Cu}^{2+}(aq)\;{\longrightarrow}\;\text{Mg}^{2+}(aq)\;+\;\text{Cu}(s); (b) 2\text{Ag}^{+}(aq)\;+\;\text{Ni}(s)\;{\longrightarrow}\;\text{Ni}^{2+}(aq)\;+\;2\text{Ag}(s)
5. Hapettunut laji = pelkistävä aine: (a) Al(s); (b) NO(g); (c) Mg(s); ja (d) MnO2(s); Pelkistyneet lajit = hapettava aine: (a) Zr4+(aq); (b) Ag+(aq); (c) \text{SiO}_3^{\\;\;2-}(aq); ja (d) \text{ClO}_3^{\;\;-}(aq)
7. Ilman suolasiltaa virtapiiri olisi auki (tai katkennut) eikä virta voisi kulkea. Suolasillan avulla jokainen puolikenno pysyy sähköisesti neutraalina ja virta voi kulkea piirin läpi.
9. Aktiivisen (metalli)elektrodin havaittiin saavan massaa, kun hapetus-pelkistysreaktion annettiin edetä. Oliko elektrodi osa anodia vai katodia? Selitä.