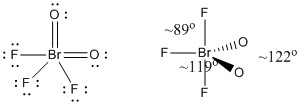Epäorgaanisen kemian keskikurssi
Rhode Islandin yliopisto
Syksy 2013
Tentti 1
1. Kirjoita elektronikonfiguraatio (käyttäen harvinaisten kaasujen merkintätapaa suljetuille kuorille) ja perustilan termisymboli seuraaville: a) Sc; b) Sc+; c) Sc2+; d) Sc3+; e) Sc-.
a) Sc
4s23d1
Termisymboliin vaikuttaa vain 3d-elektroni: L = 2 ja S = ½ antaen 2D
b) Sc+
3d2
L = 3 ja S = 1 antaen 3F
c) Sc2+
3d1
L = 2 ja S = ½ antaen 2D
d) Sc3+
L = 0 ja S = 0 antaen 1S
d) Sc-
4s23d2
L = 3 ja S = 1 antaen 3F
2. Kirjoita Lewisin pisterakenne, anna kaikkien atomien muodolliset varaukset, ennusta molekyyligeometria, arvio kaikista sidoskulmista ja anna todennäköinen hybridiorbitaali seuraaville: a) BrO2-; b) BrO3-; c) BrO2F3.
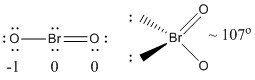
a) BrO2-
Lewisin rakenne:
Formaaliset varaukset on annettu Lewis-rakenteessa
Rakenne: taivutettu tasomainen, sidoskulma ~107°
Hybridiorbitaali Br:llä: sp3
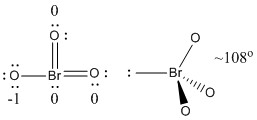
b) BrO3-
Lewis-rakenne:
Formal charges are given on the Lewis Structure
Structure: Pyramidal with bond angles O-Br-O ~108°
Hybrid orbital on Br: sp3
c) BrO2F3
Lewis Structure:
Formal charges are given on the Lewis Structure
Structure: trigonal bipyramidal with bond angles shown in the figure
Hybrid orbital on Br: dsp3
3. Atomin absoluuttinen kovuus määritellään seuraavasti: η = ½(IP – EA), IP on ionisoitumispotentiaali ja EA on elektronien affiniteetti. Ennusta η:n jaksolliset suuntaukset ja perustele ennustuksesi.
Lähes kaikille atomeille IP >> EA, joten η noudattaa IP:n jaksollisia trendejä: kasvaa, kun siirrytään jaksollisessa järjestelmässä oikealle (Z*:n perässä), ja pienenee hieman, kun siirrytään jaksollisessa järjestelmässä alaspäin atomin säteen kasvaessa.
4. Cr2:n elektronikonfiguraatio on σ2π4δ4δ*2. Mikä on sidosjärjestys ja kuinka monta parittamatonta spiniä ennustetaan? Odottaisitko Cr2:n absorboivan valoa spektrin näkyvällä alueella? Miksi vai miksi ei?
Sidosjärjestys = ½(2 + 4 + 4 – 2) = 4, jossa on 2 parittamatonta spiniä (koska δ-orbitaaleja on 2, täytyy olla myös 2 δ*-orbitaalia, joilla kullakin on Hundin sääntöjen perusteella yksi elektroni). D-orbitaalien päällekkäisyys vierekkäin δ-orbitaalien muodostamiseksi on huono, joten δ- ja δ*-orbitaalien välinen jakautuminen on pieni. Tämä viittaa siihen, että elektronin siirtämiseen HOMOsta LUMOon tarvittava energia on myös pieni, mikä ennustaa absorptiota spektrin näkyvässä osassa.