ATP, NAD JA FAD
ATP
Solut käyttävät energianlähteenä molekyyliä nimeltä adenosiinitrifosfaatti (eli ATP) (ks. kuva 2). Tämän molekyylin fosfaatit voivat toimittaa energiaa solujemme substraateille. Soluissamme on entsyymejä, jotka voivat poistaa fosfaatin ATP:stä ja liittää sen toiseen molekyyliin – yleensä proteiiniin (ks. kuva 3). Kun näin tapahtuu, sanomme, että proteiini on fosforyloitu. Ajattele, että kolmas fosfaatti on pieni energiasäkki. Kun se siirretään proteiiniin, tämä energia voidaan käyttää johonkin. Esimerkiksi kuvassa 3 proteiini muuttaa muotoaan, kun se fosforyloituu. Kun proteiinit muuttavat muotoaan, kutsumme tätä usein proteiinirakenteen konformaatiomuutokseksi. Kehossa on monia proteiineja, jotka käyttävät ATP:n fosfaattia konformaatiomuutoksen aikaansaamiseksi. Tämä proteiinin muodonmuutos mahdollistaa viime kädessä esimerkiksi lihasten supistumisen, solujen liikkuvuuden, kalvojen kuljetuksen ja entsyymien toiminnan. Solut ja elämä ovat olemassa vain, jos ATP:tä on saatavilla jatkuvasti ja tasaisesti.
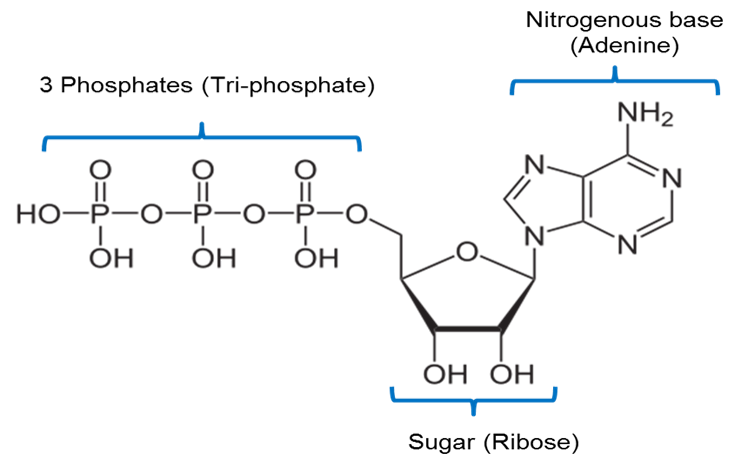
Kuvan on luonut JS at BYU Idaho F2013.
Yllä oleva kuva esittää ATP:n kemiallista rakennetta. ATP sisältää adeniiniksi kutsutun typpiperustan, joka on yhdistetty riboosiksi kutsuttuun 5-hiilisokeriin ja kolmeen fosfaattiryhmään.
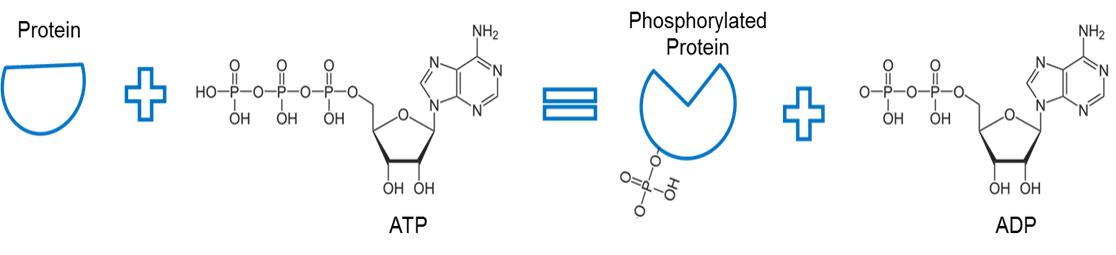
Kuvan on luonut JS at BYU Idaho F2013.
ATP:tä käytetään proteiinin fosforylointiin. Kinaasiksi kutsuttu entsyymi (ei kuvassa) irrottaa fosfaatin ATP:stä ja helpottaa fosfaatin ja jonkin toisen proteiinin välistä sidosta. Fosfaatin sitoutumista proteiiniin tällä tavoin kutsutaan fosforylaatioksi. Fosfaattiluussa proteiinin kanssa on korkeampi energia. Huomaa, että fosforylaatio käyttää tätä energiaa aiheuttaakseen proteiinin muodon konformaatiomuutoksen.
NAD ja FAD
Nikotiiniamidiadeniinidinukleotidi (NAD) ja flaviiniadeniinidinukleotidi (FAD) ovat koentsyymejä, jotka osallistuvat reversiibeleihin hapettumis- ja pelkistysreaktioihin. Usein sanotaan, että nämä yhdisteet ovat elektroninkuljettajia, koska ne ottavat elektroneja vastaan (pelkistyvät) orgaanisten molekyylien, kuten hiilihydraattien ja lipidien, hajoamisessa tapahtuvien katabolisten vaiheiden aikana. Sitten nämä pelkistyneet koentsyymit voivat luovuttaa nämä elektronit johonkin muuhun biokemialliseen reaktioon, joka normaalisti osallistuu anaboliseen prosessiin (kuten ATP:n synteesiin).
NAD+ / NADH
Nikotiiniamidiadeniinidinukleotidia kutsutaan hapettuneessa olomuodossaan NAD+:ksi, pelkistymisen (tai elektronien vastaanottamisen) jälkeen sitä kutsutaan NADH:ksi. Katso kuva 4 molekyylikuvasta. Niasiini-vitamiinia (jota kutsutaan myös B3:ksi) käytetään tämän yhdisteen tuottamiseen. Niasiini tarjoaa orgaanisen rengasrakenteen, joka osallistuu suoraan vetyatomin ja kahden elektronin siirtoon. NAD+ esiintyy usein yhdessä ”dehydrogenaasi”-entsyymin kanssa. Dehydrogenaasireaktio poistaa kaksi vetyatomia; toinen hydridinä (:H-) (hydridi on vetyatomi, jolla on 2 elektronia) ja toinen vetykationina (H+) (ja tietysti vetykationilla ei ole elektroneja). Hydridi sitoutuu NAD+:n kanssa ja muodostaa pelkistyneen Nictinamide Adenine Dinucleotide (NADH) -yhdisteen. Toinen vetyatomi (H+) vapautuu liuokseen, ks. kuva 4.
Katsoessasi aineenvaihdunnan reaktioita etsi reaktioita, joissa syntyy NADH. NADH on tärkeä, koska se toimittaa keräämänsä vedyt ja elektronit biokemiallisiin prosesseihin, jotka voivat käyttää elektroneja ja vetyjä ATP:n valmistamiseen.
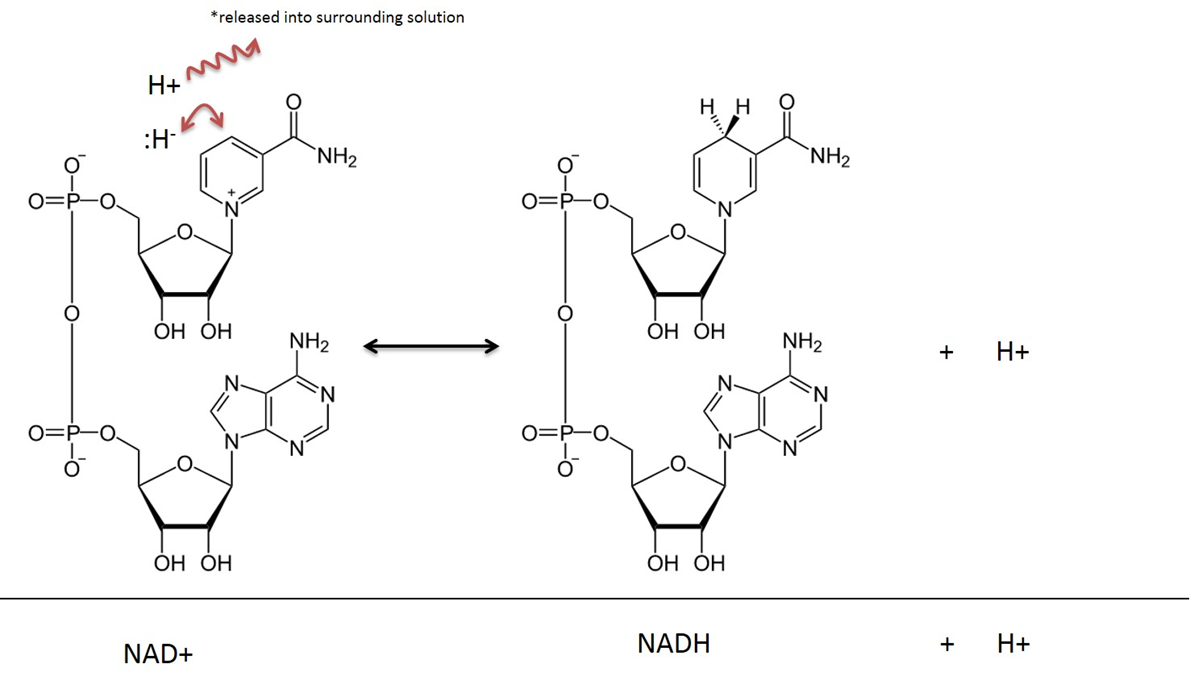
Kuvan on luonut JS at BYU Idaho F2013.
Aineenvaihduntareaktioissa, joissa on mukana NAD, substraatista irtoaa kaksi vetyatomia ja kaksi elektronia, jotka siirretään NAD+:lle. NAD+ ottaa vastaan hydridi-ionin (vety, jolla on 2 elektronia) ja muuttuu pelkistyneessä muodossa olevaksi nikotiiniamidiadeniinidinukleotidiksi (NADH). Vetykationi, joka myös otetaan reaktiossa kiinni, vapautuu ympäröivään liuokseen. Muista, että tämä reaktio on palautuva.
Aineenvaihdunnassa tapahtuvien reaktioiden selittämisessä on tavallista jättää huomiotta liuokseen vapautuva H+, ja tässä tekstissä NAD:n pelkistymisen lopputulos kuvataan pelkkänä NADH:na eikä NADH + H+:na.
FAD / FADH2
Hapettuneessa olomuodossaan olevaa flaviini-adeniinidinukleotidia kutsutaan FAD:ksi. Pelkistyneenä sitä kutsutaan FADH2:ksi. Katso molekyylikuvio kuvasta 5. Tämän yhdisteen valmistukseen käytetään riboflaviini- eli B2-vitamiinia. Riboflaviini tarjoaa rengasrakenteet, jotka osallistuvat suoraan kahden vetyatomin (joilla kummallakin on tällä kertaa yksi elektroni) siirtoon. NAD:n tavoin FAD toimii yhdessä ”dehydrogenaasi”-entsyymin kanssa. Reaktio poistaa kaksi vetyatomia; kumpikin protonin ja yhden elektronin. Molemmat vetyatomit sitoutuvat FAD:n kanssa. Tämä reaktio ei vapauta H+:aa liuokseen, kuten NAD:n pelkistyminen tekee.
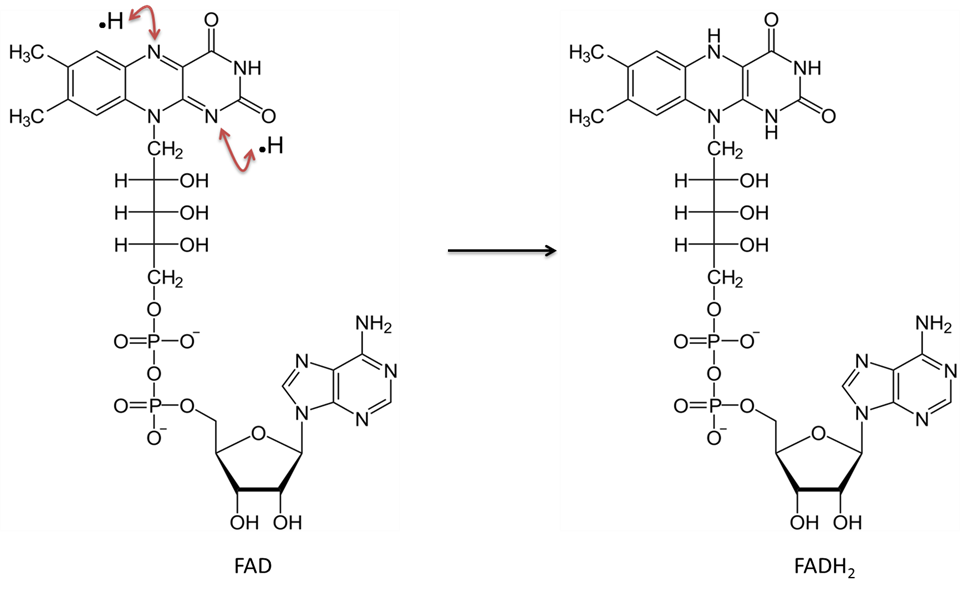
Kuvan on luonut JS at BYU Idaho F2013.
Flaviiniadeniinidinukleotidi hapettuneessa olomuodossaan (FAD) ottaa vastaan kaksi vetyatomia (kummallakin on yksi elektroni) ja muuttuu FADH2:ksi.
Katsoessasi aineenvaihdunnan reaktioita etsi reaktio, jossa syntyy FADH2. NADH:n tavoin FADH2 on tärkeä, koska se toimittaa vetyjä ja elektroneja biokemiallisiin prosesseihin, jotka voivat käyttää elektroneja ja vetyjä ATP:n valmistukseen.
**Voit käyttää alla olevia painikkeita siirtyäksesi tämän moduulin seuraavaan tai edelliseen lukukertaan**

