Geneerinen nimi: naftifiinihydrokloridi
annosmuoto: geeli
Lääketieteellisesti tarkistanut Drugs.com. Päivitetty viimeksi 1. huhtikuuta 2020.
- Yleiskatsaus
- Haittavaikutukset
- Adostus
- Erikoislääke
- Raskaus
- Lisätietoja
- Indikaatiot ja Naftin geelin käyttö
- Naftin Geeli Annostus ja antotapa
- Asennusmuodot ja vahvuudet
- Vasta-aiheet
- Varoitukset ja varotoimet
- Lokaaliset haittavaikutukset
- Haittavaikutukset
- Kliinisistä tutkimuksista saadut kokemukset
- Kokemukset markkinoille tulon jälkeen
- KÄYTTÖ ERITYISRYHMISSÄ
- Raskausaika
- Laktointi
- Pediatrinen käyttö
- Geriatrinen käyttö
- NAFTIN-geelin kuvaus
- Naftin-geeli – Kliininen farmakologia
- Toimintamekanismi
- Farmakodynamiikka
- Farmakokinetiikka
- Mikrobiologia
- Monikliininen toksikologia
- Syöpäsairauksien synnynnäinen vaurioituminen, mutageenisuus, Impairment of Fertility
- Kliiniset tutkimukset
- Varastointitapa/varastointi ja käsittely
- Potilaan neuvontaan liittyvät tiedot
- ESIMERKKIPANEELI – 45 g:n tuubipakkaus
- ESIMERKKIPANEELI – 60 g:n tuubipakkaus
- Lisätietoa Naftinista (naftifiini paikallisesti)
- Kuluttajan resurssit
- Ammattilaislähteet
- Muut valmisteet
- Seuraavat hoito-ohjeet
Indikaatiot ja Naftin geelin käyttö
NAFTIN ® -geeli on allyyliamiinisienilääke, joka on tarkoitettu Trichophyton rubrum -organismien aiheuttaman interdigitaalisen tinea pediksen hoitoon, Trichophyton mentagrophytes ja Epidermophyton floccosum.
Naftin Geeli Annostus ja antotapa
Levitä ohut kerros NAFTIN ® -geeliä kerran vuorokaudessa sairastuneille alueille sekä noin ½ tuuman marginaali tervettä ympäröivää ihoa 2 viikon ajan.
Vain paikalliseen käyttöön. NAFTIN ® -geeliä ei ole tarkoitettu silmäkäyttöön, suun kautta tai intravaginaaliseen käyttöön.
Asennusmuodot ja vahvuudet
Gel, 2 %. Jokainen gramma sisältää 20 mg naftifiinihydrokloridia värittömässä tai keltaisessa geelissä.
Vasta-aiheet
Ei ole.
Varoitukset ja varotoimet
Lokaaliset haittavaikutukset
Jos NAFTIN ® -geelin käytön yhteydessä kehittyy ärsytystä tai herkkyysoireita, hoito on lopetettava.
Haittavaikutukset
Kliinisistä tutkimuksista saadut kokemukset
Koska kliiniset tutkimukset tehdään hyvin erilaisissa olosuhteissa, yhden lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutusten määriä ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin määriin, eivätkä ne välttämättä kuvasta kliinisessä käytännössä havaittuja määriä.
Kahdessa satunnaistetussa, aineella kontrolloidussa tutkimuksessa 1143 koehenkilöä käsiteltiin NAFTIN ® -geelillä, kun taas 571:tä koehenkilöä käsiteltiin aineella. Tutkimushenkilöt olivat 12-92-vuotiaita, pääasiassa miehiä (76 %) ja 59 % valkoihoisia, 38 % mustia tai afroamerikkalaisia ja 23 % latinalaisamerikkalaisia tai latinoja. Koehenkilöt saivat annoksia kerran päivässä paikallisesti 2 viikon ajan peittääkseen sairastuneet ihoalueet sekä ½ tuuman marginaalin ympäröivästä terveestä ihosta. Yleisimmät haittavaikutukset olivat levityskohdan reaktiot, joita esiintyi 2 % Naftin-geelihaarassa ja 1 % ajoneuvohaarassa. Useimmat haittavaikutukset olivat vakavuudeltaan lieviä.
Avoimessa pediatrisessa farmakokinetiikka- ja turvallisuustutkimuksessa 22 12-17-vuotiasta pediatrista koehenkilöä, joilla oli interdigitaalinen tinea pedis, sai NAFTIN ® -geeliä. Haittavaikutusten esiintyvyys pediatrisessa populaatiossa oli samanlainen kuin aikuispopulaatiossa.
Kumulatiivinen ärsytystestaus osoitti, että NAFTIN ® -geeli saattaa aiheuttaa ärsytystä. Ei ollut näyttöä siitä, että NAFTIN ® Gel aiheuttaisi kosketusyliherkistymistä, fototoksisuutta tai fotoallergisuutta terveellä iholla.
Kokemukset markkinoille tulon jälkeen
Koska nämä reaktiot ilmoitetaan vapaaehtoisesti populaatiosta, jonka koosta ei ole varmuutta, niiden esiintymistiheyttä ei ole aina mahdollista arvioida luotettavasti eikä syy-yhteyttä lääkealtistukseen pystytä osoittamaan. Seuraavia haittavaikutuksia on havaittu naftifiinihydrokloridin myyntiluvan myöntämisen jälkeisen käytön aikana: rakkulat, polttava tunne, kuoriutuminen, kuivuminen, eryteema/punoitus, tulehdus, ärsytys, maseroituminen, kipu, pruritus/kutina, ihottuma ja turvotus.
KÄYTTÖ ERITYISRYHMISSÄ
Raskausaika
Riskin yhteenveto
NAFTIN®-geelin käytöstä raskaana oleville naisille ei ole saatavissa tietoja, joiden perusteella voitaisiin arvioida lääkkeeseen liittyvää suurten synnynnäisten epämuodostumien, keskenmenon tai haitallisten äitiys- tai sikiövaikutusten riskiä.
Eläimillä tehdyissä lisääntymistutkimuksissa ei havaittu haitallisia vaikutuksia sikiön kehitykseen oraalisilla annoksilla, jotka annettiin oraalisesti organogeneesin aikana enintään 37-kertaisina suurimpaan suositeltuun ihmisannokseen (MRHD) nähden raskaana oleville rotille, tai ihonalaisilla annoksilla, jotka annettiin organogeneesin aikana enintään 4-kertaisina MRHD-annoksiin nähden raskaana oleville rotille tai 7-kertaisina MRHD-annoksiin nähden raskaana oleville kaniineille ( ks. tiedot).
Kaikissa raskauksissa on synnynnäisten epämuodostumien, menehtymisen tai muiden haitallisten lopputuloksien tausta. Merkittävien synnynnäisten epämuodostumien ja keskenmenon arvioitua taustariskiä ilmoitetussa populaatiossa ei tunneta. Yhdysvaltain yleisväestössä suurten synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Tiedot
Tiedot eläimistä
Systeemisiä alkion ja sikiön kehitystutkimuksia on tehty rotilla ja kaneilla. Eläinannosten ja ihmisannosten vertailua varten MRHD-arvoksi on asetettu 4 g 2-prosenttista geeliä vuorokaudessa (1,33 mg/kg/vrk 60 kg painavalle henkilölle).
Oraalisia annoksia 30, 100 ja 300 mg/kg/vrk naftifiinihydrokloridia annettiin tiineille naaraspuolisille rotille organogeneesin aikana. Hoitoon liittyviä vaikutuksia sikiötoksisuuteen ei havaittu annoksilla 300 mg/kg/vrk asti (37-kertainen MRHD-arvo mg/m 2 -vertailun perusteella). Naftifiinihydrokloridia annettiin ihonalaisina annoksina 10 ja 30 mg/kg/vrk tiineille naarasrotille organogeneesin aikana. Hoitoon liittyviä vaikutuksia sikiötoksisuuteen ei havaittu annoksella 30 mg/kg/vrk (4 kertaa MRHD mg/m 2 -vertailun perusteella). Naftifiinihydrokloridia annettiin 3, 10 ja 30 mg/kg/vrk ihonalaisina annoksina tiineille naaraskaniineille organogeneesin aikana. Hoitoon liittyviä vaikutuksia sikiötoksisuuteen ei havaittu annoksella 30 mg/kg/vrk (7 kertaa MRHD mg/m 2 -vertailuun perustuen).
Rotilla tehtiin peri- ja postnataalista kehitystä koskeva tutkimus. Naftifiinihydrokloridia annettiin suun kautta 30, 100 ja 300 mg/kg/vrk naarasrotille tiineyspäivästä 14 imetyspäivään 21 asti. Naaraiden painonnousu tiineyden aikana ja jälkeläisten painonnousu imetyksen aikana väheni annoksella 300 mg/kg/vrk (37-kertainen MRHD-arvo mg/m 2 -vertailun perusteella). Kehitystoksisuutta ei havaittu annoksella 100 mg/kg/vrk (12 kertaa MRHD mg/m 2 -vertailuun perustuen).
Laktointi
Riskin yhteenveto
Naftifiinihydrokloridin esiintymisestä ihmismaidossa, lääkeaineen vaikutuksista imetettävään lapseen tai lääkeaineen vaikutuksista maidontuotantoon sen jälkeen, kun Naftin-geeliä on levitetty paikallisesti imettäville naisille, ei ole saatavilla tietoa. Ei tiedetä, erittyykö naftifiinihydrokloridi ihmismaitoon. Koska monet lääkkeet erittyvät ihmismaitoon, on noudatettava varovaisuutta, kun naftifiinihydrokloridia annetaan imettävälle naiselle.
Kliinisten tietojen puuttuminen imetyksen aikana estää selkeän määrityksen Naftin Gel -valmisteen riskistä imeväiselle imetyksen aikana. Siksi imetyksen kehitys- ja terveyshyödyt on otettava huomioon yhdessä äidin kliinisen Naftin Gel -tarpeen ja Naftin Gel -valmisteen tai äidin perussairauden mahdollisten haittavaikutusten kanssa, joita Naftin Gel -valmisteesta tai äidin perussairaudesta voi aiheutua imetettävälle lapselle.
Pediatrinen käyttö
Naftin®-geelin turvallisuus ja teho on todettu ikäryhmässä 12-18 vuotta, jossa on interdigitaalinen jalkapohjatulehdus.
NAFTIN®-geelin käyttöä tässä ikäryhmässä tukevat aikuisilla tehdyistä riittävistä ja hyvin kontrolloiduista tutkimuksista saadut todisteet ja lisäksi turvallisuus- ja PK-tiedot avoimesta tutkimuksesta, joka tehtiin 22:lla ≥12-vuotiaalla nuorella, jotka saivat NAFTIN®-geeliä annoksella noin 4 g/vrk .
Turvallisuutta ja tehoa <12-vuotiailla lapsipotilailla ei ole varmistettu.
Geriatrinen käyttö
Kliinisten tutkimusten aikana 99 koehenkilöä (9 %), jotka olivat iältään 65-vuotiaita tai sitä vanhempia, altistettiin NAFTIN ® -geelille. Turvallisuus ja teho olivat samanlaisia kuin nuoremmilla koehenkilöillä.
NAFTIN-geelin kuvaus
NAFTIN ® -geeli on kirkkaasta keltaiseen vaihteleva geeli, joka on tarkoitettu vain paikalliseen käyttöön. Jokainen gramma NAFTIN ® -geeliä sisältää 20 mg naftifiinihydrokloridia, synteettistä allyyliamiini antifungaalista yhdistettä.
Kemiallisesti naftifiinihydrokloridi on (E)-N-kinnamyyli-N-metyyli-N-metyyli-1-naftaleenimetyyliamiinihydrokloridia.
Molekyylikaava on C 21H 21N∙HCl ja molekyylipaino on 323,86.
Naftifiinihydrokloridin rakennekaava on :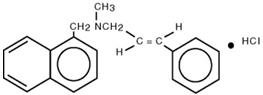
NAFTIN ® -geeli sisältää seuraavia inaktiivisia aineosia: alkoholi, bentsyylialkoholi, edetaattidinatrium, hydroksietyyliselluloosa, puhdistettu vesi, propyleeniglykoli, polysorbaatti 20 ja trolamiini.
Naftin-geeli – Kliininen farmakologia
Toimintamekanismi
NAFTIN ® -geeli on paikallinen sienilääke .
Farmakodynamiikka
Naftin ® -geelin farmakodynamiikkaa ei ole selvitetty .
Farmakokinetiikka
In vitro- ja in vivo -biologista hyötyosuutta koskevat tutkimukset ovat osoittaneet, että naftifiini tunkeutuu sarveiskerrokseen riittävinä pitoisuuksina estämään dermatofyyttien kasvua.
Farmakokineettinen analyysi plasmanäytteistä, jotka otettiin 32:lta tinea pedis -tautia sairastavalta henkilöltä, joita hoidettiin keskimääräisellä 3,9 gramman NAFTIN ® -geeliannoksella, joka annosteltiin kerran vuorokaudessa molempiin jalkoihin 14 vuorokauden ajan, osoitti altistumisen kasvaneen hoitojakson aikana siten, että geometrinen keskiarvo (CV-%:n mukaan jaoteltuna) AUC 0-24 (pinta-ala pitoisuus-pitoisuus-aikakäyrän alapuolella plasman pitoisuus-aikakäyrässä ajasta 0 24 tuntiin välillä 0 – 24 tuntia) oli 1. vuorokautta kohden laskettuna 10,5 (118) mg:aa∙hr/m3, ja että 14. vuorokautta kohden laskettu AUC AUC 0-24 -annos 0-24 -arvojen mukaan laskettuna AUK 0-24 -arvo on ollut 70 (59) mg/hl. AUC:n perusteella laskettu kertymissuhde oli noin 6.
Maksimipitoisuus (C max) kasvoi myös hoitojakson aikana; geometrinen keskiarvo (CV%) C max kerta-annoksen jälkeen oli 0,9 (92) ng/ml päivänä 1; C max päivänä 14 oli 3,7 (64) ng/ml. Mediaani T max oli 20,0 tuntia (vaihteluväli: 8, 20 tuntia) kerta-annoksen jälkeen päivänä 1 ja 8,0 tuntia (vaihteluväli: 0, 24 tuntia) päivänä 14. Plasman läpimittapitoisuudet kasvoivat tutkimusjakson aikana ja saavuttivat vakaan tilan 11 päivän kuluttua. Samassa farmakokineettisessä tutkimuksessa virtsaan hoitojakson aikana erittyneen annoksen osuus oli enintään 0,01 % käytetystä annoksesta.
Toisessa tutkimuksessa NAFTIN ® -geelin farmakokinetiikkaa arvioitiin 22:lla 12-17-vuotiaalla pediatrisella koehenkilöllä, joilla oli tinea pedis. Koehenkilöitä hoidettiin keskimääräisellä 4,1 gramman NAFTIN ® -geeliannoksella, joka levitettiin sairastuneelle alueelle kerran päivässä 14 päivän ajan. Tulokset osoittivat, että systeeminen altistus lisääntyi hoitojakson aikana. Geometrinen keskiarvo (CV%) AUC0-24 oli 15,9 (212) ng∙hr/ml päivänä 1 ja 60,0 (131) ng∙hr/ml päivänä 14. Geometrinen keskiarvo (CV%) Cmax kerta-annoksen jälkeen oli 1,40 (154) ng/ml päivänä 1 ja 3,81 (154) ng/ml päivänä 14. Hoitojakson aikana virtsaan erittyvän annoksen osuus oli enintään 0,003 % annetusta annoksesta.
Mikrobiologia
Aikutusmekanismi
Naftifiini on sienilääke, joka kuuluu allyyliamiiniluokkaan. Vaikka tarkkaa vaikutusmekanismia sieniä vastaan ei tunneta, naftifiinihydrokloridi näyttää häiritsevän sterolien biosynteesiä estämällä skvaleeni 2, 3-epoksidaasientsyymiä. Tämän allylamiinin aiheuttama entsyymiaktiivisuuden esto johtaa sterolien, erityisesti ergosterolin, määrän vähenemiseen ja vastaavasti skvaleenin kertymiseen soluihin.
Resistenssimekanismi
Tähän mennessä naftifiinille resistenssimekanismia ei ole tunnistettu.
Naftifiinin on osoitettu olevan aktiivinen seuraavien sienten useimpia isolaatteja vastaan sekä in vitro että kliinisissä infektioissa, kuten kohdassa INDIKAATIOT JA KÄYTTÖ on kuvattu:
- Trichophyton rubrum
- Trichophyton mentagrophytes
- Epidermophyton floccosum
Monikliininen toksikologia
Syöpäsairauksien synnynnäinen vaurioituminen, mutageenisuus, Impairment of Fertility
Kaksi vuotta kestäneessä ihokarsinogeenisuustutkimuksessa naftifiinihydrokloridivoidetta annettiin Sprague-Dawley-rotille paikallisina annoksina 1 %, 2 % ja 3 % (10, 20 ja 30 mg/kg/vrk naftifiinihydrokloridia). Tässä tutkimuksessa ei havaittu lääkkeeseen liittyviä kasvaimia korkeimpaan tässä tutkimuksessa arvioituun annokseen 30 mg/kg/vrk asti (36 kertaa MRHD AUC-vertailun perusteella).
Naftifiinihydrokloridilla ei havaittu viitteitä mutageenisesta tai klastogeenisesta potentiaalista kahden in vitro -genotoksisuustestin (Amesin testi ja kiinalaisen hamsterin munasarjasolujen kromosomipoikkeavuustesti) ja yhden in vivo -genotoksisuustestin (hiiren luuytimen mikronukleuskoe) tulosten perusteella.
Naftifiinihydrokloridin oraalinen anto rotille parittelun, tiineyden, synnytyksen ja laktaation aikana ei osoittanut vaikutuksia kasvuun, hedelmällisyyteen tai lisääntymiseen annoksilla, jotka olivat enintään 100 mg/kg/vrk (12-kertainen mg/m 2 -vertailuun perustuva MRHD).
Kliiniset tutkimukset
NAFTIN ® -geelin tehoa on arvioitu kahdessa satunnaistetussa, kaksoissokkoutetussa, lääkeaineella kontrolloidussa, monikeskustutkimuksessa, joihin osallistui 1175 koehenkilöä, joilla oli oireinen ja dermatofyyttiviljelypositiivinen interdigitaalinen tinea pedis. Koehenkilöt satunnaistettiin saamaan NAFTIN ® -geeliä tai lääkettä. Koehenkilöt levittivät 2-prosenttista naftifiinihydrokloridigeeliä tai käyttöainetta sairastuneelle jalkaterän alueelle kerran päivässä 2 viikon ajan. Interdigitaalisen tinea pediksen merkit ja oireet (eryteema, kutina ja hilseily) arvioitiin, ja kaliumhydroksiditutkimus (KOH) ja dermatofyyttiviljely suoritettiin 6 viikon kuluttua ensimmäisestä hoidosta.
Tutkimuspopulaation keski-ikä oli 45 vuotta, 77 % oli miehiä, 60 % oli valkoihoisia, 35 % mustia tai afroamerikkalaisia ja 26 % latinalaisamerikkalaisia. Lähtötilanteessa tutkittavilla vahvistettiin interdigitaalisen tinea pediksen merkit ja oireet, positiivinen KOH-tutkimus ja vahvistettu dermatofyyttiviljely. Ensisijainen tehon päätetapahtuma oli niiden koehenkilöiden osuus, joilla oli täydellinen paraneminen 6 viikon kuluttua hoidon aloittamisesta (4 viikkoa viimeisen hoidon jälkeen). Täydellinen paraneminen määriteltiin sekä kliiniseksi paranemiseksi (eryteeman, kutinan ja hilseilyn puuttuminen) että mykologiseksi paranemiseksi (negatiivinen KOH-tutkimus ja dermatofyyttiviljely).
Tehokkuustulokset viikolla 6, neljä viikkoa hoidon päättymisen jälkeen, on esitetty alla olevassa taulukossa 1.
| Koe 1 | Koe 2 | |||
|---|---|---|---|---|
| Lopetuspiste | NAFTIN ® -geeli, 2 % N=382 n (%) |
Valmiste N=179 n (%) |
NAFTIN ® Gel, 2 % N=400 n (%) |
Vehikkeli N=213 n (%) |
| * Täydellinen paraneminen on yhdistetty päätepiste, joka sisältää sekä mykologisen paranemisen että kliinisen paranemisen. Kliininen paraneminen määritellään eryteeman, kutinan ja hilseilyn puuttumisena (aste 0). † Tehokkaalla hoidolla tarkoitetaan negatiivista KOH-valmistetta ja negatiivista dermatofyyttiviljelmää, eryteemaa, hilseilyä ja kutinaa asteikolla 0 tai 1 (puuttuu tai lähes puuttuu). ‡ Mykologinen parantuminen määritellään negatiiviseksi KOH-valmisteeksi ja dermatofyyttiviljelyksi. | ||||
| Täydellinen parannus * | 64 (17%) | 3 (2%) | 104 (26%) | 7 (3%) |
| Hoidon vaikuttavuus † | 207 (54 %) | 11 (6 %) | 203 (51 %) | 15 (7 %) |
| Mykolog. Parantaminen ‡ | 250 (65%) | 25 (14%) | 235 (59%) | 22 (10%) |
Varastointitapa/varastointi ja käsittely
How Supplied
NAFTIN ® Gel on värittömästä keltaiseen vaihteleva geeli, joka toimitetaan kokoontaitettavissa putkiloissa seuraavassa koossa:
45g – NDC 54766-772-45
60g – NDC 54766-772-60
Varastointi
Varastoi NAFTIN ® -geeliä 25°C:ssa (77°F); poikkeamat sallittu 15-30°C:seen (59-86°F) .
Potilaan neuvontaan liittyvät tiedot
- Kerro potilaille, että NAFTIN ® -geeli on tarkoitettu vain paikalliseen käyttöön. NAFTIN ® -geeliä ei ole tarkoitettu silmäkäyttöön, suun kautta tai intravaginaaliseen käyttöön.
- Potilaita on ohjattava ottamaan yhteyttä lääkäriin, jos NAFTIN ® -geelin käytön yhteydessä ilmenee ärsytystä.
Distributed by Sebela Pharmaceuticals Inc.
645 Hembree Parkway, Suite I, Roswell, GA 30076
www.sebelapharma.com
Toll Free 1-844-732-3521
©2020 Sebela Pharmaceuticals Inc. Kaikki oikeudet pidätetään.
ESIMERKKIPANEELI – 45 g:n tuubipakkaus

NDC 54766-772-45
NAFTIN ®
(Naftifiinihydrokloridi) geeli, 2 %
Sebela Pharmaceuticals Inc.
Vain paikalliseen käyttöön
Ei silmäkäyttöön, Oraaliseen tai intravaginaaliseen käyttöön
45g
Vain reseptilääkkeeksi
ESIMERKKIPANEELI – 60 g:n tuubipakkaus

NDC 54766-772-60
NAFTIN®
(Naftifiinihydrokloridi)-geeli, 2 %:n pitoisuuksina
Sebela Pharmaceuticals Inc.
Vain paikalliseen käyttöön
Ei silmäkäyttöön, Oraaliseen tai intravaginaaliseen käyttöön
60g
Rx Only
| NAFTIN naftifiinihydrokloridigeeli |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
| Markkinointitiedot | |||
| Markkinointiluokka | Hakemuksen numero tai monografian viittaus | Markkinoinnin alkamispäivä | Markkinoinnin päättymispäivä |
| NDA | NDA204286 | 03/01/2018 | |
Labeler – Sebela Pharmaceuticals Inc. (079104574)
| Toimipaikka | |||
| Nimi | Asoite | ID/FEI | Toimipaikat |
| DPT Laboratories, Ltd. | 832224526 | valmistus(54766-772), analyysi(54766-772), merkintä(54766-772) | |
Lisätietoa Naftinista (naftifiini paikallisesti)
- Haittavaikutukset
- Raskauden tai imetyksen aikana
- Dositus Tietoa
- Hinnoittelu & Kuponkeja
- En Español
- 3 Arvosteluja
- Generaalinen saatavuus
- Lääkeryhmä:
Kuluttajan resurssit
- Potilastiedot
- Naftin Topical (Advanced Reading)
Ammattilaislähteet
- Reseptitiedot
- Naftifiini (AHFS-monografia)
Muut valmisteet
- Naftin-MP Topical
Seuraavat hoito-ohjeet
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Lääketieteellinen vastuuvapauslauseke