Adaptiivisen immuunivasteen soluvälitteisessä haarassa päähistokompatibiliteettikompleksin (MHC) I- ja II-luokan molekyylit sitovat lyhyitä peptidejä ja ne esitetään solun pinnalla, jossa T-lymfosyyttien antigeenireseptorit tunnistavat ne. Tietyn MHC-peptidikompleksin tunnistavan T-solureseptorin (TCR) sitoutuminen saa naiivit lymfosyytit erilaistumaan efektorisoluiksi (sytotoksisiksi ja auttaja-T-soluiksi), jotka tuhoavat infektoituneita isäntäsoluja tai stimuloivat vasta-aineiden tuotantoa, ja muistisoluiksi, jotka tuottavat suojaavan immuniteetin uudelleeninfektiota vastaan.
MHC-molekyylien rakenne ja toiminta
Kaksi monigeeniperhettä, jotka sijaitsevat MHC-genomialueella, koodaavat antigeeniä sitovia molekyylejä, jotka esittävät vieraita peptidejä solun pinnalla. Todellisuudessa MHC-molekyylit esittävät myös itse tuotettuja peptidejä. Autoreaktiivisten T-solujen negatiivinen kateenkorvan valinta estää kuitenkin MHC-self-peptidikomplekseja aiheuttamasta immuunivastetta. MHC-luokan I molekyylit ilmentyvät useimmissa tuman sisältämissä soluissa, ja niissä on tyypillisesti endogeenisia peptidejä, jotka ovat peräisin solunsisäisistä patogeeneistä, jotka lisääntyvät sytosolissa (esim. virukset). Proteasomi hajottaa sytosoliproteiinit lyhyiksi peptidifragmenteiksi, ja ATP-riippuvaiset kuljettajat TAP1 & 2 kuljettavat ne ensin endoplasmiseen retikulumiin (ER) MHCI-kuormitusta varten ja sen jälkeen solun pinnalle esiteltäviksi kiertäville sytotoksisille CD8+ T-soluille, joiden tehtävänä on indusoida infektoituneen kohdesolun apoptoosi ja lyysi. (Kuviot on mukautettu lähteestä Murphy ym. (2008) Kuviot 3.12, 3.25, 5.5, & 5.11.)
MHC-luokan II-locien konstitutiivinen ilmentyminen rajoittuu immuunijärjestelmän antigeenejä esitteleviin soluihin (APC:t, esim. makrofagit, dendriittiset solut ja B-lymfosyytit). MHCII-molekyylit stabiloituvat ja estyvät sitoutumasta antigeeniin ollessaan ER:ssä, kun ne assosioituvat luokan II invariantti-ketjun (Ii tai CD74) kanssa, minkä jälkeen ne ohjataan oletusarvoisesti erittävältä reitiltä endosyyttiselle reitille. Siellä ne kohtaavat solunsisäisten vesikkelien sisällä replikoituvista patogeeneistä tai solunulkoisista patogeeneistä ja soluun kuljetettavista proteiineista peräisin olevia peptidejä. Epäklassinen MHCII DMα/β-dimeeri katalysoi vakaan peptidisidoksen, ja sen ansiosta MHCII-peptidikompleksit pääsevät endosyyttisestä reitistä solun pinnalle. CD4+ T-solujen tunnistaminen aktivoi kohde-isäntäsolun stimuloimaan antibakteerisia mekanismeja (makrofageissa) tai käynnistämään vasta-ainetuotannon ja humoraalisen immuunivasteen.
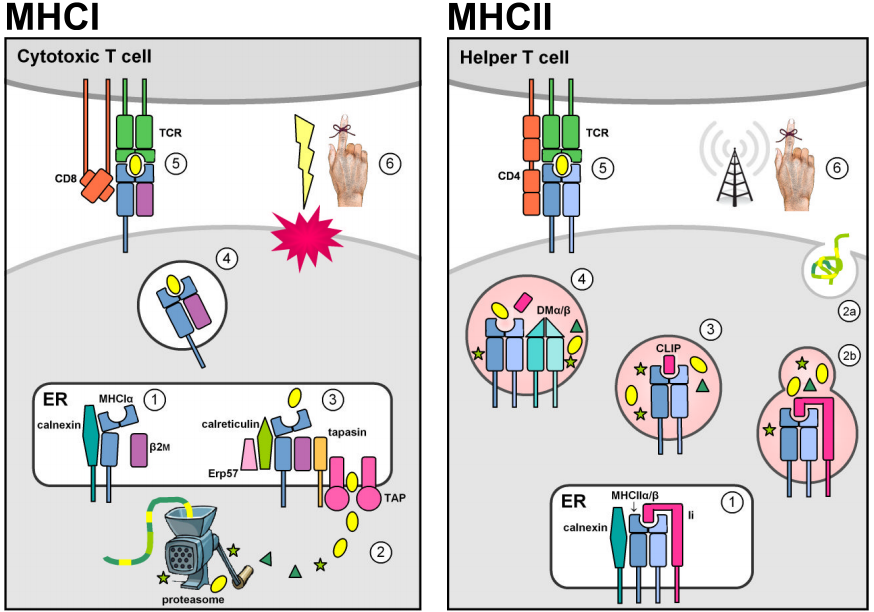
MHCI- ja MHCII-molekyylien rakenteelliset samankaltaisuudet kuvastavat todennäköisesti niiden polveutumista yhteisestä esi-isästä. Kypsät MHC-molekyylit ovat tyypin I integraalisia kalvoglykoproteiineja, jotka koostuvat peptidejä sitovasta urasta ja immunoglobuliinin kaltaisista, transmembraanisista ja sytoplasmisista domeeneista. MHC-molekyylien solunulkoiset osat koostuvat kahdesta membraanin distaalisesta domeenista, jotka yhdessä muodostavat peptidiä sitovan ontelon, jota rajoittavat kaksi keskeytynyttä α-heliksiä, jotka lepäävät antiparalleelisen β-arkin päällä, ja kaksi membraanin proksimaalista immunoglobuliinin kaltaista (Ig:n kaltaista) domeenia, jotka osallistuvat CD4- ja CD8-ydinsolureseptoreiden sitomiseen.
Näistä rakenteellisista yhteneväisyyksistä huolimatta proteiinien alayksiköt koodataan eri tavalla I- ja II-luokan mikroglykosyyttisille ryhmälle. MHCI-molekyylit ovat heterodimeerejä, jotka muodostuvat MHCIα:n raskaan ketjun ja β2-mikroglobuliinin (β2m) välisestä ei-kovalenttisesta assosiaatiosta, jota koodaa MHC-genomialueen ulkopuolella sijaitseva pitkälti muuttumaton lokus. Raskaalla ketjulla on molemmat peptidejä sitovat alueet ja yksi Ig:n kaltainen domeeni, kun taas β2m:llä on vain toinen Ig:n kaltainen alue, josta puuttuu transmembraaniankkuri. MHC-luokan II molekyylit ovat heterodimeerejä, jotka muodostuvat α- ja β-ketjujen ei-kovalenttisesta assosioinnista, sillä kumpikin niistä tuottaa yksittäisiä peptidejä sitovia ja kalvoankkuroituja Ig:n kaltaisia domeeneja, ja kumpikin niistä transkriboituu erilliseltä lokaatiolta, joka tyypillisesti sijaitsee MHC-alueella.
MHC-geeniperheen jäsenet voidaan jakaa edelleen klassisiin tai ei-klassisiin lokuksiin sekä ei-toimiviin pseudogeeneihin. Klassiset MHC Ia -lokukset ilmentyvät laajalti, ja niihin liittyy tyypillisesti suurta sekvenssivaihtelua ja positiivista valikoitumista, joka vaikuttaa peptidiä sitovan alueen (PBR) jäännösten substituutioihin. Ei-klassisten MHC Ib -loosien ekspressio on sen sijaan vähäisempää tai niiden kudosjakauma on rajallinen, polymorfismi on vähäisempää ja niillä voi olla rajoitettuja tai muunneltuja toimintoja. Luokan II geenien osalta ”klassisella” viitataan yleensä kaikkiin antigeenipresentoiviin lokuksiin, kun taas termi ”ei-klassinen” on varattu DMα/β:n kaltaisille geeneille, joilla on liitännäistehtäviä antigeenipresentaatioreitillä. Vaikka tämä geeniperheen jäsenten toiminnallinen luokittelu tarjoaa käyttökelpoisen työsanaston, klassisten ja ei-klassisten lokusten välinen raja ei ole käytännössä aina selvä, ja jotkin ei-klassiset MHCI-lokukset ovat polymorfisia, ekspressoituvat laajalti tai sitovat peptidiligandeja klassisten geenien perinteisellä tavalla.
Populaatiotasolla esiintyvä äärimmäinen polymorfismi ja todisteet tasapainottavasta valikoitumisesta viittaavat siihen, että MHC-geenien huomattavaa alleelivaihtelua tarvitaan todennäköisesti tunnistamaan ja vastaamaan moninaisiin taudinaiheuttajavalintoihin. Huolimatta joissakin lajeissa esiintyvästä laajasta geeniduplikaatiosta yksilöt ilmentävät kuitenkin tyypillisesti vain kohtuullisen määrän klassisia MHC-looseja, ja myös joissakin polyploidisissa Xenopus-lajeissa on havaittu paluuta disomaattiseen perimään. Yksilön sisäisen MHC-variaation rajoitusten (ainakin vahvasti ilmentyneiden klassisten lokusten osalta) uskotaan heijastavan toiminnallista kompromissia, joka perustuu siihen, että allelirepertuaarin kasvattaminen suuremman patogeenisten peptidivalikoiman esittämiseksi vastakohtana on T-solurepertuaarin vähenemiselle, jota tarvittaisiin itsetoleranssin ylläpitämiseksi. Yksittäisten MHC-molekyylien on näin ollen kyettävä sallimaan peptidien sitoutuminen, jotta ne tunnistaisivat riittävästi monenlaisia vieraita antigeenejä. On kuitenkin myös luotava vakaita MHC-peptidikomplekseja, jotka säilyvät riittävän kauan T-solujen tunnistamisen mahdollistamiseksi ja jotka eivät vaihda peptidejä solujen pinnalla, mikä voisi johtaa infektoitumattomien solujen tuhoutumiseen. Tällainen stabiilius liittyy yleensä korkeaan affiniteettiin ja siten rajoittaviin molekyylien välisiin vuorovaikutuksiin.
MHC-molekyylit sovittavat nämä kilpailevat sitoutumisvaatimukset yhteen tyylikkäällä rakenteellisella ratkaisulla: MHC-molekyylin erittäin konservoitujen peptidiä sitovan alueen (PBR) jäännösten ja peptidien pääketjun atomien väliset kontaktit stabiloivat useimpien peptidiligandien promissiivisen sitoutumisen, kun taas peptidiä sitovaa uraa reunustavat polymorfiset jäännökset luovat epäsäännöllisiä taskuja, joilla on erilainen stereokemia ja jotka majoittavat sekvenssistä riippuvalla tavalla peptidijäänteitä. Sivuketjuja sitovien taskujen asettamat rajoitukset vaihtelevat sekä alleelien välillä että taskujen välillä yhden MHC-molekyylin sisällä. Taskujen, jotka asettavat tiukempia sitoutumisvaatimuksia, sanotaan majoittavan ”ensisijaisen ankkurin” peptidijäännöksiä, kun taas ”toissijaiset ankkurit” ovat joustavampia sitoutumispreferensseiltään. Yhdessä nämä spesifisyydet määrittävät tietyn MHC-alleelin peptidiin sitoutuvan motiivin, joka antaa selektiivisyyden antigeenin esittelyssä.